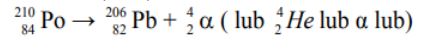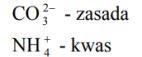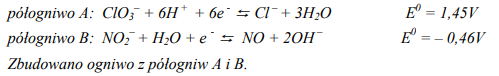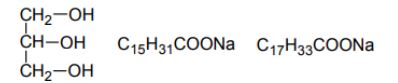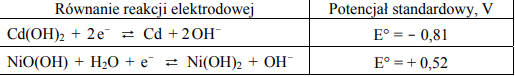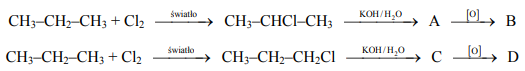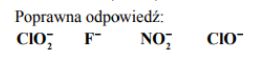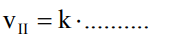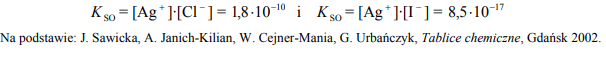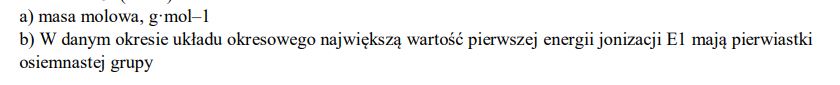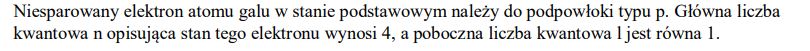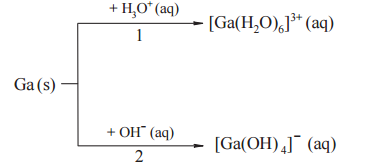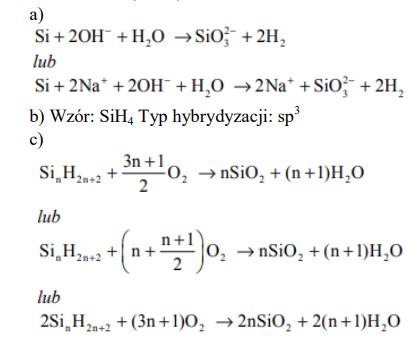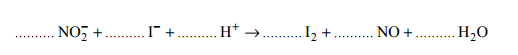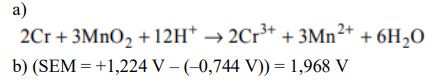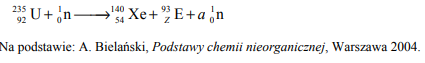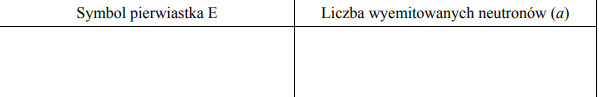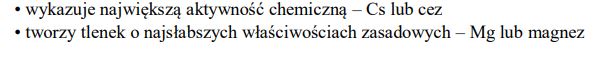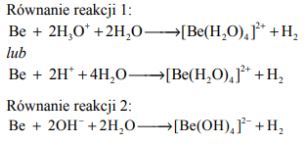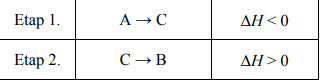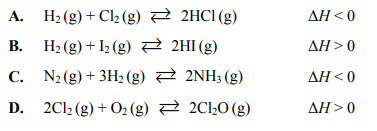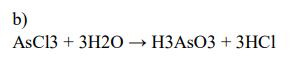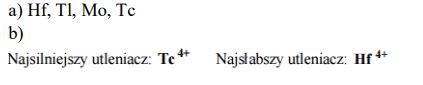Zadania maturalne z Chemii
Tematyka: atomy, cząsteczki, wiązania, pierwiastki, układ okresowy.
Zadania pochodzą z oficjalnych arkuszy maturalnych CKE, które służyły przeprowadzaniu majowych egzaminów. Czteroznakowy kod zapisany przy każdym zadaniu wskazuje na jego pochodzenie: S/N – „stara”/”nowa” formuła; P/R – poziom podstawowy/rozszerzony; np. 08 – rok 2008.
Zbiór zadań maturalnych w formie arkuszy, możesz pobrać >> TUTAJ <<.
Zadanie 70. (SR05)
Polon ulega przemianie α. Okres połowicznego rozpadu tego izotopu wynosi 138 dni.
Napisz równanie tej przemiany.
Zadanie 71. (SR05)
Właściwości fizyczne i chemiczne substancji można określić na podstawie budowy ich cząsteczek. Masa cząsteczkowa etanolu wynosi 46 u, a propanu 44 u, jednak etanol wrze w temperaturze 78°C, a propan w temperaturze -42°C.
Podaj jedną przyczynę tak dużej różnicy temperatur wrzenia tych substancji.
np.: etanol ma budowę polarną, tworzą się asocjaty; między cząsteczkami etanolu (w etanolu) występują oddziaływania międzycząsteczkowe typu dipol-dipol; pomiędzy cząsteczkami etanolu tworzą się wiązania wodorowe; (a propan ma budowę niepolarną; pomiędzy cząsteczkami propanu występują bardzo słabe oddziaływania międzycząsteczkowe; brak wiązań wodorowych między cząsteczkami propanu)
Zadanie 72. (SR05)
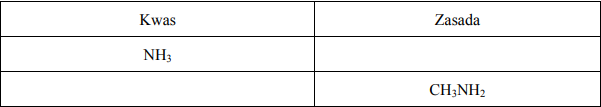
Dane są jony:
Zaklasyfikuj je do kwasów lub zasad według teorii Brönsteda.
Uzasadnij swoją decyzję, pisząc odpowiednie równania reakcji.
Zadanie 73. (SR05)
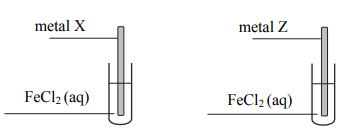
Masz do dyspozycji: blaszkę cynkową, blaszkę miedzianą, roztwór siarczanu(VI) miedzi(II), roztwór siarczanu(VI) cynku.
Zaproponuj doświadczenie, w którym porównasz aktywność miedzi i cynku. W tym celu:
a) przedstaw schematyczny rysunek doświadczenia,
b) opisz przewidywane obserwacje,
c) napisz, w formie jonowej, równanie(-a) zachodzącej(-ych) reakcji, d) sformułuj wniosek wynikający z tego doświadczenia.
b)blaszka cynkowa w roztworze CuSO4 pokrywa się (czerwonobrunatnym) nalotem lub (niebieski) roztwór odbarwia się lub jeżeli blaszkę miedzianą zanurzymy w roztworze ZnSO4 to nie zaobserwujemy żadnych objawów przebiegu reakcji lub następuje zmiana masy blaszki
c)Zn + Cu2+ → Zn2+ + Cu
d) Cynk jest bardziej aktywny od miedzi
Zadanie 74. (SR05)
Podczas elektrolizy wodnego roztworu pewnego elektrolitu na anodzie zachodziła reakcja przedstawiona równaniem:
2H2O → O2 + 4H+ + 4e–
Sumaryczne równanie tego procesu elektrolizy można przedstawić następująco:
2H2O → 2H2 + O2
Napisz jedno równanie reakcji, która mogła przebiegać na katodzie. Podaj przykład substancji (wzór sumaryczny), której wodny roztwór mógł pełnić podczas tego procesu rolę elektrolitu.
2H2O + 2e- → H2 + 2OH-
wzór soli np. Na2SO4
2H+ + 2e- → H2
wzór kwasu tlenowego np. H2SO4
Zadanie 75. (SR05)
Reakcję chemiczną zachodzącą w pewnym ogniwie opisuje równanie:
Przedstaw schemat tego ogniwa i napisz równania reakcji przebiegających w jego półogniwach.
Pt| Sn2+, Sn4+ || Fe3+, Fe2+| Pt
lub zamiast „Pt” – „C(grafit)”
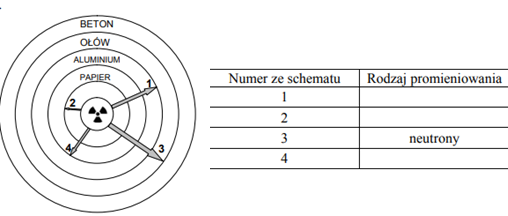
Zadanie 76. (SR06)
Poniższy schemat przedstawia zdolność przenikania przez materię różnych rodzajów promieniowania jonizującego. Wypełnij poniższą tabelę, wpisując obok numeru ze schematu odpowiadający mu rodzaj promieniowania (α, β lub γ).
1. γ
2. α
4. β
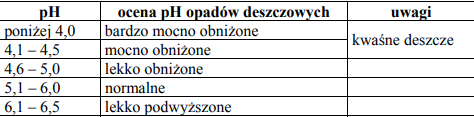
Zadanie 77. (SR06)
W poniższej tabeli podano wartości oraz ocenę pH opadów deszczowych:
W pewnym regionie Polski pobrano próbkę wody deszczowej i przeprowadzono jej analizę. Stwierdzono, że stężenie obecnych w niej jonów wodorowych wynosi 0,00001 mol·dm–3.
Określ pH badanej wody. Korzystając z informacji przedstawionych w tabeli, podaj jego ocenę. Oceń, jak zmieni się pH wody deszczowej w badanym regionie po zainstalowaniu urządzeń do odsiarczania gazów kominowych w elektrociepłowni, w której jako paliwa używano węgla kamiennego.
Wartość pH: 5
Ocena pH: lekko obniżone
pH wzrośnie
Zadanie 78. (SR06)
W silnikach spalinowych – w wysokiej temperaturze – przebiegają różne reakcje uboczne. Powstające spaliny w kontakcie z tlenem ulegają dalszym przemianom. Ze względu na szkodliwość produktów, do najważniejszych należą procesy:
Określ, jak zmieni się (w układzie zamkniętym) ilość produktu w stosunku do ilości substratów:
a) reakcji I, jeśli nastąpi wzrost temperatury
b) reakcji II, jeśli nastąpi wzrost ciśnienia.
a) Ilość produktu wzrośnie.
b) Ilość produktu wzrośnie.
Zadanie 79. (SR06)
Chlor można otrzymać w wyniku reakcji kwasu solnego z manganianem(VII) potasu. Produktami tej reakcji, oprócz chloru, są: chlorek manganu(II), chlorek potasu i woda. Napisz w formie cząsteczkowej równanie tej reakcji i dobierz w nim współczynniki stechiometryczne metodą bilansu elektronowego. Zapisz wzory substancji, które pełnią w tej reakcji rolę utleniacza i reduktora.
– Bilans elektronowy
– Zbilansowane równanie reakcji:
2KMnO4 + 16HCl → 5Cl2 + 2MnCl2 + 2KCl + 8H2O
– Wzór utleniacza: KMnO4
– Wzór reduktora: HCl
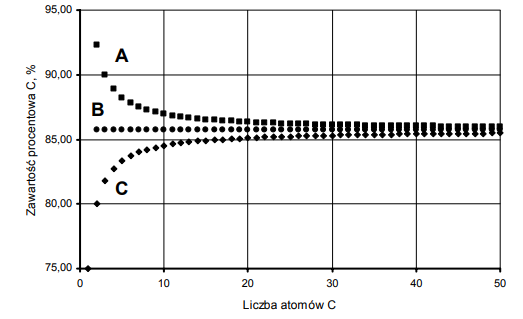
Zadanie 80. (SR06)
Poniżej przedstawiono zależność zawartości węgla (wyrażoną w procentach masowych) w alkanach, alkenach i alkinach od liczby atomów węgla w cząsteczce:
Przyporządkuj wykresom A, B i C nazwy szeregów homologicznych wymienionych w informacji wstępnej.
Wykres A: alkiny
Wykres B: alkeny
Wykres C: alkany
Zadanie 81. (SR07)
Powstawanie pierwiastków we Wszechświecie ilustruje uproszczony ciąg przemian termojądrowych zachodzących na jednym z etapów życia gwiazd. Ustal liczbę atomową, liczbę masową i symbol izotopu X.
Liczba atomowa: 8 Liczba masowa: 16 Symbol: O
Zadanie 82. (SR07)
Uzupełnij poniższą tabelę, wpisując stopnie utlenienia, jakie przyjmuje siarka w związkach chemicznych i jonach o podanych niżej wzorach.
Kolejno: VI, -II, IV, -II
Zadanie 83. (SR07)
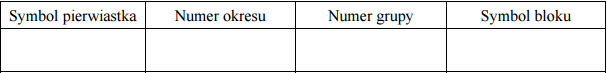
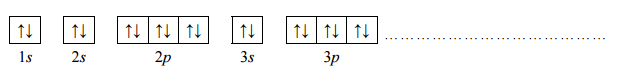
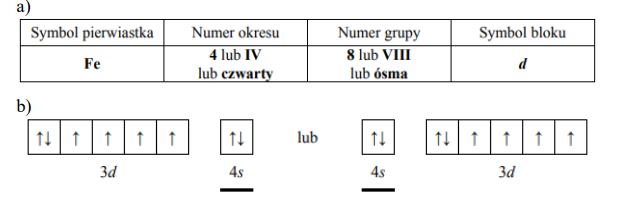
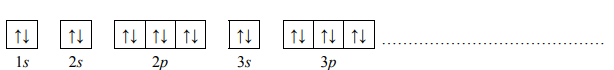
Pierwiastek E leży w układzie okresowym w 7. grupie i 4. okresie. Podaj symbol tego pierwiastka i jego liczbę atomową. Napisz skróconą konfigurację elektronową atomu tego pierwiastka w stanie podstawowym oraz określ dwa najważniejsze stopnie utlenienia, jakie przyjmuje on w związkach chemicznych.
Symbol: Mn
Konfiguracja elektronowa: [Ar]3d5 4s2
Stopnie utlenienia: II, VII
Liczba atomowa: 25
Zadanie 84. (SR07)
Podaj liczbę wiązań σ i liczbę wiązań π w cząsteczce węglowodoru o wzorze:
CH2 = C(CH3) − C ≡ CH
Liczba wiązań σ: 10
Liczba wiązań π: 3
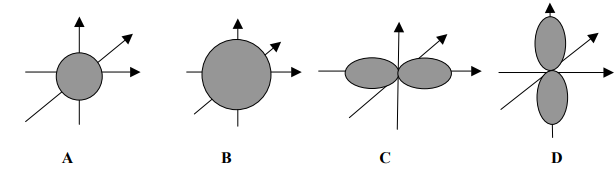
Zadanie 85. (SR07)
Dane są orbitale atomowe oznaczone na rysunkach literami A, B, C i D.
Na podstawie powyższego rysunku uzupełnij poniższe zdania.
- Orbitale oznaczone literami B i C różnią się wartością ………………………………………………….. liczby kwantowej.
- Orbitale o identycznej wartości pobocznej liczby kwantowej, różniące się wartością głównej liczby kwantowej, to orbitale oznaczone literami ……………………. i ……………………..
- Orbitale oznaczone literami …………………. i ………………… różnią się wartością magnetycznej liczby kwantowej.
- Orbitale oznaczone literami B i C różnią się wartością pobocznej liczby kwantowej.
- Orbitale o identycznej wartości pobocznej liczby kwantowej, różniące się wartością głównej liczby kwantowej, to orbitale oznaczone literami A i B.
- Orbitale oznaczone literami C i D różnią się wartością magnetycznej liczby kwantowej.
Zadanie 86. (SR07)
Roztwory ciał stałych mają zwykle wyższą temperaturę wrzenia i niższą temperaturę krzepnięcia niż czysty rozpuszczalnik. Podwyższenie temperatury wrzenia lub obniżenie temperatury krzepnięcia jest tym większe, im większa jest liczba moli drobin (cząsteczek lub jonów) substancji rozpuszczonej w danej ilości rozpuszczalnika. Sporządzono roztwory wodne chlorku sodu, sacharozy, chlorku glinu i siarczanu(VI) sodu, w każdym przypadku rozpuszczając w tej samej ilości wody 1 mol substancji.
Przeanalizuj powyższą informację i podaj nazwę (lub wzór) substancji, której roztwór będzie miał najwyższą temperaturę wrzenia, oraz nazwę (lub wzór) substancji, której roztwór będzie miał najwyższą temperaturę krzepnięcia.
Substancja, której roztwór ma najwyższą temperaturę wrzenia to chlorek glinu.
Substancja, której roztwór ma najwyższą temperaturę krzepnięcia to sacharoza.
Zadanie 87. (SR07)
Przygotowano roztwory wodne następujących substancji: NaNO2, C2H5OH, CH3NH2, NH4Br, CH3ONa Spośród substancji o podanych wyżej wzorach wybierz te, których roztwory mają odczyn zasadowy oraz te, których roztwory mają odczyn kwasowy. Napisz w formie skróconej jonowej równanie reakcji potwierdzającej powstanie kwasowego odczynu roztworu.
Odczyn zasadowy mają roztwory: NaNO3, CH3NH2, CH3ONa.
Odczyn kwasowy mają roztwory: NH4Br.
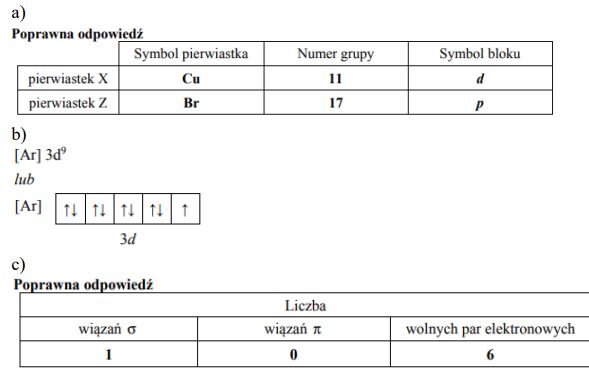
Równanie reakcji
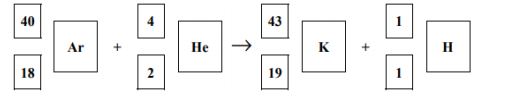
NH4+ + H2O→NH3 +H3O+
Zadanie 88. (SR07)
W przyrodzie występuje kilka minerałów tytanu. Najważniejsze z nich to ilmenit (FeTiO3) i rutyl (TiO2). Czysty metal otrzymuje się z rutylu podczas ogrzewania z węglem i chlorem, w wyniku czego powstaje chlorek tytanu(IV) i tlenek węgla(II). W drugim etapie chlorek tytanu(IV) ogrzewa się w odpowiednich warunkach z magnezem. Czysty tytan lub jego stop o składzie masowym 85% Ti, 8% Al, 7% V stosowny jest np. do wytwarzania implantów. Na podstawie powyższego tekstu napisz równania reakcji przebiegających podczas otrzymywania czystego tytanu.
TiO2 + 2C + 2Cl2 → TiCl4 + 2CO
TiCl4 + 2Mg → Ti + 2MgCl2
Zadanie 89. (SR07)
W półogniwach A i B zachodzą reakcje opisane równaniami:
Na podstawie podanych wartości potencjałów standardowych określ, w którym półogniwie (A czy B) zachodzi proces utlenienia, a w którym redukcji. Napisz w formie jonowej sumaryczne równanie reakcji zachodzącej w ogniwie.
a)
Utlenianie zachodzi w półogniwie: B
Redukcja zachodzi w półogniwie: A
b)
Równanie reakcji zachodzącej w ogniwie:
6NO + 6OH – + ClO3– → 6NO2– + Cl – + 3H2O
Zadanie 90. (SR08)
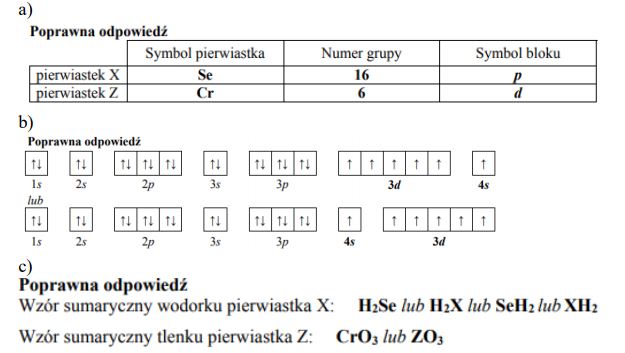
Przeanalizuj położenie selenu w układzie okresowym i określ podstawowe właściwości tego pierwiastka. Uzupełnij poniższą tabelę.
- 4s2 4p4
- -II
- VI
- H2Se
- SeO3
- kwasowy
Zadanie 91. (SR08)
Związki jonowe zbudowane są z jonów dodatnich i ujemnych, które mogą być jedno- lub wieloatomowe.
Z podanego zbioru wybierz i podkreśl wzory tych substancji, które są związkami jonowymi.
Ba(OH)2 CCl4 CH3COOH CO2 H3PO4 KHCO3 Na2SO4 NH4NO3 Rb2O SO3
Ba(OH)2 KHCO3 Na2SO4 NH4NO3 Rb2O
Zadanie 92. (SR08)
Poniżej przedstawiono ciąg przemian.
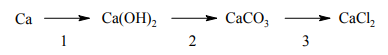
Równanie reakcji 1.: Ca + 2H2O → Ca(OH)2 + H2↑
Równanie reakcji 2.: Ca(OH)2 + CO2 → CaCO3 + H2O
Równanie reakcji 3.: CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
Zadanie 93. (SR08)
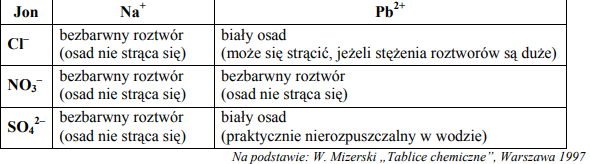
W wyniku badania próbki wody stwierdzono w niej niewielką zawartość jonów ołowiu(II). a) Korzystając z poniższego fragmentu tablicy rozpuszczalności, ustal i zapisz wzór soli sodowej, której wodnego roztworu należy użyć, aby praktycznie całkowicie usunąć jony Pb2+ z badanej wody. Opisz przewidywane obserwacje, uwzględniając barwy użytych i otrzymanych roztworów lub osadów.
Napisz w formie jonowej skróconej równanie zachodzącej reakcji.
a)Wzór soli: Na2SO4
b) Po dodaniu bezbarwnego roztworu Na2SO4 do badanej wody wytrąca się biały osad.
c) Pb2+ + SO42– → PbSO4↓
Zadanie 94. (SR08)
Wskaźnikami pH są słabe kwasy bądź słabe zasady organiczne, które reagując z wodą tworzą układy sprzężone kwas-zasada. Kwasowa i zasadowa postać wskaźnika mają albo różne zabarwienia, albo tylko jedna z nich jest zabarwiona. Wskaźnik (indykator In) o charakterze kwasowym reaguje z wodą w myśl równania:
Gdy stężenie InH jest dużo większe od stężenia In– , roztwór ma barwę charakterystyczną dla postaci kwasowej wskaźnika, gdy zaś stężenie InH jest dużo mniejsze od stężenia In– , roztwór przybiera zabarwienie zasadowej postaci wskaźnika. Przykładem wskaźnika o charakterze kwasowym jest błękit bromotymolowy. W roztworze o pH < 6 przyjmuje on barwę żółtą, a w roztworze o pH > 7,6 barwę niebieską (błękitną).
Na podstawie: Minczewski, Marczenko „Chemia analityczna. Chemiczne metody analizy ilościowej”, Warszawa 1998; Jones, Atkins „Chemia ogólna. Cząsteczki, materia, reakcje”, Warszawa 2004.
a) Napisz wzory wszystkich drobin (cząsteczek i jonów), które są zasadami i kwasami Brönsteda w reakcji zilustrowanej powyższym równaniem.
b) Napisz wyrażenie na stałą równowagi opisanej reakcji.
c) Wskaż postać wskaźnika (InH lub In– ), której stężenie wzrośnie po dodaniu do roztworu mocnej zasady.
d) Określ barwę postaci kwasowej (InH) oraz barwę postaci zasadowej (In– ) błękitu bromotymolowego.
e) Sporządzono bezbarwny wodny roztwór, którego pH zawiera się w przedziale 6 < pH < 7,6.
Określ barwę, jaką roztwór ten uzyska po dodaniu do niego kilku kropli błękitu bromotymolowego.
a)
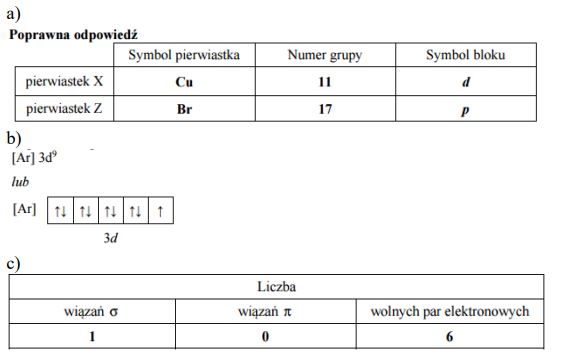
b)
c) In–
d)
e) zielona
Zadanie 95. (SR08)
Sporządzono wodny roztwór propanianu sodu (CH3CH2COONa) i stwierdzono, że ma on odczyn zasadowy.
a) Napisz w formie jonowej skróconej równanie reakcji powodującej zasadowy odczyn roztworu
b) Z podanego zbioru wybierz i podkreśl symbole lub wzory wszystkich drobin (cząsteczek i jonów) obecnych w tym roztworze.
CH3CH2COONa CH3CH2COOH CH3CH2COO– NaOH Na+ OH–
a) CH3CH2COO– + H2O R CH3CH2COOH + OH–
b)CH3CH2COOH CH3CH2COO– Na+ OH–
Zadanie 96. (SR08)
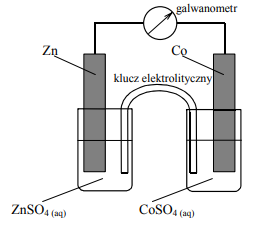
Zbudowano ogniwo według schematu przedstawionego na poniższym rysunku.
a) Korzystając z szeregu elektrochemicznego metali, wskaż półogniwo, które stanowiło ujemny biegun ogniwa. Napisz w formie jonowej skróconej sumaryczne równanie reakcji zachodzącej w czasie pracy ogniwa.
b) Wskaż metal (cynk lub kobalt), który jest silniejszym reduktorem.
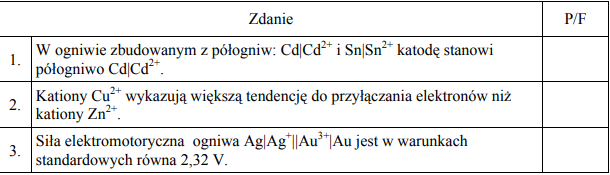
c) Oceń prawdziwość poniższych zdań i uzupełnij tabelę, wpisując literę P, jeżeli uznasz zdanie za prawdziwe, lub literę F, jeżeli uznasz je za fałszywe.
a) Zn/Zn2+
Zn + Co2+ → Zn2+ + Co
b) cynk
c) 1. F
2.P
3.P
4.F
Zadanie 97. (SR08)
Poniżej przedstawiono równania elektrodowe oraz potencjały standardowe dwóch półogniw redoks.
Napisz sumaryczne równanie reakcji, która zajdzie w ogniwie zbudowanym z tych półogniw.
Zadanie 98. (SR08)
Aniony dichromianowe (VI) reagują z anionami jodkowymi w środowisku kwasowym według następującego schematu:
Dobierz współczynniki stechiometryczne w równaniu tej reakcji, stosując metodę bilansu elektronowego.
Równanie reakcji:
Napisz wzór lub symbol jonu, który w tej reakcji pełni rolę utleniacza, i wzór lub symbol jonu, który pełni rolę reduktora.
Zadanie 99. (SR08)
Chemicznie czysta woda nie ulega elektrolizie. Aby umożliwić ten proces, należy w wodzie rozpuścić odpowiednią substancję. Zachodzi wtedy elektrolityczny rozkład wody, którego przebieg ilustruje następujące równanie:
a) Określ funkcję, jaką pełni substancja, którą należy rozpuścić, aby umożliwić elektrolizę wody.
b) Spośród soli, których wzory podano poniżej, wybierz tę, której należy użyć w celu przeprowadzenia elektrolitycznego rozkładu wody. Podkreśl jej wzór.
CuCl2 ZnSO4 NaCl Na2SO4
c) Napisz równania reakcji elektrodowych zachodzących w czasie elektrolitycznego rozkładu wody. (katodowej i anodowej).
a) Substancja ta umożliwia przepływ prądu elektrycznego przez roztwór.
b) Na2SO4
c)
Zadanie 100. (SR09)
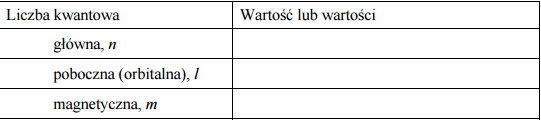
W atomie pewnego pierwiastka w stanie podstawowym trzy spośród elektronów walencyjnych znajdują się na podpowłoce 4p (4p3 ). Opisz stan kwantowo-mechaniczny tych elektronów, wpisując do tabeli odpowiednie wartości trzech liczb kwantowych. Podaj symbol tego pierwiastka i przedstaw w formie skróconej (z symbolem helowca) konfigurację elektronową jego atomu w stanie podstawowym.
a)
Główna liczba kwantowa [n]: 4
Poboczna liczba kwantowa [l]: 1
Magnetyczna liczba kwantowa [m]: -1, 0, 1
b)
Symbol pierwiastka As
Konfiguracja elektronowa: [Ar] 4s2 3d10 4p3 lub [Ar] 3d10 4s2 4p3
Zadanie 101. (SR09)
Korzystając z tabeli rozpuszczalności, zaproponuj sposób usunięcia kationów Ba2+ z roztworu zawierającego jony Ba2+ i Mg2+.
a) Spośród odczynników o podanych niżej wzorach wybierz jeden, który pozwoli usunąć wyłącznie jony Ba2+ , i uzasadnij wybór.
Na2CO3 (aq) Na2SO4 (aq) Na3PO4 (aq)
b) Zapisz w formie jonowej skróconej równanie zachodzącej reakcji.
a) Odczynnik: Na2SO4
Uzasadnienie:
- Jony siarczanowe(VI) powstałe w wyniku dysocjacji Na2SO4 tworzą nierozpuszczalny osad wyłącznie z jonami Ba2+.
- Aniony pozostałych soli tworzą nierozpuszczalne osady zarówno z jonami Ba2+, jak i Mg2+.
b)
Ba2+ + SO4 2– → BaSO4 ↓
Zadanie 102. (SR09)
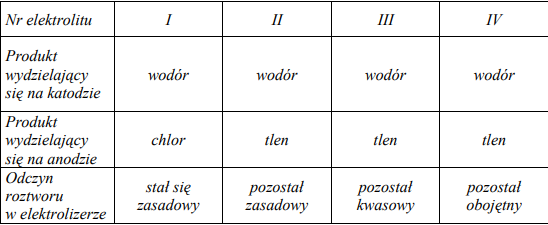
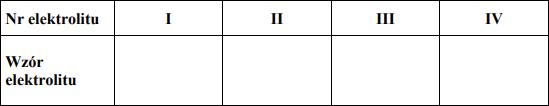
Przeprowadzono elektrolizę wodnych roztworów czterech elektrolitów z użyciem elektrod platynowych. Informacje dotyczące produktów wydzielających się na elektrodach oraz odczynu roztworów w elektrolizerze (po wymieszaniu katolitu z anolitem) przedstawiono w poniższej tabeli.
Spośród związków o podanych niżej wzorach: CuSO4, Na2SO4, H2SO4, HCl, NaCl, NaOH wybierz te elektrolity, których wodne roztwory poddano elektrolizie. Wpisz wzory odpowiednich związków do poniższej tabeli.
I. NaCl
II. NaOH
III. H2SO4
IV. Na2SO4
Zadanie 103. (SR09)
Zapisz równania reakcji zachodzących podczas elektrolizy wodnego roztworu NaOH na elektrodach platynowych.
Równanie reakcji przebiegającej na katodzie: 2H2O + 2e– → H2↑ + 2OH–
Równanie reakcji przebiegającej na anodzie: 4OH– → O2↑ + 2H2O + 4e–
Zadanie 104. (SR09)
Zaprojektuj doświadczenie, które umożliwi redukcję jonów manganianowych (VII) do jonów manganu (II). W tym celu:
a) wybierz potrzebne odczynniki spośród wodnych roztworów: kwasu siarkowego (VI), manganianu (VII) potasu, wodorotlenku potasu, siarczanu (IV) sodu
b) napisz, co zaobserwowano podczas tego doświadczenia.
a) Roztwory manganianu(VII) potasu, kwasu siarkowego(VI) i siarczanu(IV) sodu lub roztwory KMnO4, H2SO4 i Na2SO3.
b) Fioletowy roztwór odbarwia się lub roztwór staje się bezbarwny.
Zadanie 105. (SR09)
Podaj wzory półstrukturalne (grupowe) wszystkich produktów całkowitej hydrolizy zasadowej (w roztworze wodnym NaOH) związku o wzorze:
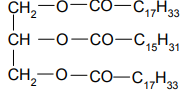
Zadanie 106. (SR10)
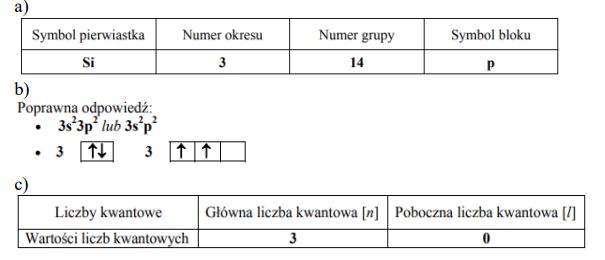
Atomy pierwiastka X tworzą jony X3+, których konfigurację elektronową można zapisać:
1s2 2s2 2p6 3s2 3p6 3d10
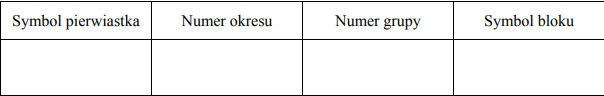
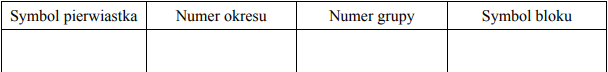
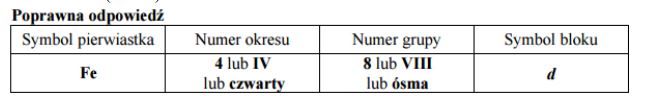
Uzupełnij poniższą tabelę, wpisując symbol pierwiastka X, dane dotyczące jego położenia w układzie okresowym oraz symbol bloku konfiguracyjnego (energetycznego) s, p lub d, do którego należy pierwiastek X.
Symbol pierwiatka: Ga
Numer okresu: 4 lub IV lub czwarty
Numer grupy: 13 lub IIIA lub III główna
Symbol bloku: p
Zadanie 107. (SR10)
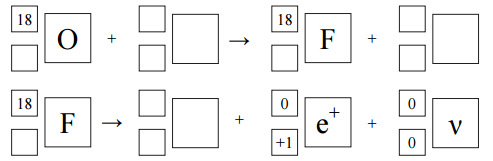
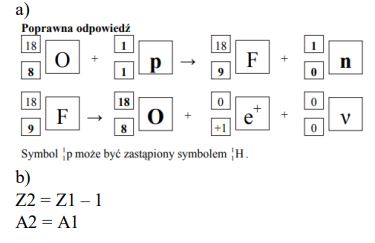
Jednym z pierwszych sztucznie otrzymanych radionuklidów był izotop azotu . Powstał on w wyniku napromieniowania izotopu boru cząstkami α pochodzącymi z naturalnej przemiany promieniotwórczej, jakiej ulega izotop polonu . Napisz równania przemian promieniotwórczych opisanych powyżej.
Zadanie 108. (SR10)
Poniżej podano wzory pięciu związków chemicznych.
CCl4 Li2O SO2 CS2 BaBr2
Podkreśl te wzory, które przedstawiają związki chemiczne występujące w postaci kryształów jonowych (tak jak chlorek sodu), a nie zbiorów cząsteczek.
Li2O , BaBr2
Zadanie 109. (SR10)
Pewna roślina rosnąca na glebie o odczynie kwasowym ma kwiaty w kolorze niebieskim, a gdy odczyn gleby jest zasadowy, jej kwiaty mają zabarwienie różowoczerwone. Gleba, na której posadzono tę roślinę, pierwotnie miała odczyn obojętny, ale do jej użyźnienia zastosowano siarczan(VI) amonu.
a) Określ kolor, na jaki zabarwiły się kwiaty tej rośliny po użyciu siarczanu(VI) amonu
b) Uzasadnij swoją odpowiedź, zapisując w formie jonowej skróconej odpowiednie równanie reakcji.
a) Kwiaty zabarwiły się na kolor niebieski.
b)
Zadanie 110. (SR10)
Do oceny mocy elektrolitu stosuje się stopień dysocjacji oraz stałą dysocjacji, jednak w tablicach chemicznych zwykle podawane są wartości stałej dysocjacji.
Wyjaśnij, dlaczego stała dysocjacji lepiej charakteryzuje moc elektrolitu.
Przykłady poprawnej odpowiedzi
- (Ponieważ) stała dysocjacji nie zależy od stężenia (elektrolitu).
- (Ponieważ) stopień dysocjacji zależy od stężenia (elektrolitu).
Zadanie 111. (SR10)
Aniony dichromianowe(VI) reagują z kationami żelaza(II) w środowisku kwasowym według następującego schematu:
a) Napisz w formie jonowej z uwzględnieniem oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równania procesów redukcji i utleniania dokonujących się w czasie tej reakcji.
b) Dobierz i uzupełnij współczynniki stechiometryczne w poniższym schemacie.
c) Podaj stosunek molowy utleniacza do reduktora.
a)
b)
c) Stosunek molowy utleniacza do reduktora: 1 : 6
Zadanie 112. (SR10)
W poniższej tabeli przedstawiono równania reakcji elektrodowych oraz odpowiadające im wartości potencjałów standardowych dwóch półogniw redoks tworzących tzw. ogniwo niklowo-kadmowe.
a) Korzystając z podanych informacji, napisz sumaryczne równanie reakcji, która zachodzi w pracującym ogniwie niklowo-kadmowym.
b) Oblicz siłę elektromotoryczną (SEM) tego ogniwa w warunkach standardowych.
a)
b)
Zadanie 113. (SR10)
Wilgotne powietrze stanowi środowisko korozyjne, w którym metalowe przedmioty narażone są na zniszczenie. Metale można chronić przed korozją przez powlekanie ich powierzchni innymi metalami. Jeżeli w tym celu zastosuje się metal o potencjale większym od potencjału metalu chronionego (powłoka katodowa), pełne zabezpieczenie uzyskuje się tylko wówczas, gdy powłoka jest całkowicie szczelna. Jeżeli natomiast zastosuje się powłokę wykonaną z metalu o potencjale mniejszym od potencjału metalu chronionego (powłoka anodowa), jej uszkodzenie nie powoduje korozji metalu podłoża. O charakterze danej powłoki metalicznej na stali można wnioskować, porównując wartości standardowych potencjałów odpowiednich elektrod (typu Me/Men+ ).
a) Oceń, który metal (cynk czy miedź) powinien być zastosowany do ochrony przed korozją w wilgotnym powietrzu stalowego przedmiotu narażonego na zarysowania.
b) W niektórych środowiskach następuje zmiana biegunowości układu: metal podłoża – metal powłoki ochronnej, a tym samym zmiana charakteru powłoki. Przykładem może być powłoka cynowa na stali: w wilgotnym powietrzu wykazuje ona charakter katodowy, natomiast w warunkach beztlenowych stanowi powłokę anodową.
Dokończ poniższe zdanie, wpisując właściwą nazwę.
Po mechanicznym uszkodzeniu cynowej powłoki na wewnętrznej stalowej powierzchni zamkniętej puszki z konserwą cyna ulega procesowi ……………………………………………………….. (utleniania /redukcji).
a) wybrany metal: cynk
b) Po mechanicznym uszkodzeniu cynkowej powłoki na wewnętrznej stalowej powierzchni zamkniętej puszki z konserwą cyna ulega procesowi utleniania.
Zadanie 114. (SR10)
Poniżej podano dwa ciągi przemian chemicznych, w wyniku których otrzymano związki organiczne B i D.
Narysuj wzór półstrukturalny (grupowy) związku oznaczonego literą B oraz podaj nazwę systematyczną związku oznaczonego literą D. Stosując podział charakterystyczny dla chemii organicznej, określ typ reakcji, w wyniku których powstały związki oznaczone literami A i C.
a)
b)
(reakcja) podstawienia (nukleofilowego)
(reakcja) substytucji (nukleofilowej)
Zadanie 115. (SR10)
Reakcją pozwalającą wykryć w związkach organicznych grupę
jest próba jodoformowa. Polega ona na reakcji związku organicznego z jodem w obecności NaOH w podwyższonej temperaturze. Po oziębieniu mieszaniny poreakcyjnej do temperatury pokojowej powstaje żółty, krystaliczny osad o charakterystycznym zapachu. Jeżeli badanym związkiem jest propanon (aceton), produktami próby jodoformowej są: trijodometan, etanian sodu (octan sodu), jodek sodu i woda
a) Korzystając z powyższych informacji, uzupełnij schemat, tak aby przedstawiał równanie opisanej reakcji w formie cząsteczkowej (wpisz wzory produktów reakcji i odpowiednie współczynniki stechiometryczne).
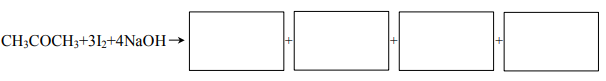
b) Napisz wzór tego produktu przemiany, który tworzy żółty, krystaliczny osad o charakterystycznym zapachu
c) Napisz, czy próba jodoformowa pozwala na odróżnienie propanonu (acetonu) od etanalu, i uzasadnij swoje stanowisko.
a)
b) CHI3
c)Przykłady poprawnej odpowiedzi:
- Nie, ponieważ etanal zawiera również tatą samą grupę.
- Nie, ponieważ etanal zawiera również grupę CH3-CO-
- Nie, ponieważ etanal zawiera również grupę acetylową.
Zadanie 116. (SR10)
Pewien dwufunkcyjny związek organiczny ma masę molową równą 90 g/mol. W jego cząsteczce stosunek liczby atomów węgla, wodoru i tlenu wynosi 1:2:1. Napisz wzór sumaryczny opisanego związku. Wiedząc, że związek ten w roztworze wodnym dysocjuje z odszczepieniem jonu wodorowego oraz że jego cząsteczka jest achiralna, narysuj wzór półstrukturalny (grupowy) tego związku.
a) C3H6O3
b)
Zadanie 117. (SR11)
Pewien pierwiastek X tworzy anion prosty o konfiguracji elektronowej atomu argonu. W stanie podstawowym w powłoce walencyjnej atomu pierwiastka X dwa orbitale p mają niesparowane elektrony. Napisz symbol pierwiastka X oraz podaj konfigurację elektronową powłoki walencyjnej atomu tego pierwiastka.
Symbol pierwiastka X: S
Konfiguracja elektronowa powłoki walencyjnej: 3s2 3p4 lub 3s2 p4
Zadanie 118. (SR11)
Przeanalizuj budowę następujących cząsteczek i jonów: CH4, H3O + , NH3, CO2 i napisz wzór tej drobiny,
a) w której wiążąca para elektronowa pochodzi od jednego atomu
b) w której wszystkie elektrony walencyjne biorą udział w tworzeniu wiązań
c) która ma kształt liniowy.
a)H3O+
b) CH4
c) CO2
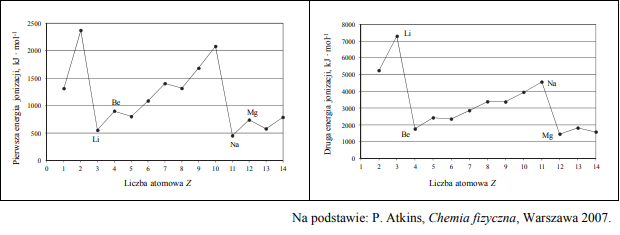
Zadanie 119. (SR11)
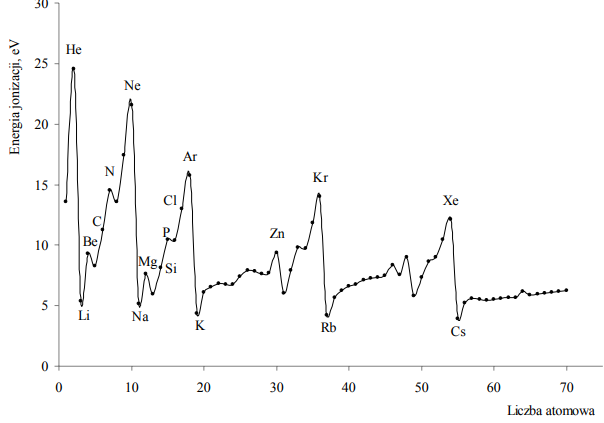
Pierwsza energia jonizacji (Ej) to minimalna energia potrzebna do oderwania jednego elektronu od obojętnego atomu. Na poniższym wykresie przedstawiono zmiany pierwszej energii jonizacji pierwiastków uszeregowanych według liczb atomowych.
Oceń prawdziwość poniższych zdań i uzupełnij tabelę. Wpisz literę P, jeżeli uznasz zdanie za prawdziwe, lub literę F, jeżeli uznasz je za fałszywe.
- P
- F
- F
Zadanie 120. (SR11)
Zgodnie z teorią Brönsteda kwas i sprzężona z nim zasada różnią się o jeden proton, przy czym im silniejszy jest kwas, tym słabsza jest sprzężona z nim zasada.
a) Uzupełnij poniższą tabelę, wpisując wzory brakującej sprzężonej zasady i brakującego sprzężonego kwasu.
b) Korzystając z zamieszczonej powyżej informacji, wskaż najsłabszą spośród następujących zasad:
−Cl , −HS , CH3COO− , C6H5O− .
a)
b) Najsłabszą zasadą jest Cl –
Zadanie 121. (SR11)
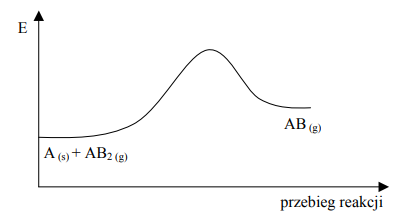
Na poniższym wykresie zilustrowano zmianę energii podczas przebiegu reakcji opisanej równaniem A (s) + AB2 (g) ⇄ 2AB (g).
Oceń, jak zmieni się (wzrośnie czy zmaleje) wydajność reakcji otrzymywania produktu AB, jeżeli w układzie będącym w stanie równowagi nastąpi a) wzrost temperatury w warunkach izobarycznych (p = const) b) wzrost ciśnienia w warunkach izotermicznych (T = const).
a) wzrośnie
b) zmaleje
Zadanie 122. (SR11)
Poniżej przedstawiony jest schemat reakcji:
Napisz w formie jonowej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równania procesów redukcji i utleniania zachodzących podczas tej przemiany.
Dobierz i uzupełnij współczynniki stechiometryczne w poniższym schemacie.
Napisz, jakie funkcje pełnią jony MnO 2-4 w tej reakcji.
a)
b)
Zadanie 123. (SR11)
Oceń prawdziwość poniższych zdań i uzupełnij tabelę. Wpisz literę P, jeżeli uznasz zdanie za prawdziwe, lub literę F, jeżeli uznasz je za fałszywe.
- – F, 2. – P, 3. – F
Zadanie 124. (SR11)
Elektroliza może być prowadzona na elektrodach, które nie biorą udziału w procesach elektrodowych (np. platyna, grafit), lub na elektrodach, które ulegają roztworzeniu w procesie anodowym. Efekt roztwarzania materiału anody wykorzystywany jest do oczyszczania metali w procesie elektrorafinacji.
W celu oczyszczenia miedzi prowadzi się elektrolizę wodnego roztworu siarczanu(VI) miedzi(II) na elektrodach, z których jedną stanowi czysta miedź, a drugą miedź zanieczyszczona. Podczas tego procesu miedź i metale o niższym standardowym potencjale redukcji niż miedź ulegają na anodzie utlenieniu, natomiast na katodzie osadza się czysta miedź. Płyta miedziana zawierająca ok. 98% miedzi zanieczyszczona jest niklem. W celu uzyskania czystej miedzi płytę poddano elektrorafinacji. Korzystając z powyżej informacji, napisz równania wszystkich reakcji, zachodzących na elektrodach podczas elektrorafinacji. Napisz, z jakim biegunem (dodatnim czy ujemnym) źródła prądu stałego połączona jest ta elektroda, której masa wzrasta podczas procesu elektrorafinacji.
Zadanie 125. (SR12)
Związek organiczny X o wzorze sumarycznym C7H6O2 ulega reakcji hydrolizy. Produktami tej reakcji w środowisku kwasowym są związki Y i Z. Substancja Y, jako jedyny przedstawiciel swojego szeregu homologicznego, ma właściwości redukujące. Związek Z w reakcji z chlorkiem żelaza(III) daje związek kompleksowy o fioletowej barwie. a) Podaj nazwy grup związków, do których należą substancje organiczne X, Y i Z. b) Napisz, stosując wzory półstrukturalne (grupowe) związków organicznych, równanie reakcji hydrolizy kwasowej związku organicznego X.
a)
X: estry lub ester
Y: kwasy (karboksylowe) lub kwas (karboksylowy)
Z: fenole lub fenol
b)
Zadanie 126. (SR12)
Atomy pierwiastka X tworzą kationy X2+ o następującej konfiguracji elektronowej:
1s2 2s2 2p6 3s2 3p6 3d10
Podaj symbol pierwiastka X, określ jego położenie w układzie okresowym i blok energetyczny (konfiguracyjny), do którego pierwiastek ten należy.
Symbol pierwiastka: Zn
Numer okresu: 4 lub IV
Numer grupy: 12 lub XII
Symbol bloku: d
Zadanie 126. (SR12)
Pewien orbital atomowy opisują liczby kwantowe o następujących wartościach: główna liczba kwantowa n = 4 poboczna liczba kwantowa l = 2 magnetyczna liczba kwantowa ml = 0 Uzupełnij poniższe zdanie, wybierając symbol podpowłoki, do której należy ten orbital, oraz maksymalną liczbę elektronów na tej podpowłoce. Podkreśl wybrany symbol podpowłoki i liczbę elektronów. Opisany orbital należy do podpowłoki ( 4s / 4p / 4d / 4f ), na której maksymalna liczba elektronów wynosi ( 2 / 6 / 10 / 14 ).
Opisany orbital należy do podpowłoki 4d, na której maksymalna liczba elektronów wynosi 10.
Zadanie 127. (SR12)
Poniżej przedstawiono wzory elektronowe dwóch cząsteczek. Wzór I Wzór II Określ liczbę wiązań σ i π w cząsteczkach, których budowę elektronową ilustrują oba wzory.
Wzór I:
Liczba wiązań σ: 1
Liczba wiązań π: 2
Wzór II:
Liczba wiązań σ: 1
Liczba wiązań π: 0 lub brak
Zadanie 128. (SR12)
Poniższy schemat przedstawia początkowy fragment szeregu promieniotwórczego toru. Numerami w kółkach oznaczono kolejne nuklidy, a strzałkami przemiany jądrowe, jakim te nuklidy ulegają.
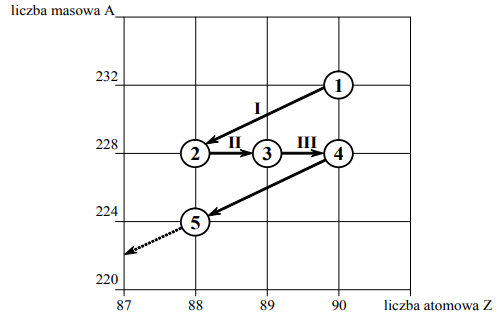
Zadanie 130. (SR12)
W dwóch probówkach znajdowała się woda destylowana o temperaturze 25 ºC. Do probówki I wprowadzono pewną liczbę moli soli A, a do probówki II – taką samą liczbę moli soli B. Stwierdzono, że w probówce I powstały roztwór jest cieplejszy od użytej wody destylowanej, natomiast zawartość probówki II nieco ochłodziła się w czasie rozpuszczania w niej soli B.
Wiedząc, że do przygotowania roztworów użyto chlorku magnezu i azotanu(V) amonu, a standardowe entalpie rozpuszczania w wodzie tych soli wynoszą
napisz wzór soli, której roztwór otrzymano w probówce I.
Reakcja zaszła szybciej w probówce numer I.
Zadanie 131. (SR12)
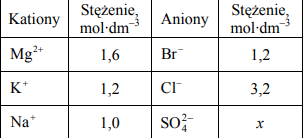
W poniższej tabeli podano wzory wszystkich kationów i anionów, których obecność stwierdzono w badanym roztworze wodnym, oraz wartości stężenia tych jonów – z wyjątkiem anionów siarczanowych(VI).
Wiedząc, że każdy roztwór jest elektrycznie obojętny, ustal wartość stężenia molowego x anionów siarczanowych(VI) w badanym roztworze. Wynik podaj z dokładnością do jednego miejsca po przecinku. Próbkę badanego roztworu (o składzie podanym w tabeli) poddano działaniu chloru. W wyniku reakcji roztwór zabarwił się na kolor żółtopomarańczowy. Substancją, która spowodowała to zabarwienie, była czerwonobrunatna lotna ciecz o charakterystycznym ostrym zapachu. Substancja ta reaguje z większością metali oraz niektórymi niemetalami, a także z nienasyconymi związkami organicznymi. Napisz w formie jonowej skróconej równanie reakcji odpowiedniego składnika badanego roztworu z chlorem, w wyniku której powstała opisana substancja.
a) (x=) 0,5 (mol*dm-3)
b) 2Br – + Cl2 →Br2 + 2Cl–
Zadanie 132. (SR12)
Uzupełnij tabelę, wpisując wartość stężenia jonów OH– oraz wartość pH i pOH roztworu wodnego, w którym stężenie jonów H+ jest równe 10‑ mol·dm–3.
Określ odczyn opisanego roztworu.
a) [OH-], mol·dm–3 = 10–5
pH = 9
pOH = (14-9=)5
b) (odczyn) zasadowy
Zadanie 133. (SR12)
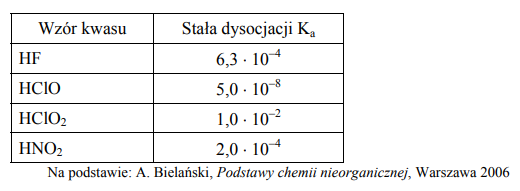
Związek między mocą kwasu Brönsteda i sprzężonej z tym kwasem zasady w roztworach wodnych przedstawia zależność: Ka × Kb = Kw gdzie Ka oznacza stałą dysocjacji kwasu, Kb stałą dysocjacji sprzężonej zasady, a Kw iloczyn jonowy wody, którego wartość wynosi 1,0 × 10–14 w temperaturze 298 K. W poniższej tabeli podano wartości stałej dysocjacji wybranych kwasów w temperaturze 298 K.
Na podstawie powyższej informacji napisz wzory zasad sprzężonych z kwasami wymienionymi w tabeli uporządkowane od najsłabszej do najmocniejszej.
Zadanie 134. (SR12)
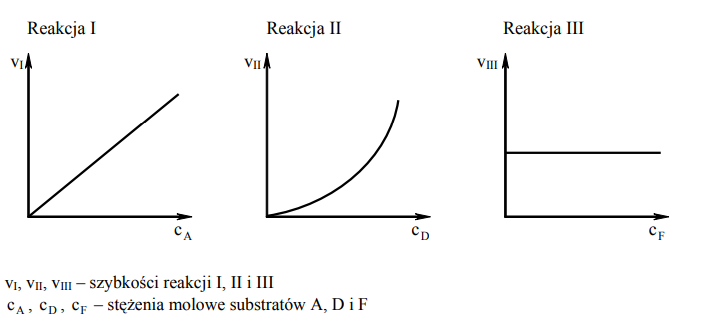
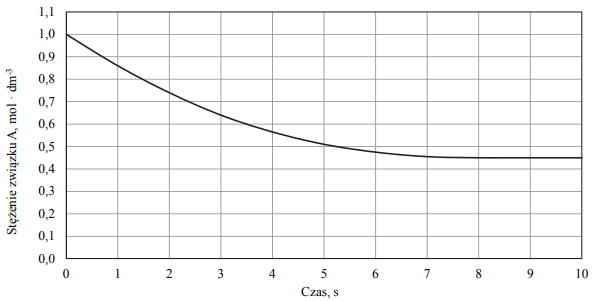
Badano szybkość trzech reakcji chemicznych zachodzących zgodnie z równaniami:
Reakcja I: A → B
Reakcja II: 2D → E
Reakcja III: F + G → H
Na wykresach przedstawiono zależność szybkości tych reakcji od stężeń molowych ich substratów oznaczonych symbolami A, D i F.
Przeanalizuj powyższe wykresy i uzupełnij tabelę, określając rząd reakcji I ze względu na substrat A oraz rząd reakcji III ze względu na substrat F.
Zadanie 135. (SR12)
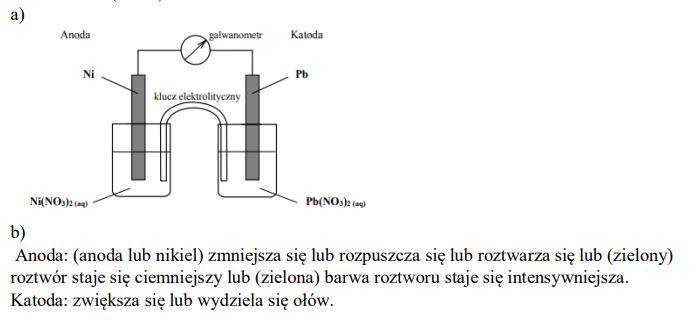
Zaprojektuj ogniwo galwaniczne, w którym półogniwo Ni│Ni2+ będzie pełnić funkcję anody. a) Uzupełnij poniższy schemat, wpisując symbole lub wzory odczynników wybranych spośród następujących:
Opisz zmiany, jakie będzie można zaobserwować w półogniwach podczas pracy ogniwa.
Zadanie 136. (SR13)
Z konfiguracji elektronowej atomu w stanie podstawowym pierwiastka X wynika, że w tym atomie: · elektrony rozmieszczone są na trzech powłokach elektronowych · w powłoce walencyjnej liczba elektronów sparowanych jest równa liczbie elektronów niesparowanych.
a) Uzupełnij poniższą tabelę, wpisując symbol chemiczny pierwiastka X, dane dotyczące jego położenia w układzie okresowym oraz symbol bloku konfiguracyjnego (energetycznego), do którego należy pierwiastek X.
b) Napisz fragment konfiguracji elektronowej atomu pierwiastka X opisujący rozmieszczenie w podpowłokach elektronów walencyjnych
c) Dla jednego ze sparowanych elektronów walencyjnych podaj wartości dwóch charakteryzujących go liczb kwantowych: głównej i pobocznej. Obie wartości wpisz do tabeli.
Zadanie 137. (SR13)
Na podstawie budowy atomów pierwiastków należących do 16. i 17. grupy i trzeciego okresu układu okresowego uzupełnij poniższe zdania. Wybierz i podkreśl jedno z określeń podanych w nawiasie, tak aby powstały zdania prawdziwe. Jądro atomu fluorowca ma ładunek ( mniejszy / większy ) niż jądro atomu tlenowca. Atom fluorowca ma ( mniejszy / większy ) promień atomowy niż atom tlenowca. Tlenowiec jest ( bardziej / mniej ) aktywny chemicznie od fluorowca.
Zadanie 138. (SR13)
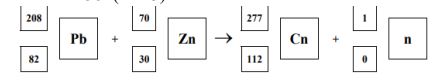
Na cześć wybitnego polskiego astronoma Mikołaja Kopernika pierwiastek o liczbie atomowej 112 otrzymał nazwę copernicium i symbol Cn. Reakcja prowadząca do otrzymania tego pierwiastka zachodzi pomiędzy jądrami 208Pb i 70 Zn Towarzyszy jej emisja pewnej cząstki wchodzącej w skład atomu. Napisz równanie opisanej reakcji jądrowej.
Zadanie 139. (SR13)
W teorii orbitali molekularnych powstawanie wiązań chemicznych typu σ lub p wyjaśnia się, stosując do opisu tych wiązań orbitale cząsteczkowe odpowiedniego typu (σ lub p), które można utworzyć w wyniku właściwego nakładania odpowiednich orbitali atomowych atomów tworzących cząsteczkę. Dane są cząsteczki: Cl2, H2, HF Ustal, nakładanie jakich orbitali atomowych (s czy p) obu atomów należy koniecznie uwzględnić, aby wyjaśnić tworzenie wiązań typu s w tych cząsteczkach. W tym celu przyporządkuj każdej literze a, b, c jeden ze wzorów: Cl2, H2, HF.
a) orbital s jednego atomu – orbital s drugiego atomu
b) orbital s jednego atomu – orbital p drugiego atomu
c) orbital p jednego atomu – orbital p drugiego atomu .
Zadanie 140 (SR13)
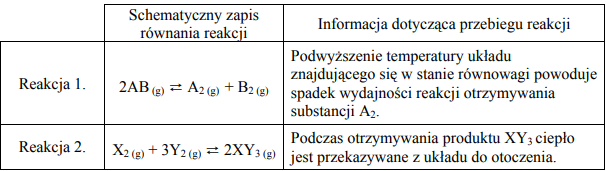
W poniższej tabeli podano schematyczne zapisy równań i informacje o przebiegu dwóch reakcji chemicznych.
Na podstawie powyższego opisu określ typ reakcji 1. i typ reakcji 2. ze względu na ich efekt cieplny. Wskaż numer reakcji, której wydajność nie zmieni się po zmianie ciśnienia panującego w układzie.
Zadanie 141. (SR13)
Poniżej przedstawiony jest schemat reakcji:
Napisz w formie jonowej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równanie reakcji redukcji i równanie reakcji utleniania zachodzących podczas tej przemiany.
Uzupełnij współczynniki stechiometryczne w poniższym schemacie.Napisz, jaką funkcję (utleniacza czy reduktora) pełni w tej reakcji nadtlenek wodoru.
Zadanie 142. (SR13)
W 1 dm3 pewnego wodnego roztworu znajdowało się 1,0* 10-10 × mola jonów Cl– , 1,0* 10- 10× mola jonów I– oraz jony Na+ . Do roztworu wprowadzono kroplę roztworu AgNO3 zawierającą 1,0* 10-5 × mola tej soli. Iloczyny rozpuszczalności AgCl i AgI w temperaturze T, w której przeprowadzono doświadczenie, wynoszą:
Napisz w formie jonowej skróconej równanie reakcji, która zaszła jako pierwsza podczas opisanego doświadczenia.
Oceń, czy w temperaturze T może istnieć roztwór, w którym iloczyn stężeń molowych kationów srebra i anionów chlorkowych wynosiłby 2*5-10 . Uzasadnij swoje stanowisko.
Do wodnego roztworu zawierającego aniony chlorkowe ( Cl-) i cząsteczki amoniaku (NH3) wprowadzono roztwór zawierający kationy srebra (Ag+ ). Nie zaobserwowano jednak wytrącenia osadu, który świadczyłby o powstaniu chlorku srebra (AgCl). Wynika to z faktu, że dla jonów Ag+ reakcją uprzywilejowaną w stosunku do reakcji tworzenia AgCl jest reakcja tworzenia jonu kompleksowego o liczbie koordynacyjnej 2, w którym rolę ligandów pełnią cząsteczki amoniaku. Napisz w formie jonowej równanie reakcji prowadzącej do powstania opisanego jonu kompleksowego.
Zadanie 143. (SR14)
Na rysunku przedstawiono schemat układu okresowego pierwiastków (bez lantanowców i aktynowców), na którym umieszczono strzałki A i B odpowiadające kierunkom zmian wybranych wielkości charakteryzujących pierwiastki chemiczne.
Podkreśl wszystkie wymienione poniżej wielkości, których wzrost wskazują strzałki oznaczone literami A i B. 1.
Dla pierwiastków 1. grupy strzałka A wskazuje kierunek wzrostu najwyższego stopnia utlenienia promienia atomowego promienia jonowego 2.
Dla pierwiastków grup 1.–2. i 13.–17. okresu III strzałka B wskazuje kierunek wzrostu najwyższego stopnia utlenienia promienia atomowego charakteru metalicznego
Zadanie 144. (SR14)
Na poniższym schemacie układu okresowego pierwiastków (bez lantanowców i aktynowców) zaznaczono położenie trzech pierwiastków oznaczonych numerami I, II oraz II.
Wypełnij tabelę, wpisując literę P, jeżeli informacja jest prawdziwa, lub literę F, jeżeli jest fałszywa.
Zadanie 145. (SR14)|
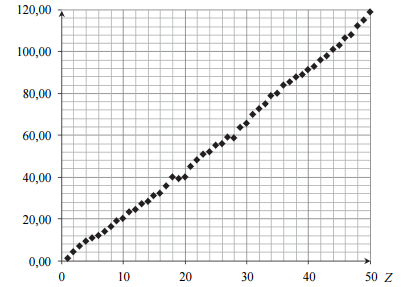
Na poniższym wykresie przedstawiono zależność pewnej makroskopowej wielkości charakteryzującej pierwiastki chemiczne w funkcji ich liczby atomowej Z.
Opisz oś pionową wykresu, podając nazwę tej wielkości oraz jednostkę, w jakiej jest ona wyrażana.
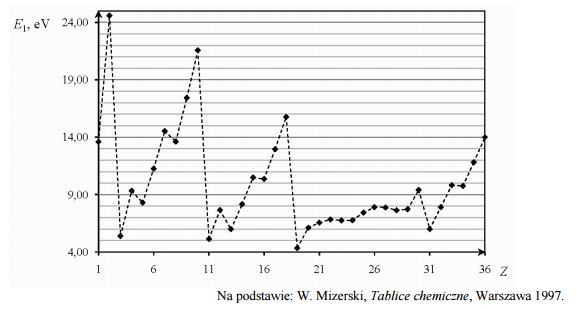
Pierwsza energia jonizacji E1 to najmniejsza energia potrzebna do oddzielenia pierwszego (o najwyższej energii) elektronu od atomu. Poniższy wykres przedstawia zależność pierwszej energii jonizacji atomów pierwiastków z czterech pierwszych okresów układu okresowego od liczby atomowej Z tych pierwiastków.
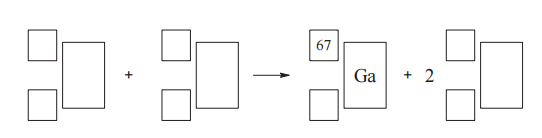
Uzupełnij zdanie. Wybierz i podkreśl numer grupy pierwiastków spośród podanych w nawiasie. W danym okresie układu okresowego największą wartość pierwszej energii jonizacji E1 mają pierwiastki (pierwszej / trzeciej / siedemnastej / osiemnastej) grupy.
Zadanie 146. (SR14)
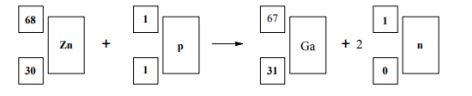
Radioaktywny izotop galu o liczbie masowej równej 67 jest stosowany w medycynie nuklearnej. Otrzymuje się go w reakcji zachodzącej podczas bombardowania protonami jąder izotopu cynku o liczbie masowej równej 68. Napisz równanie opisanego procesu, uzupełniając poniższy schemat.
Zadanie 147. (SR14)
W stanie podstawowym atom galu ma jeden niesparowany elektron. Uzupełnij zdania. Wybierz i podkreśl symbol typu podpowłoki oraz wartość głównej i pobocznej liczby kwantowej spośród podanych w nawiasach. Niesparowany elektron atomu galu w stanie podstawowym należy do podpowłoki typu (s / p / d). Główna liczba kwantowa n opisująca stan tego elektronu wynosi (2 / 3 / 4), a poboczna liczba kwantowa l jest równa (0 / 1 / 2 / 3).
Zadanie 148. (SR14)
Gal jest metalem, który roztwarza się w mocnych kwasach oraz mocnych zasadach. W reakcjach tych tworzy sole, przechodząc na stopień utlenienia III. Drugi produkt tych reakcji jest taki sam jak w reakcjach glinu z mocnymi kwasami i zasadami. Poniżej przedstawiono schemat reakcji galu z mocnymi kwasami i zasadami.
Napisz w formie jonowej skróconej równania reakcji oznaczonych numerami 1 i 2.
Zadanie 149. (SR15)
Poniżej wymieniono symbole sześciu pierwiastków.
In Sn Sb Te I Xe
Wybierz i podkreśl w każdym nawiasie poprawne uzupełnienie poniższego tekstu. Pierwiastki, których symbole wymieniono powyżej, stanowią w układzie okresowym pierwiastków fragment (III okresu / V okresu / 3. grupy / 5. grupy) i należą do bloku konfiguracyjnego (s / p / d). Atomy tych pierwiastków mają w stanie podstawowym jednakowe rozmieszczenie elektronów walencyjnych w podpowłoce (4d / 5s / 5p), a różnią się rozmieszczeniem elektronów walencyjnych w podpowłoce (4d / 5s / 5p). Największą liczbę elektronów walencyjnych ma atom (indu / antymonu / jodu / ksenonu).
Zadanie 150. (SR15)
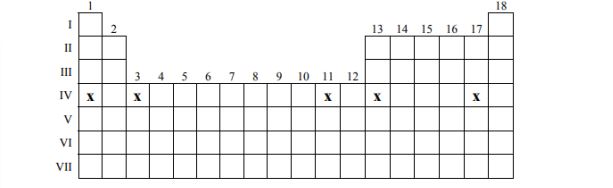
Zaznacz wszystkie pierwiastki należące do IV okresu, które spełniają następujący warunek: w powłoce walencyjnej atomu pierwiastka w stanie podstawowym tylko jeden elektron jest niesparowany. Wstaw znaki x w poniższym fragmencie układu okresowego.
Zadanie 152. (SR15)
Uzupełnij poniższą tabelę − wpisz wszystkie wartości wymienionych w niej liczb kwantowych, które opisują stan elektronów podpowłoki 3d.
Zadanie 153. (SR15)
Na trwałość jądra atomowego ma wpływ stosunek liczby neutronów do liczby protonów. Kiedy jądro ma nadmiar protonów, w jego wnętrzu może zajść przemiana β+, w której z protonu powstają neutron, pozyton i neutrino.
Pozyton, e+ , jest cząstką różniącą się od elektronu tylko znakiem ładunku elektrycznego. Bezwzględna wartość ładunku oraz masa obydwu cząstek są jednakowe. Neutrino, ν, jest nienaładowaną elektrycznie cząstką o masie spoczynkowej bliskiej zeru.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010 oraz A. Czerwiński, Energia jądrowa i promieniotwórczość, Warszawa 1998.
Pozytonowa tomografia emisyjna jest metodą diagnostyki medycznej, w której wykorzystuje się strumień pozytonów. Ich źródłem może być sztuczny radioizotop fluoru 18F . Izotop ten otrzymuje się przez napromieniowanie protonami izotopu tlenu 18O . Napisz równania opisanych reakcji − uzupełnij poniższe schematy.
Jądro o liczbie atomowej Z1 i liczbie masowej A1 uległo przemianie β+, w której wyniku powstało jądro o liczbie atomowej Z2 i liczbie masowej A2. Spośród podanych zależności wybierz i podkreśl te, które są prawdziwe dla Z1 i Z2 oraz dla A1 i A2.
Z2 = Z1 – 1
Z2 = Z1
Z2 = Z1 + 1
A2 = A1 – 1
A2 = A1
A2 = A1 + 1
Zadanie 154. (SR15)
Jodyna jest preparatem o działaniu odkażającym. Aby otrzymać 100,0 gramów jodyny, miesza się 3,0 gramy jodu, 1,0 gram jodku potasu, 90,0 gramów etanolu o stężeniu 96% masowych (pozostałe 4% masy stanowi woda) oraz 6,0 gramów wody. Powstała mieszanina jest ciemnobrunatnym roztworem. Jod rozpuszczony w etanolu ma ograniczoną trwałość. Reaguje z wodą obecną w roztworze, tworząc jodowodór i kwas jodowy(I) o wzorze HIO, który z kolei utlenia etanol najpierw do aldehydu, a następnie − do dalszych produktów. Aby zapobiec tym przemianom, do jodyny dodaje się rozpuszczalny w wodzie jodek potasu. W wyniku reakcji jodu cząsteczkowego z jonami jodkowymi powstają trwałe jony trijodkowe, dzięki czemu jod nie reaguje z wodą.
Na podstawie: http://www.doz.pl, A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010 oraz R.T. Morrison, R.N. Boyd, Chemia organiczna, t. 1, Warszawa 2008.
Napisz w formie cząsteczkowej równanie reakcji jodu z wodą oraz podaj wzór utleniacza i reduktora.
Poniżej przedstawiono schemat reakcji kwasu jodowego(I) z etanolem.
Napisz w formie jonowej z uwzględnieniem oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równanie reakcji redukcji i równanie reakcji utleniania zachodzących podczas tej przemiany.
Narysuj wzór elektronowy kwasu jodowego(I) HIO. Zaznacz kreskami wiązania chemiczne i wolne pary elektronowe.
Zadanie 155. (SR15)
Krzem ulega reakcji z roztworami wodorotlenków litowców, w wyniku czego tworzy krzemiany litowców o wzorze ogólnym Me2SiO3. Krzem tworzy z wodorem związki zwane silanami, których struktura jest analogiczna do struktury węglowodorów nasyconych i wyraża się ogólnym wzorem SinH2n + 2. Cząsteczka najprostszego silanu zawiera jeden atom krzemu. Wszystkie silany są nietrwałe w obecności tlenu – ich pary zapalają się w zetknięciu z powietrzem.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Napisz w formie jonowej równanie reakcji krzemu z zasadą sodową.
Napisz wzór sumaryczny najprostszego silanu. Określ typ hybrydyzacji walencyjnych orbitali atomowych atomu krzemu w cząsteczce tego związku.
Napisz, stosując wzór ogólny silanów, równanie reakcji ich całkowitego spalania.
Zadanie 156. (SR16)
Z konfiguracji elektronowej atomu (w stanie podstawowym) pierwiastka X wynika, że w tym atomie:
- elektrony rozmieszczone są na czterech powłokach elektronowych
- na podpowłoce 3d liczba elektronów sparowanych jest dwa razy mniejsza od liczby elektronów niesparowanych.
Uzupełnij poniższą tabelę – wpisz symbol pierwiastka X, dane dotyczące jego położenia w układzie okresowym oraz symbol bloku konfiguracyjnego (energetycznego), do którego należy pierwiastek X.
Uzupełnij poniższy zapis (stosując schematy klatkowe), tak aby przedstawiał on konfigurację elektronową atomu w stanie podstawowym pierwiastka X. W zapisie tym uwzględnij numery powłok i symbole podpowłok. Podkreśl ten fragment konfiguracji, który nie występuje w konfiguracji elektronowej jonu X2+ (stan podstawowy).
Zadanie 157. (SR16)
Wpisz do tabeli wartości trzech liczb kwantowych, które opisują stan kwantowo-mechaniczny elektronów podpowłoki 3d.
Zadanie 158. (SR16)
Promieniotwórczy izotop potasu 43K można otrzymać przez bombardowanie jąder izotopu argonu 40Ar cząstkami α.
Na podstawie: A. Czerwiński, Energia jądrowa i promieniotwórczość, Warszawa 1998.
Napisz równanie opisanej reakcji jądrowej, w wyniku której można otrzymać izotop potasu 43K.
Zadanie 159. (SR16)
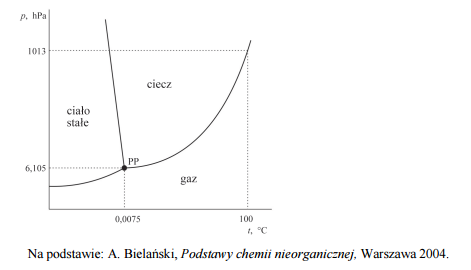
Poniżej przedstawiono diagram fazowy wody. Diagram ten określa wartości ciśnienia i temperatury, w których trwała jest dana faza (stała, ciekła, gazowa). Linie ciągłe wyznaczają warunki, w których ustala się równowaga między dwiema fazami. Trzy fazy współistnieją w stanie równowagi jedynie w punkcie potrójnym PP (p = 6,105 hPa, t = 0,0075 oC).
Na podstawie diagramu fazowego wody uzupełnij poniższe zdania. W zdaniu 1. wybierz i zaznacz jedno określenie spośród podanych w nawiasie, a w zdaniu 2. wpisz wartość temperatury.
- Temperatura wrzenia wody przy zmianie ciśnienia zewnętrznego z 1013 hPa do 900 hPa (nie ulega zmianie / wzrasta / maleje).
- Temperatura, poniżej której – przy odpowiednim ciśnieniu – możliwa jest sublimacja lodu, jest równa …………………….. o C.
Zadanie 160. (SR16)
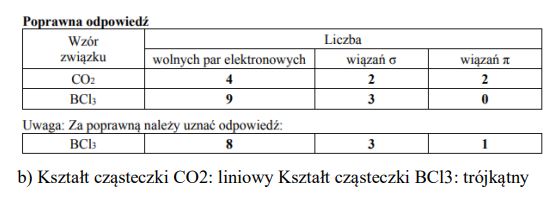
Uzupełnij poniższą tabelę − wpisz liczbę wolnych par elektronowych oraz liczbę wiązań σ i π w cząsteczkach CO2 i BCl3.
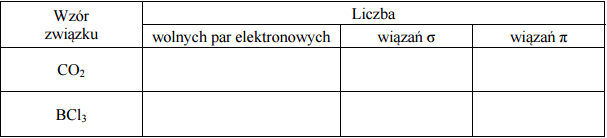
Zadanie 161. (SR16)
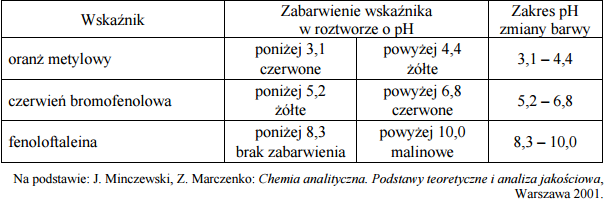
Wskaźniki kwasowo-zasadowe to związki chemiczne, które przyjmują różne zabarwienia w roztworach o różnych odczynach. Barwa roztworu zależy od formy, w jakiej wskaźnik występuje w roztworze. Dla każdego wskaźnika można określić charakterystyczny zakres pH, w którym następuje zmiana zabarwienia wskaźnika. Poniżej scharakteryzowano trzy wskaźniki kwasowo-zasadowe.
Oceń, czy poniższe zdanie jest prawdziwe. Odpowiedź uzasadnij. Oranż metylowy w roztworach o odczynie kwasowym barwi się na czerwono, w roztworach o odczynie obojętnym barwi się na pomarańczowo, a w roztworach o odczynie zasadowym – na żółto.
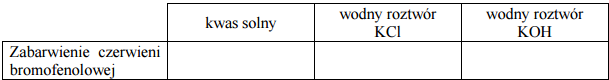
W trzech nieoznakowanych probówkach umieszczono następujące roztwory:
- kwas solny o pH = 1
- wodny roztwór KCl o pH = 7
- wodny roztwór KOH o pH = 13
W celu identyfikacji roztworów wykonano doświadczenie. W etapie I obserwowano zabarwienie czerwieni bromofenolowej w każdym z nich.
Określ zabarwienie czerwieni bromofenolowej w każdym z badanych roztworów.
Spośród scharakteryzowanych wskaźników wybierz ten, którego należy użyć w II etapie doświadczenia, aby (uwzględniając wynik I etapu) zidentyfikować każdy badany roztwór.
Zmiany struktury oranżu metylowego podczas zmiany pH roztworu ilustruje poniższy schemat.
Formy I i II oranżu metylowego stanowią sprzężoną parę kwas – zasada Brønsteda.
Określ funkcję (kwas albo zasada Brønsteda), jaką w przemianie opisanej powyższym schematem pełni oranż metylowy w formie I.
Napisz, jaką barwę nadaje roztworowi oranż metylowy występujący w formie II.
Zadanie 162. (SR17)
Dwa pierwiastki umownie oznaczone literami X i Z leżą w czwartym okresie układu okresowego pierwiastków. Ponadto wiadomo, że w stanie podstawowym:
- atom pierwiastka X ma na ostatniej powłoce sześć elektronów;
- atom pierwiastka Z ma łącznie na ostatniej powłoce i na podpowłoce 3d sześć elektronów.
Uzupełnij poniższą tabelę. Wpisz symbole pierwiastków X i Z, dane dotyczące ich położenia w układzie okresowym oraz symbol bloku konfiguracyjnego, do którego należy każdy z pierwiastków.
Wybierz ten pierwiastek (X albo Z), którego atomy w stanie podstawowym mają większą liczbę elektronów niesparowanych. Uzupełnij poniższy zapis, tak aby przedstawiał on konfigurację elektronową atomu w stanie podstawowym wybranego pierwiastka. Zastosuj schematy klatkowe, podaj numery powłok i symbole podpowłok.
Zadanie 163. (SR17)
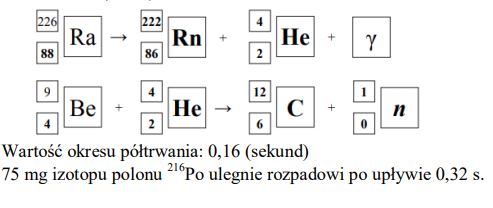
Izotop radu- 226 ulega rozpadowi α. Tej przemianie towarzyszy emisja promieniowania γ. Cząstki α emitowane przez rad mogą służyć do wybijania neutronów z lekkich jąder, np. berylu 9Be.
Na podstawie: A. Czerwiński, Energia jądrowa i promieniotwórczość, Warszawa 1998.
Napisz równania opisanych przemian jądrowych. Uzupełnij wszystkie pola w poniższych schematach.
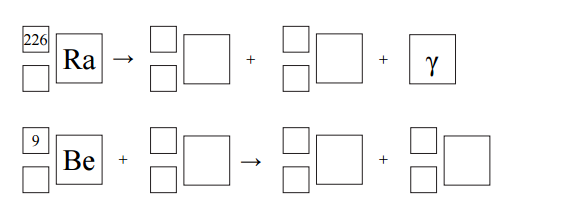
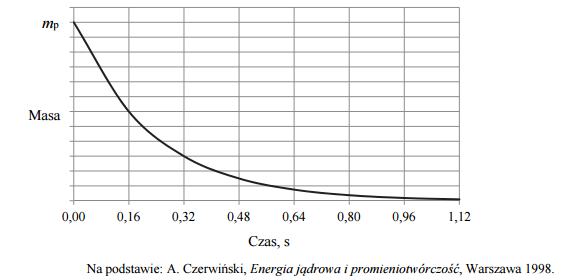
Odczytaj z wykresu wartość okresu półtrwania izotopu polonu 216Po . Określ, po ilu sekundach w próbce zawierającej 100 mg izotopu polonu 216Po ulegnie rozpadowi 75 mg tego izotopu.
Zadanie 164. (SR17)
W poniższej tabeli zestawiono wybrane właściwości pewnej substancji.

Zadanie 165. (SR17)
Reakcja jonów jodkowych z jonami azotanowymi(III) w środowisku kwasowym przebiega według schematu:
Napisz w formie jonowej z uwzględnieniem oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równanie procesu redukcji i równanie procesu utleniania zachodzących podczas tej przemiany. Uwzględnij fakt, że ta reakcja zachodzi w środowisku kwasowym.
Uzupełnij schemat reakcji jonów jodkowych z jonami azotanowymi(III) w środowisku kwasowym – wpisz współczynniki stechiometryczne
Zadanie 166. (SR17)
Zbudowano ogniwo złożone z następujących półogniw:

Oblicz siłę elektromotoryczną opisanego ogniwa w warunkach standardowych.
Zadanie 167. (SR18)
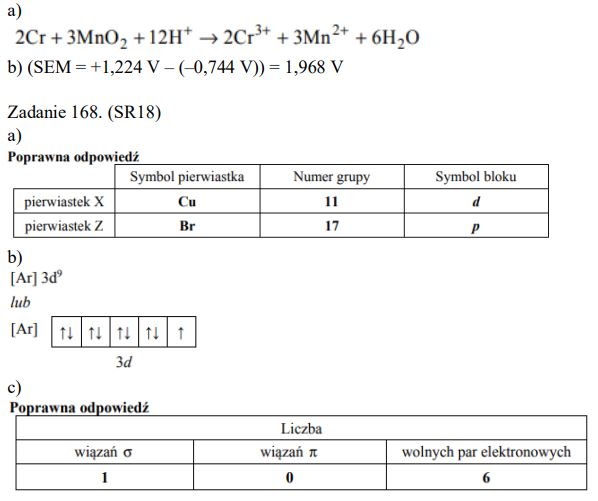
Pierwiastki X i Z leżą w czwartym okresie układu okresowego. Pierwiastek X jest metalem, natomiast pierwiastek Z – niemetalem. W stanie podstawowym atomów obu tych pierwiastków tylko jeden elektron jest niesparowany. Znajduje się on na ostatniej powłoce. Niesparowany elektron atomu pierwiastka X znajduje się na innej podpowłoce niż niesparowany elektron atomu pierwiastka Z. Ponadto wiadomo, że pierwiastek X tworzy tlenki o wzorach X2O i XO oraz że ten metal jest jednym z najlepszych przewodników ciepła i elektryczności. Pierwiastek Z występuje w postaci dwuatomowych cząsteczek.
Zadanie 168. (SR18)
Uzupełnij poniższą tabelę. Wpisz symbole pierwiastków X i Z, dane dotyczące ich położenia w układzie okresowym oraz symbol bloku konfiguracyjnego, do którego należy każdy z pierwiastków.
Przedstaw konfigurację elektronową jonu X2+ (stan podstawowy). Zastosuj skrócony zapis konfiguracji elektronowej z symbolem gazu szlachetnego.
Dla cząsteczki Z2 określ liczbę: wiązań σ, wiązań π oraz wolnych par elektronowych.
Zadanie 169. (SR18)
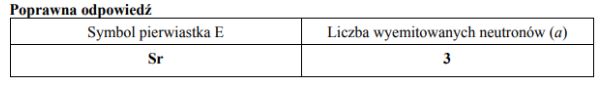
Jądra atomowe niektórych izotopów ciężkich pierwiastków bombardowane neutronami ulegają rozszczepieniu, czyli rozpadowi na mniejsze fragmenty. Jedną z możliwych reakcji rozszczepienia jądra 235U przedstawia poniższy schemat.
Uzupełnij poniższą tabelę. Na podstawie informacji wstępnej wpisz symbol pierwiastka E oraz liczbę neutronów (a), wyemitowanych podczas przedstawionej reakcji rozszczepienia jednego jądra .
Zadanie 170. (SR18)
Elektrony w atomach są przyciągane przez jądro, więc usunięcie elektronu z powłoki wymaga nakładu energii, która jest nazywana energią jonizacji. Pierwsza energia jonizacji to minimalna energia potrzebna do oderwania pierwszego elektronu od atomu. Druga energia jonizacji jest minimalną energią potrzebną do usunięcia drugiego elektronu (z jednododatniego jonu). W odpowiednich warunkach od atomu można oderwać kolejne elektrony. Rozróżnia się zatem pierwszą, drugą i kolejne energie jonizacji.
W poniżej tabeli przedstawiono wartości kolejnych (trzech) energii jonizacji glinu.
Uzupełnij poniższe zdanie, tak aby powstała informacja prawdziwa, i wyjaśnij, dlaczego wybrana energia jonizacji ma najniższą wartość. Spośród podanych wartości energii jonizacji najniższą wartość ma (pierwsza / druga / trzecia) energia jonizacji, ponieważ……………
Zadanie 171. (SR18)
Na podstawie położenia w układzie okresowym następujących pierwiastków: Na, K, Cs, Mg ustal i napisz symbol tego, który:
- ma największy promień jonowy (promień kationu)
- wykazuje największą aktywność chemiczną
- tworzy tlenek o najsłabszych właściwościach zasadowych.
Zadanie 172. (SR18)
Dane są wzory sześciu cząsteczek i jonów: NH3 SO2− HCO32− CO3– HSO3– NH4+
Spośród wymienionych powyżej wzorów wybierz i wpisz do tabeli wzory tych drobin, które zgodnie z teorią Brønsteda stanowią sprzężone pary kwas–zasada.
Zadanie 173. (SR18)
Beryl jest metalem, który reaguje z kwasami oraz ze stężonymi zasadami. Poniżej przedstawiono schemat reakcji berylu z kwasem i zasadą.
Zadanie 174. (SR18)
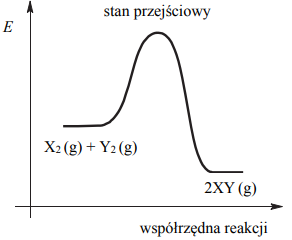
Na poniższym wykresie zilustrowano zmianę energii potencjalnej podczas reakcji opisanej równaniem X2 (g) + Y2 (g) ⇄ 2XY (g).
Oceń, czy zmieni się (wzrośnie albo zmaleje), czy też nie ulegnie zmianie wydajność reakcji otrzymywania produktu XY, jeżeli w układzie będącym w stanie równowagi nastąpi:
- wzrost temperatury w warunkach izobarycznych (p = const)
- wzrost ciśnienia w warunkach izotermicznych (T = const).
Zadanie 175. (SR18)
Złoto jest doskonale kowalnym żółtym metalem o silnym połysku. W czystej postaci jest stosunkowo miękkie, więc w wyrobach jubilerskich stosuje się stopy złota z innymi metalami, np. srebrem lub miedzią. Zawartość czystego złota w tych wyrobach podaje się w jednostkach zwanych karatami. Jeden karat odpowiada 1/24 zawartości masowej złota w stopie, co oznacza, że czyste złoto jest 24-karatowe. Złoto jest metalem szlachetnym, więc trudno ulega reakcjom chemicznym. Roztwarza się w wodzie królewskiej, przy czym powstaje m.in. chlorkowy kompleks złota(III), co ilustruje poniższe równanie:
Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.
Zadanie 176. (NR15)
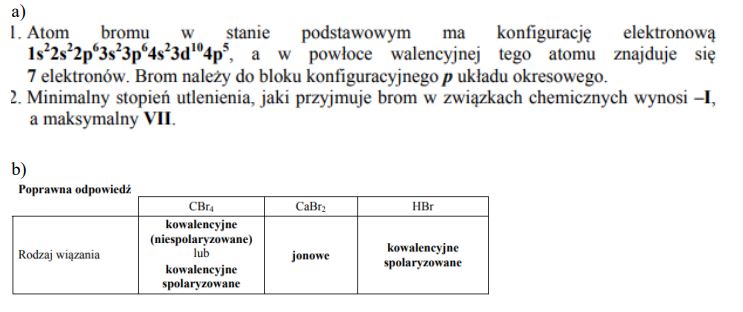
Brom występuje w przyrodzie w postaci mieszaniny dwóch izotopów o masach atomowych równych 78,92 u i 80,92 u. Średnia masa atomowa bromu jest równa 79,90 u. Pierwiastek ten w reakcjach utleniania i redukcji może pełnić funkcję zarówno utleniacza, jak i reduktora. Tworzy związki chemiczne, w których występują różne rodzaje wiązań.
Uzupełnij poniższy tekst, wpisując w odpowiednie miejsca informacje dotyczące struktury elektronowej atomu bromu i jego stopni utlenienia.
- Atom bromu w stanie podstawowym ma konfigurację elektronową …………………………………………………………………………………, a w powłoce walencyjnej tego atomu znajduje się …………………. elektronów. Brom należy do bloku konfiguracyjnego ……………….. układu okresowego.
- Minimalny stopień utlenienia, jaki przyjmuje brom w związkach chemicznych, jest równy …………., a maksymalny wynosi ………….. .
Ustal i wpisz do tabeli, jaki rodzaj wiązania (kowalencyjne niespolaryzowane, kowalencyjne spolaryzowane, jonowe) występuje w wymienionych związkach.
Zadanie 177. (NR15)
Poniżej przedstawiono model struktury wody w stanie stałym
Uzupełnij zdania opisujące budowę i właściwości lodu. Podkreśl właściwe określenie spośród wymienionych w każdym nawiasie.
W wodzie w stanie stałym, czyli w lodzie, każda cząsteczka wody związana jest wiązaniami (kowalencyjnymi / kowalencyjnymi spolaryzowanymi / wodorowymi / jonowymi) z czterema innymi cząsteczkami wody leżącymi w narożach czworościanu foremnego. Tworzy się w ten sposób luźna sieć cząsteczkowa o strukturze (diagonalnej / trygonalnej / tetraedrycznej), która pęka, gdy lód się topi, choć pozostają po niej skupiska zawierające 30 i więcej cząsteczek. W ciekłej wodzie cząsteczki zajmują przestrzeń mniejszą niż w sieci krystalicznej, a zatem woda o temperaturze zamarzania ma gęstość (większą / mniejszą) niż lód. Dlatego lód (tonie w / pływa po) wodzie.
Zadanie 178. (NR15)
Do szczelnego zbiornika wprowadzono wodór oraz tlen i zainicjowano reakcję. Po jej zakończeniu naczynie zawierało wyłącznie 0,9 g wody. Napisz, w jakim stosunku objętościowym i masowym zmieszano wodór z tlenem w zbiorniku, a także podaj, ile gramów wodoru i ile gramów tlenu znajdowało się w naczyniu przed zainicjowaniem reakcji.
Zadanie 179. (NR15)
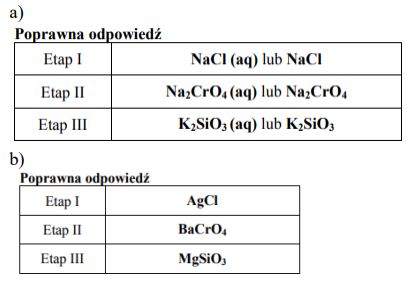
W roztworze wodnym znajdują się kationy: Ba2+, Ag+ i Mg2+ oraz towarzyszące im aniony. Kationy te można wydzielić z roztworu za pomocą reakcji strąceniowych, stosując odpowiednie odczynniki w takiej kolejności, aby jeden odczynnik wytrącał z roztworu w postaci nierozpuszczalnej soli tylko jeden kation. Po przesączeniu osadu, używając innego odczynnika, można wytrącić z przesączu sól zawierającą kolejny kation.
Wpisz do tabeli wzory odczynników, których użycie pozwoli w trzech etapach (I, II i III) wytrącić kolejno z roztworu w postaci nierozpuszczalnych soli kationy w nim zawarte. Odczynniki wybierz spośród wymienionych poniżej.
Na2CrO4 (aq) KNO3 (aq) NaCl (aq) NaOH(aq) K2SiO3 (aq)
Napisz wzory nierozpuszczalnych soli powstałych w każdym etapie doświadczenia.
Zadanie 180. (NR15)
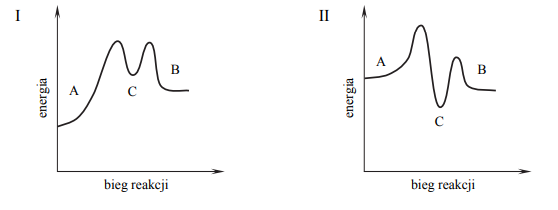
Pewien proces, w którym związek A zostaje przekształcony w związek B, przebiega w dwóch etapach.
Przeanalizuj poniższe wykresy i ustal, który z nich odpowiada opisanej przemianie.
Zadanie 181. (NR15)
Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, lub F – jeśli jest fałszywa.
Zadanie 182. (NR16)
Z konfiguracji elektronowej atomu (w stanie podstawowym) pierwiastka X wynika, że w tym atomie:
- elektrony rozmieszczone są na czterech powłokach elektronowych
- na podpowłoce 3d liczba elektronów sparowanych jest dwa razy mniejsza od liczby elektronów niesparowanych.Uzupełnij poniższą tabelę – wpisz symbol pierwiastka X, dane dotyczące jego położenia w układzie okresowym oraz symbol bloku konfiguracyjnego (energetycznego), do którego należy pierwiastek X.
Uzupełnij poniższy zapis (stosując schematy klatkowe), tak aby przedstawiał on konfigurację elektronową atomu w stanie podstawowym pierwiastka X. W zapisie tym uwzględnij numery powłok i symbole podpowłok. Podkreśl ten fragment konfiguracji, który nie występuje w konfiguracji elektronowej jonu X2+ (stan podstawowy).
Zadanie 183. (NR16)
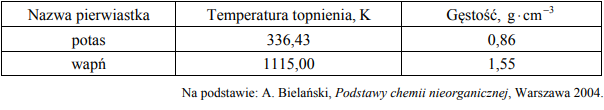
W poniższej tabeli zestawiono wybrane właściwości fizyczne potasu i wapnia.
Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.
Na podstawie informacji i układu okresowego pierwiastków uzupełnij poniższe zdania. Wybierz i zaznacz jedno właściwe określenie spośród podanych w każdym nawiasie.
- Węzły sieci krystalicznych wapnia, jak i potasu obsadzone są (dodatnio / ujemnie) naładowanymi jonami zwanymi rdzeniami atomowymi. Pomiędzy rdzeniami atomowymi obecne są słabo związane elektrony walencyjne, które mogą wędrować swobodnie przez kryształ metalu. Dlatego zarówno wapń, jak i potas odznaczają się (dużą / małą) przewodnością elektryczną.
- Temperatura topnienia wapnia jest (niższa / wyższa) niż temperatura topnienia potasu, co wynika między innymi (z silniejszego / ze słabszego) wiązania metalicznego, utworzonego z udziałem (mniejszej / większej) liczby elektronów walencyjnych.
Zadanie 184. (NR16)
W wyniku pewnej odwracalnej reakcji chemicznej z dwóch substratów powstaje jeden produkt. Przemiana przebiega w fazie gazowej, co oznacza, że oba substraty i produkt są gazami. Reakcję tę przeprowadzono w zamkniętym reaktorze przy użyciu stechiometrycznych ilości substratów w różnych temperaturach i pod różnym ciśnieniem. Na poniższym diagramie przedstawiono, jaki procent objętości mieszaniny poreakcyjnej w reaktorze stanowiła objętość produktu tej reakcji w zależności od warunków temperatury i ciśnienia, w jakich przebiegała.
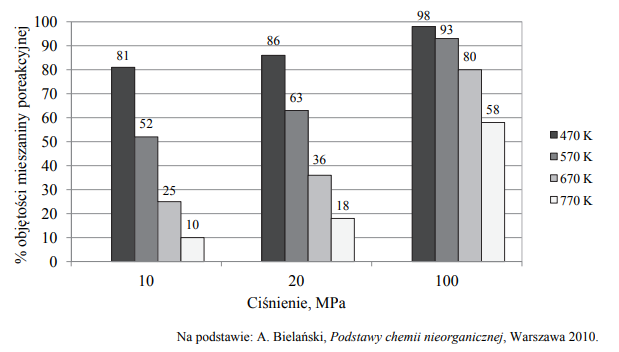
Na podstawie analizy diagramu określ, czy w równaniu stechiometrycznym opisanej reakcji łączna liczba moli substratów jest mniejsza, czy – większa od liczby moli produktu, czy też – równa liczbie moli produktu. Odpowiedź uzasadnij.
Spośród reakcji, których równania przedstawiono poniżej, wybierz tę, do której mógłby odnosić się przedstawiony diagram. Zaznacz wybraną odpowiedź.
Zadanie 185. (NR16)
Zmiana barwy wskaźników pH następuje stopniowo, w pewnym zakresie pH. W tabeli podano zakres pH, w którym następuje zmiana barwy wybranych wskaźników kwasowo-zasadowych.
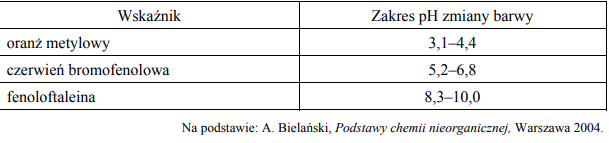
dwóch wodnych roztworów, z których jeden ma pH = 5, a drugi ma pH = 7
oranż metylowy czerwień bromofenolowa fenoloftaleina
2. kwasu solnego o stężeniu 0,01mol* dm-3 od wodnego roztworu wodorotlenku sodu o stężeniu 0,01mol* dm-3
oranż metylowy czerwień bromofenolowa fenoloftaleina.
Zadanie 186. (NR16)
Przeprowadzono doświadczenie zilustrowane poniższym schematem.
Celem doświadczenia było odróżnienie dwóch, oznaczonych umownie literami X i Z, metali, z których wykonano płytki. Wiadomo, że jednym metalem był cynk, a drugim – nikiel. Po pewnym czasie obie płytki wyjęto z roztworów, osuszono i zważono. Stwierdzono, że zmieniła się tylko masa płytki wykonanej z metalu X. Uzupełnij poniższe zdania. Wybierz i zaznacz właściwe określenie spośród podanych w każdym nawiasie oraz napisz w formie jonowej skróconej równanie zachodzącej reakcji. Masa płytki wykonanej z metalu X się (zmniejszyła / zwiększyła). Podczas przeprowadzonego doświadczenia przebiegła reakcja zilustrowana równaniem: ………………
Metalem Z był (cynk / nikiel).
Zadanie 187. (NR17)
Dwa pierwiastki oznaczone literami X i Z leżą w czwartym okresie układu okresowego pierwiastków. Ponadto wiadomo, że w stanie podstawowym:
- atom pierwiastka X ma na ostatniej powłoce sześć elektronów;
- atom pierwiastka Z ma łącznie na ostatniej powłoce i na podpowłoce 3d sześć elektronów
Uzupełnij poniższą tabelę. Wpisz symbole pierwiastków X i Z, dane dotyczące ich położenia w układzie okresowym oraz symbol bloku konfiguracyjnego, do którego należy każdy z pierwiastków.
Wybierz pierwiastek (X albo Z), którego atomy w stanie podstawowym mają większą liczbę elektronów niesparowanych. Uzupełnij poniższy zapis, tak aby przedstawiał on konfigurację elektronową atomu w stanie podstawowym wybranego pierwiastka. Zastosuj schematy klatkowe, podaj numery powłok i symbole podpowłok.
Zadanie 188. (NR17)
Miarą tendencji atomów do oddawania elektronów i przechodzenia w dodatnio naładowane jony jest energia jonizacji. Pierwsza energia jonizacji to minimalna energia potrzebna do oderwania jednego elektronu od atomu. Druga energia jonizacji jest minimalną energią potrzebną do usunięcia drugiego elektronu (z jednododatniego jonu). Na wykresach przedstawiono zmiany pierwszej i drugiej energii jonizacji wybranych pierwiastków uszeregowanych według rosnącej liczby atomowej.
Uzupełnij poniższe zdania. Wybierz i zaznacz jedno określenie spośród podanych w każdym nawiasie.
- Lit ma wyższą wartość pierwszej energii jonizacji niż sód, ponieważ w jego atomie elektron walencyjny znajduje się (bliżej jądra / dalej od jądra) niż elektron walencyjny w atomie sodu. Oznacza to, że (łatwiej / trudniej) oderwać elektron walencyjny atomu litu niż elektron walencyjny atomu sodu.
- Wartości drugiej energii jonizacji berylu i magnezu są dużo (niższe / wyższe) niż wartości drugiej energii jonizacji litu i sodu, ponieważ atomy litowców po utracie jednego elektronu uzyskują trwałą konfigurację gazów szlachetnych. Atomy berylu, gdy oddają elektrony walencyjne, przechodzą w dodatnio naładowane jony o konfiguracji elektronowej helu, natomiast atomy magnezu – w dodatnio naładowane jony o konfiguracji elektronowej (argonu / neonu).
Zadanie 189. (NR17)
Chlorek arsenu(III) – AsCl3 – jest w temperaturze pokojowej cieczą. W stanie ciekłym chlorek arsenu(III) nie przewodzi prądu elektrycznego. W reakcji z wodą tworzy kwas arsenowy(III) o wzorze H3AsO3 oraz chlorowodór.
Czy chlorek arsenu(III) ma budowę kowalencyjną, czy – jonową? Narysuj wzór elektronowy chlorku arsenu(III). Uwzględnij wolne pary elektronowe.
Napisz w formie cząsteczkowej równanie reakcji chlorku arsenu(III) z wodą.
Zadanie 190. (NR17)
Do reaktora wprowadzono próbkę gazowego związku A i zainicjowano reakcję:
A (g) ⇄ 2B (g)
Przemianę prowadzono w stałej objętości. Mierzono stężenie związku A w czasie trwania reakcji. Tę zależność przedstawiono na poniższym wykresie.
Na podstawie powyższych informacji narysuj wykres przedstawiający zależność stężenia związku B od czasu trwania reakcji.
Zadanie 191. (NR17)
W temperaturze T przygotowano wodne roztwory sześciu elektrolitów: NaBr, NH4NO3, HCl, HCOOH, NaClO, NaClO4 o jednakowym stężeniu molowym równym 0,1 mol · dm–3 .
Porównaj pH tych roztworów. Uzupełnij zdania wyrażeniami wybranymi spośród podanych poniżej. wyższe niż równe niższe niż
pH wodnego roztworu NaBr jest ………………………………… pH wodnego roztworu NH4NO3.
pH wodnego roztworu HCl jest …………………………………. pH wodnego roztworu HCOOH.
pH wodnego roztworu NaClO jest ………………………………. pH wodnego roztworu NaClO4.
Zadanie 192. (NR17)
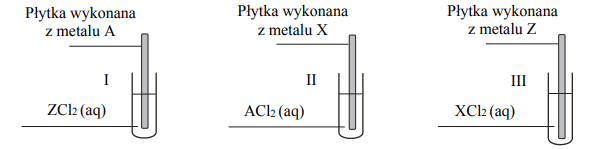
Przeprowadzono doświadczenie, którego celem było porównanie aktywności trzech metali oznaczonych umownie literami A, X i Z. Przebieg doświadczenia zilustrowano poniższym schematem.
Zmiany zaobserwowane podczas doświadczenia pozwoliły stwierdzić, że aktywność użytych metali rośnie w szeregu A, Z, X. Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.
Zadanie 193. (NR18)
Pierwiastki X i Z leżą w czwartym okresie układu okresowego. Pierwiastek X jest metalem, natomiast pierwiastek Z – niemetalem. W stanie podstawowym atomów obu tych pierwiastków tylko jeden elektron jest niesparowany. Znajduje się on na ostatniej powłoce. Niesparowany elektron atomu pierwiastka X znajduje się na innej podpowłoce niż niesparowany elektron atomu pierwiastka Z. Ponadto wiadomo, że pierwiastek X tworzy tlenki o wzorach X2O i XO oraz że ten metal jest jednym z najlepszych przewodników ciepła i elektryczności. Pierwiastek Z występuje w postaci dwuatomowych cząsteczek.
Uzupełnij poniższą tabelę. Wpisz symbole pierwiastków X i Z, dane dotyczące ich położenia w układzie okresowym oraz symbol bloku konfiguracyjnego, do którego należy każdy z pierwiastków.
Przedstaw konfigurację elektronową jonu X2+ (stan podstawowy). Zastosuj skrócony zapis konfiguracji elektronowej z symbolem gazu szlachetnego.
Dla cząsteczki Z2 określ liczbę: wiązań σ, wiązań π oraz wolnych par elektronowych.
Zadanie 194. (NR18)
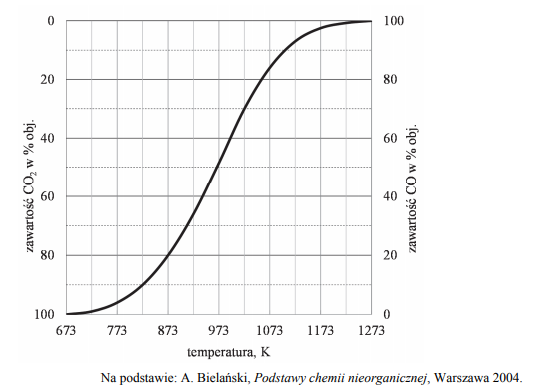
W wysokiej temperaturze węgiel reaguje z tlenkiem węgla(IV) i ustala się równowaga chemiczna:
CO2 (g) + C (s) ⇄ 2CO (g)
Objętościową zawartość procentową CO i CO2 w gazie pozostającym w równowadze z węglem w zależności od temperatury (pod ciśnieniem atmosferycznym 1013 hPa) przedstawiono na poniższym wykresie.
Oceń, czy reakcja pomiędzy tlenkiem węgla(IV) i węglem jest procesem endo- czy egzoenergetycznym. Odpowiedź uzasadnij.
Zadanie 195. (NR18)
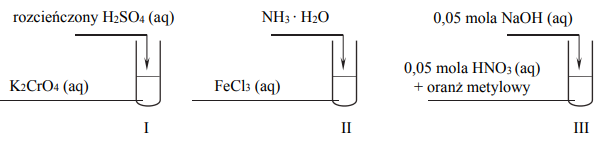
Przeprowadzono doświadczenia, których przebieg zilustrowano na schemacie:
Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa
Zadanie 196. (NR18)
W temperaturze T przygotowano wodne roztwory pięciu elektrolitów o jednakowym stężeniu molowym równym 0,1mol* dm-3 . Poniżej podano wzory tych elektrolitów.
KCl HCl NaNO2 NH4Cl KOH
Uszereguj związki o podanych wzorach zgodnie z rosnącym pH ich wodnych roztworów. Napisz wzory tych związków w odpowiedniej kolejności.
Zadanie 197. (NR18)
Dwa gazy A i B zmieszane w stosunku molowym A B n n: 1:4 = zajmują w warunkach normalnych objętość 1 dm3 . Tę mieszaninę umieszczono w reaktorze o stałej pojemności 1 dm3 i w temperaturze T zainicjowano reakcję. W tej temperaturze ustalił się stan równowagi opisany równaniem: A (g) + 2B(g) ⇄ 2C(g) ΔH < 0 W stanie równowagi stężenie substancji C było równe 0,004 mol · dm–3.
Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.
Zadanie 198. (NR18)
Przeprowadzono doświadczenie, którego celem było porównanie aktywności chemicznej czterech metali: talu (Tl), technetu (Tc), hafnu (Hf) i molibdenu (Mo). Stwierdzono, że z udziałem wymienionych metali i ich jonów samorzutnie zachodzą reakcje, których przebieg ilustrują poniższe równania w formie jonowej skróconej:
Uszereguj wymienione metale według malejącej aktywności chemicznej – napisz ich symbole w odpowiedniej kolejności.
Spośród kationów biorących udział w opisanych reakcjach wybierz jon, który jest najsilniejszym utleniaczem, i jon, który jest najsłabszym utleniaczem. Napisz wzory wybranych jonów.