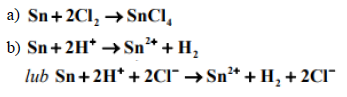Zadania maturalne z Chemii
Tematyka: atomy, cząsteczki, wiązania, pierwiastki, układ okresowy.
Zadania pochodzą z oficjalnych arkuszy maturalnych CKE, które służyły przeprowadzaniu majowych egzaminów. Czteroznakowy kod zapisany przy każdym zadaniu wskazuje na jego pochodzenie: S/N – „stara”/”nowa” formuła; P/R – poziom podstawowy/rozszerzony; np. 08 – rok 2008.
Zbiór zadań maturalnych w formie arkuszy, możesz pobrać >> TUTAJ <<.
Zadanie 1. (SP05)
Zapis 1s2 2s2 2p6 3s2 3p2 (K2 L8 M4 ) przedstawia konfigurację elektronową atomu.
Zaznacz poprawną odpowiedź.
A. argonu.
B. węgla.
C. krzemu.
D. siarki.
Zadanie 2. (SP05)
Liczba atomowa pierwiastka jest cztery razy większa od liczby atomowej berylu, a liczba masowa jego izotopu jest równa liczbie atomowej selenu.
Podaj liczbę masową izotopu, liczbę atomową i symbol tego pierwiastka.
34, 16, S
Zadanie 3. (SP05)
Określ, na podstawie różnicy elektroujemności pierwiastków, typ wiązania w związkach: KBr i HBr.
Typ wiązania w KBr: …………………………………..
Typ wiązania w HBr: …………………………………..
KBr – (wiązanie) jonowe
HBr – (wiązanie) kowalencyjne spolaryzowane
lub atomowe spolaryzowane
Zadanie 4. (SP05)
Podaj jedną przyczynę powstawania kwaśnych deszczów.
(obecność w powietrzu) tlenków siarki i azotu, spalanie (zasiarczonego) węgla (kamiennego) (przez zakłady przemysłowe, elektrownie węglowe, koksownie, huty), spalanie benzyny w samochodach bez katalizatorów, erupcje wulkanów.
Zadanie 5. (SP05)
Wymień po dwie właściwości fizyczne sodu i siarki.
Właściwości fizyczne sodu: ……………………………………….
Właściwości fizyczne siarki: ………………………………………
Sód: ciało stałe, srebrzystobiały, mała gęstość, miękki
Siarka: ciało stałe, żółta, krucha, nierozpuszczalna w wodzie, rozpuszczalna w dwusiarczku węgla, nie przewodzi prądu elektrycznego
Zadanie 6. (SP05)
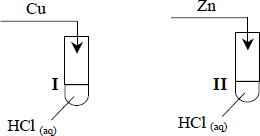
Badano zachowanie cynku, miedzi i magnezu wobec rozcieńczonego kwasu solnego (chlorowodorowego), przeprowadzając doświadczenia przedstawione na poniższym rysunku:
Korzystając ze skróconego szeregu aktywności wybranych metali: K, Ca, Mg, Zn, Pb, H, Cu, Ag, Au wskaż, w których probówkach przebiegały reakcje chemiczne. Wyjaśnij, dlaczego we wskazanych przez ciebie probówkach metale reagowały z kwasem solnym (chlorowodorowym).
– I i III lub Zn i Mg
– cynk i magnez reagują z kwasem solnym, ponieważ w szeregu aktywności znajdują się przed wodorem… lub ponieważ są metalami aktywnymi lub nieszlachetnymi; lub … ponieważ są aktywniejsze od wodoru (i wypierają wodór z kwasów); lub …. ponieważ mają ujemne wartości potencjałów redoks.
Zadanie 7. (SP06)
Konfigurację elektronową atomu glinu w stanie podstawowym można przedstawić następująco: 1s2 2s2 2p6 3s2 3p1 (K2 L8 M3). Przepisz ten fragment konfiguracji elektronowej atomu glinu, który odnosi się do elektronów walencyjnych.
3s2, 3p1
Zadanie 8. (SP06)
Konfigurację elektronową atomu glinu w stanie podstawowym można przedstawić następująco: 1s2 2s2 2p6 3s2 3p1 (K2 L8 M3).
Podaj trwały stopień utlenienia, który glin przyjmuje w związkach chemicznych.
III
Zadanie 9. (SP07)
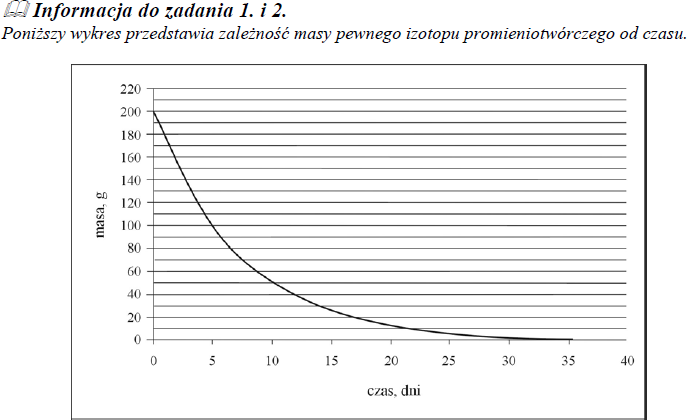
Poniższy wykres przedstawia zależność masy pewnego izotopu promieniotwórczego od czasu.
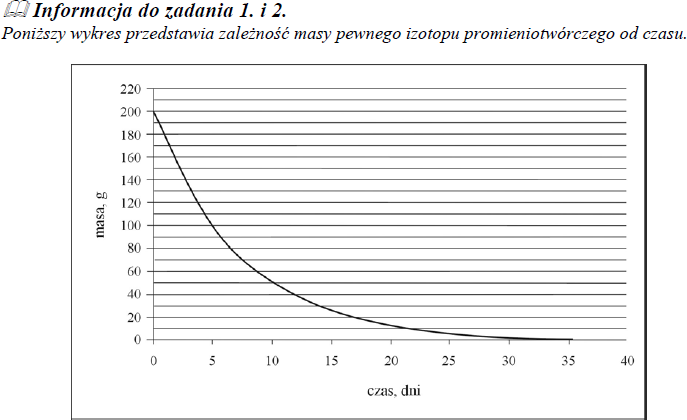
Na podstawie zamieszczonego wyżej wykresu oszacuj okres półtrwania tego izotopu.
około 5 dni
Zadanie 10. (SP07)
Poniższy wykres przedstawia zależność masy pewnego izotopu promieniotwórczego od czasu.
Korzystając z powyższego wykresu, oszacuj, ile gramów izotopu pozostało po 15 dniach.
około 25 g
Zadanie 11. (SP07)
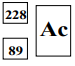
Poniższe równanie ilustruje przebieg przemiany promieniotwórczej, której ulega izotop uranu.
Ustal liczbę atomową, liczbę masową i symbol izotopu X.
Liczba atomowa: 90 Liczba masowa: 231 Symbol: Th
Zadanie 12. (SP07)
Pierwiastek E tworzy wodorek o wzorze EH4 oraz tlenki EO i EO2. W atomie tego pierwiastka, w stanie podstawowym, elektrony rozmieszczone są na dwóch powłokach.
Ustal położenie pierwiastka E w układzie okresowym oraz podaj jego nazwę.
Numer grupy: ………………..
Numer okresu: ………………..
Nazwa: …………………………………………….
Numer grupy: 14 Numer okresu: 2 Nazwa: węgiel
Zadanie 13. (SP07)
Uzupełnij poniższą tabelę, wpisując w każdym wierszu jeden z symboli wybranych spośród:
Zadanie 14. (SP08)
Przeanalizuj położenie strontu (Sr) w układzie okresowym pierwiastków, a następnie uzupełnij poniższą tabelę, wpisując w pustą kolumnę literę P, jeżeli zdanie jest prawdziwe, lub literę F, jeżeli jest ono fałszywe. Na podstawie położenia strontu w układzie okresowym pierwiastków można stwierdzić, że
Zadanie 15. (SP08)
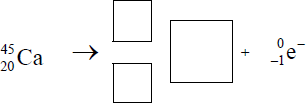
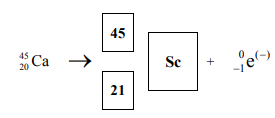
W skorupie ziemskiej występuje promieniotwórczy izotop , ulegający przemianie β − .
Określ skład jądra atomowego tego izotopu rubidu.
Liczba protonów = 37 Liczba neutronów = 50
Zadanie 16. (SP08)
W skorupie ziemskiej występuje promieniotwórczy izotop , ulegający przemianie β − .
Uzupełnij schemat opisanej przemiany, wpisując symbol oraz liczbę atomową i liczbę masową powstającego izotopu.
Zadanie 17. (SP08)
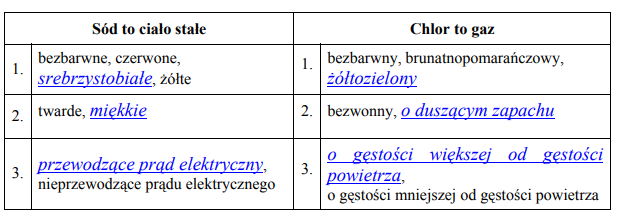
Spośród podanych właściwości wybierz (i podkreśl w każdym wierszu tabeli) te, które charakteryzują sód i chlor w temperaturze pokojowej i pod ciśnieniem atmosferycznym.
Zadanie 18. (SP09)
Jądro atomu izotopu pewnego pierwiastka zawiera 20 protonów i 20 neutronów.
a) Przedstaw symbol izotopu tego pierwiastka w postaci.
b) Zapisz konfigurację elektronową atomu tego pierwiastka w stanie podstawowym.
a)
b)
1s2 2s2 2p6 3s2 3p6 4s2
Zadanie 19. (SP09)
Jądro izotopu radu 226Ra ulega rozpadowi α zgodnie z poniższym schematem.
Opisz produkt tej przemiany (E), podając wartość jego liczby atomowej (Z), liczby masowej (A) oraz symbol odpowiedniego pierwiastka.
Liczba atomowa Z: ……….. Liczba masowa A: ………… Symbol pierwiastka: …………
Liczba atomowa Z = 86
Liczba masowa A = 222
Symbol pierwiastka: Rn
Zadanie 20. (SP09)
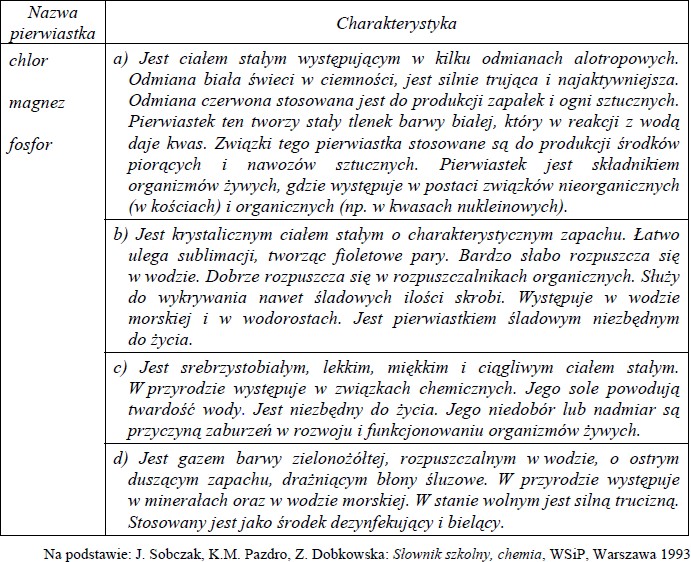
W tabeli podano nazwy trzech pierwiastków oraz krótkie charakterystyki czterech pierwiastków (w tym stan skupienia w temperaturze pokojowej i pod ciśnieniem atmosferycznym).
Przyporządkuj każdemu pierwiastkowi właściwą charakterystykę, wpisując odpowiednie litery (a –d) w poniższe kratki.
I. Chlor: ……………………
II. Magnez: ………………..
III. Fosfor: ……….………..
I. chlor – d
II. magnez – c
III. fosfor – a
Zadanie 21. (SP09)
Przeprowadzono doświadczenie zilustrowane poniższym rysunkiem.
W probówce I nie zaobserwowano objawów reakcji, natomiast w probówce II zaobserwowano wydzielanie gazu.
a) Korzystając z powyższej informacji, uzupełnij podany niżej fragment szeregu aktywności metali. Wpisz symbole chemiczne miedzi i cynku w wykropkowane miejsca.
Na, Mg, Al, ……., Fe, Sn, Pb, H2, ……., Ag, Au
b)Zapisz w formie jonowej skróconej równanie reakcji zachodzącej w probówce II.
a) Zn, Cu
b) Zn + 2H+ → Zn2+ +H2 (↑)
Zadanie 22. (SP10)
Atomy pewnego pierwiastka w stanie podstawowym mają następującą konfigurację elektronów walencyjnych: 2s2 2p3 (L5 )
Określ położenie tego pierwiastka w układzie okresowym, wpisując poniżej numer grupy oraz numer okresu.
Numer grupy: ……………………………………….
Numer okresu: ………………………………………..
Numer grupy: 15 lub VA lub piąta główna
Numer okresu: 2 lub II lub drugi
Zadanie 23. (SP10)
W jądrze pierwiastka X znajduje się tyle protonów, ile neuronów zawiera jądro izotopu Si-30. Liczba masowa jednego z izotopów pierwiastka X jest równa liczbie elektronów w izotopie Se-74.
Korzystając z powyższej informacji, ustal liczbę atomową pierwiastka X oraz liczbę masową opisanego izotopu pierwiastka X.
Liczba atomowa (Z): 16
Liczba masowa (A): 34
Zadanie 24. (SP10)
Promieniotwórczy izotop pierwiastka Z uległ przemianie α i przekształcił się w izotop 212 83Bi.
Korzystając z układu okresowego, ustal symbol pierwiastka Z.
Symbol pierwiastka Z: …………………………………………………..
At
Zadanie 25. (SP10)
Ustal, który z metali (lit czy sód) jest mniej reaktywny, i napisz w formie cząsteczkowej równanie reakcji tego metalu z wodą.
2Li + 2H2O → 2LiOH + H2 (↑)
Zadanie 26. (SP10)
W poniższej tabeli podane są dane fizykochemiczne dotyczące niektórych właściwości tlenu i azotu (pod ciśnieniem 1013 hPa).
W przemyśle tlen otrzymuje się przez destylację skroplonego powietrza.
Korzystając z danych zawartych w informacji wprowadzającej, napisz, która substancja (tlen czy azot) pierwsza odparowuje podczas otrzymywania tlenu opisaną metodą, i uzasadnij swoją odpowiedź.
- Pierwszy odparuje: azot
Uzasadnienie:
- Najpierw odparuje substancja o większej lotności.
- Jest bardziej lotny (niż tlen).
- (Azot) ma niższą temperaturę wrzenia.
Zadanie 27. (SP10)
W poniższej tabeli podane są dane fizykochemiczne dotyczące niektórych właściwości tlenu i azotu (pod ciśnieniem 1013 hPa).
Pewną ilość mieszaniny tlenu i azotu (pod ciśnieniem 1013 hPa), w której stosunek objętościowy składników był równy 1 : 1, przepuszczano (w cyklu zamkniętym) przez wodę destylowaną o temperaturze 20 °C aż do nasycenia wody tymi gazami.
Korzystając z danych zawartych w informacji wprowadzającej, uzupełnij poniższe zdanie, wpisując: większy niż 1 : 1 albo mniejszy niż 1 : 1, albo równy 1 : 1.
Stosunek objętościowy tlenu do azotu w mieszaninie gazów po przepuszczeniu jej przez wodę destylowaną o temperaturze 20 °C (w celu nasycenia wody tymi gazami) jest …………………………………………………………. .
- mniejszy niż 1:1
Zadanie 28. (SP11)
Uzupełnij zdania, wpisując określenia wybrane z poniższego zestawu: zmniejszy się, zwiększy się, nie ulegnie zmianie.
Po emisji cząstki − β liczba masowa jądra ……………………………………………….., natomiast ładunek ……………………………………………….. o jeden ładunek elementarny. W wyniku emisji cząstki α liczba masowa jądra ……………………………………………….. o cztery jednostki, a jego ładunek ……………………………………………….. o dwa ładunki elementarne.
Po emisji cząstki − β liczba masowa jądra nie ulegnie zmianie, natomiast ładunek zwiększy się o jeden ładunek elementarny. W wyniku emisji cząstki α liczba masowa jądra zmniejszy się o cztery jednostki, a jego ładunek zmniejszy się o dwa ładunki elementarne.
Zadanie 29. (SP12)
Przedstaw konfigurację elektronową atomu argonu w stanie podstawowym. Podkreśl fragment konfiguracji, który opisuje stan elektronów zewnętrznej powłoki.
Konfiguracja elektronowa, np.:
Zadanie 30. (SP12)
Napisz wzory jonów potasu i siarki, których konfiguracja elektronowa jest taka sama, jak konfiguracja atomu argonu w stanie podstawowym.
Wzór jonu potasu: K+
Wzór jonu siarki: S2–
Zadanie 31. (SP12)
Pierwiastek X tworzy jony o ładunku 2+, których konfiguracja elektronowa jest następująca:
1s2 2s2 2p6 (K2 L8).
Podaj symbol pierwiastka X i określ jego położenie w układzie okresowym pierwiastków.
Symbol pierwiastka X: Mg
Numer okresu: III lub 3
Numer grupy: 2 lub II
Zadanie 32. (SP12)
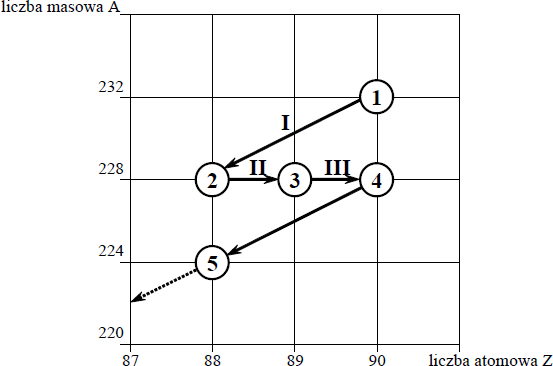
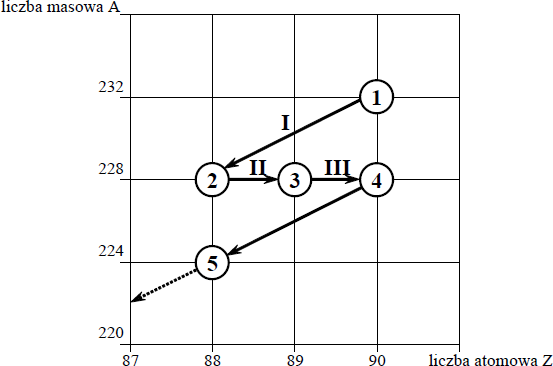
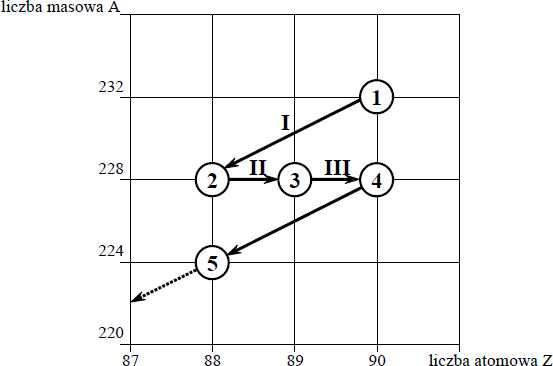
Poniższy schemat przedstawia początkowy fragment szeregu promieniotwórczego toru. Numerami w kółkach oznaczono kolejne człony tego szeregu, a strzałkami przemiany (α lub β– ), jakim ich jądra ulegają.
Określ liczbę protonów i liczbę neutronów w jądrze izotopu oznaczonego numerem 1.
Liczba protonów: 90
Liczba neutronów: 142
Zadanie 33. (SP12)
Poniższy schemat przedstawia początkowy fragment szeregu promieniotwórczego toru. Numerami w kółkach oznaczono kolejne człony tego szeregu, a strzałkami przemiany (α lub β– ), jakim ich jądra ulegają.
Uzupełnij poniższy schemat, wpisując symbol i liczbę atomową pierwiastka, którego izotop oznaczono numerem 3, oraz liczbę masową tego izotopu.
Zadanie 34. (SP12)
Poniższy schemat przedstawia początkowy fragment szeregu promieniotwórczego toru. Numerami w kółkach oznaczono kolejne człony tego szeregu, a strzałkami przemiany (α lub β– ), jakim ich jądra ulegają.
Określ typ przemian jądrowych (α lub β– ) oznaczonych strzałkami I i III.
Typ przemiany I: α
Typ przemiany III: β –
Zadanie 35. (SP12)
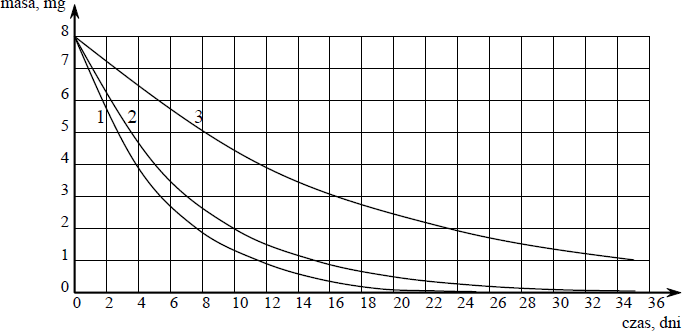
Poniższy wykres przedstawia zależność masy trzech izotopów promieniotwórczych od czasu.
Wskaż najtrwalszy izotop (1, 2 lub 3).
Numer, którym oznaczono najtrwalszy izotop: 3
Zadanie 36. (SP12)
Poniższy wykres przedstawia zależność masy trzech izotopów promieniotwórczych od czasu.
a) Oszacuj okres półtrwania izotopu oznaczonego numerem 2.
Okres półtrwania izotopu oznaczonego numerem 2 wynosi około ……………………………… dni.
b) Oszacuj, ile miligramów izotopu oznaczonego numerem 3 uległo rozpadowi w czasie 8 dni.
W czasie 8 dni uległo rozpadowi ……………….. mg izotopu oznaczonego numerem 3.
a)
Okres półtrwania izotopu oznaczonego numerem 2 wynosi około 5 dni.
b)
W czasie 8 dni uległo rozpadowi 3 mg izotopu oznaczonego numerem 3
Zadanie 37. (SP13)
Przeanalizuj położenie bromu w układzie okresowym pierwiastków i oceń prawdziwość poniższych zdań. Wpisz do tabeli literę P, jeżeli zdanie jest prawdziwe, lub literę F, jeśli jest fałszywe.
- P
- P
- F
Zadanie 38. (SP13)
Wapń występuje w przyrodzie w postaci mieszaniny trwałych izotopów. Liczba elektronów w atomie jednego z tych izotopów wapnia jest równa liczbie neutronów znajdujących się w jego jądrze (izotop I). Atom drugiego z trwałych izotopów wapnia zawiera w jądrze neutrony w liczbie równej liczbie atomowej chromu (izotop II). Spośród sztucznie otrzymanych promieniotwórczych izotopów wapnia najtrwalszy jest izotop Ca-45, ulegający przemianie beta (-) .
Określ liczbę masową izotopu I oraz liczbę masową izotopu II.
izotopu I = 40
izotopu II = 44
Zadanie 39. (SP13)
Wapń występuje w przyrodzie w postaci mieszaniny trwałych izotopów. Liczba elektronów w atomie jednego z tych izotopów wapnia jest równa liczbie neutronów znajdujących się w jego jądrze (izotop I). Atom drugiego z trwałych izotopów wapnia zawiera w jądrze neutrony w liczbie równej liczbie atomowej chromu (izotop II). Spośród sztucznie otrzymanych promieniotwórczych izotopów wapnia najtrwalszy jest izotop Ca-45, ulegający przemianie beta (-) .
Uzupełnij schemat przemiany beta (-) , której ulega nietrwały izotop wapnia Ca-45, wpisując w odpowiednie pola symbol oraz liczbę atomową i liczbę masową powstającego izotopu.
Zadanie 40. (SP14)
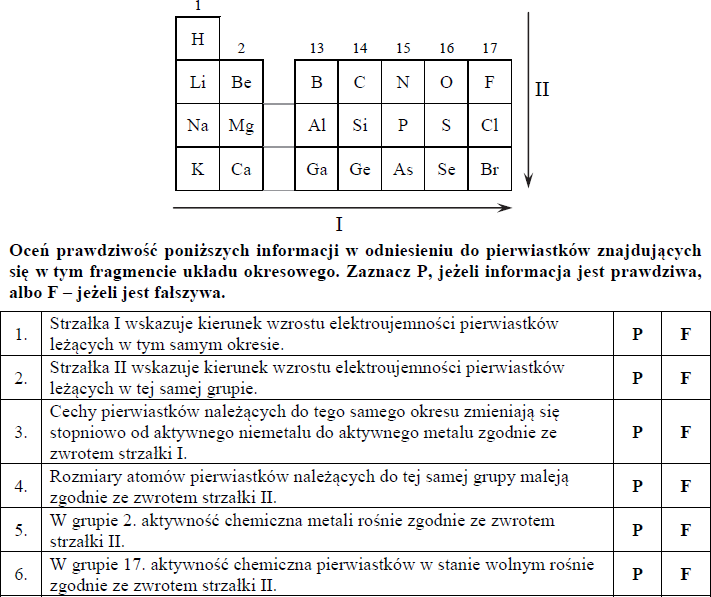
Na rysunku przedstawiono schemat układu okresowego pierwiastków (bez lantanowców i aktynowców), na którym umieszczono strzałki A i B odpowiadające kierunkom zmian wybranych wielkości charakteryzujących pierwiastki chemiczne.
Podkreśl wszystkie wymienione poniżej wielkości, których wzrost wskazują strzałki oznaczone literami A i B.
- Dla pierwiastków 1. grupy strzałka A wskazuje kierunek wzrostu elektroujemności /masy atomowej /ładunku jądra atomowego.
- Dla pierwiastków grup 1.–2. i 13.–17. okresu III strzałka B wskazuje kierunek wzrostu elektroujemności /masy atomowej /ładunku jądra atomowego.
- masy atomowej, ładunku jądra atomowego
2. elektroujemności, masy atomowej, ładunku jądra atomowego
Zadanie 41. (SP14)
Na poniższym schemacie układu okresowego pierwiastków (bez lantanowców i aktynowców) zaznaczono pocienienie trzech pierwiastków oznaczonych numerami I, II oraz III.
- P
- F
- P
Zadanie 42. (SP14)
Do trwałych izotopów siarki i argonu należą izotopy, których liczba masowa A wynosi 36.
a) Uzupełnij poniższe schematy, wpisując symbole opisanych izotopów siarki i argonu z uwzględnieniem ich liczby atomowej Z i liczby masowej A.
b) Podaj symbol i napisz konfigurację elektronową atomu w stanie podstawowym tego pierwiastka (siarki albo argonu), którego jądro atomowe zawiera więcej protonów.
Zadanie 43. (SP14)
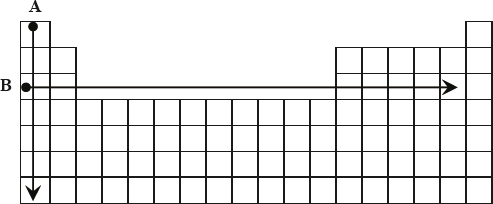
Odczytaj z układu okresowego pierwiastków wymienione w tabeli dane dotyczące cyny i uzupełnij tę tabelę.
Symbol pierwiastka: Sn
Liczba atomowa: 50
Masa atomowa, u: 119 lub 118,71
Numer grupy: 14
Numer okresu: 5
Zadanie 44. (SP14)
Cyna nie ulega działaniu słabych kwasów i zasad, dzięki czemu jest stosowana do pokrywania blachy stalowej w celu jej ochrony przed korozją. Z blachy tej wykonuje się puszki na konserwy. Aby odzyskać cynę z odpadów, działa się na nią chlorem i przekształca w chlorek cyny(IV). Mocne kwasy i zasady atakują cynę energicznie. W reakcji ze stężonym kwasem solnym cyna tworzy chlorek cyny(II), który jest solą dobrze rozpuszczalną w wodzie.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
a) Napisz w formie cząsteczkowej równanie reakcji cyny z chlorem.
b) Napisz w formie jonowej równanie reakcji cyny z kwasem solnym.
Zadanie 46. (SP14)
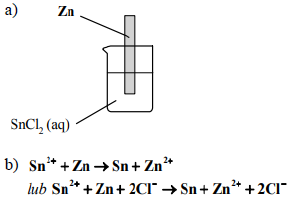
Szereg aktywności metali tworzą metale i wodór ułożone według ich podatności na utlenianie, czyli według zdolności tworzenia jonów naładowanych dodatnio. Każdy pierwiastek jest reduktorem kationów wszystkich pierwiastków położonych po jego prawej stronie w tym szeregu. Poniżej przedstawiono fragment szeregu aktywności metali.
Zn/Zn2+ Sn/Sn2+ H2/H+ Cu/Cu2+
Na podstawie: K.-H.Lutenschlagr, W. Schroter, A. Wanninger, „Nowoczesne kompendium chemii” Warszawa 2007.
Wskaż metal (cynk Zn albo miedź Cu), z którego wykonaną blaszkę należy zanurzyć w wodnym roztworze chlorku cyny(II), aby wydzieliła się cyna metaliczna.
a) Uzupełnij schemat doświadczenia, wpisując symbol wybranego metalu.
b) Napisz w formie jonowej równanie reakcji chemicznej, która zachodzi w czasie doświadczenie.
Zadanie 47. (SP14)
Cyna występuje w postaci dwóch odmian: cyny szarej i cyny białej. Cyna biała jest metalem srebrzystobiałym, ciągliwym i kowalnym, cyna szara tworzy szary proszek. Cyna biała jest trwała w temperaturze powyżej 13,4 °C, cyna szara jest trwała poniżej tej temperatury.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Wypełnij tabelę, wpisując literę P, jeżeli zdanie jest prawdziwe, lub literę F, jeżeli jest fałszywe.
- P
- F
- P
Zadanie 48. (SP14)
Pierwiastki X i Y tworzą związek chemiczny o następującym wzorze elektronowym:
Poniżej przedstawiono wzory sumaryczne pięciu związków chemicznych. Podkreśl wzory wszystkich związków, których budowę ilustruje powyższy wzór elektronowy.
CO2 CaCl2 H2S SO2 H2O
H2S, H2O
Zadanie 49. (SP15)
W układzie okresowym pierwiastków wyróżnia się 4 bloki konfiguracyjne:
blok s, który stanowią pierwiastki 1. i 2. grupy oraz hel – elektrony walencyjne atomów tych pierwiastków (w stanie podstawowym) zajmują w powłoce walencyjnej o numerze n podpowłokę ns
blok p, do którego należą pierwiastki z grup od 13. do 18. z wyjątkiem helu – w powłoce walencyjnej o numerze n atomów tych pierwiastków (w stanie podstawowym) można wyróżnić podpowłokę ns, która jest całkowicie obsadzona elektronami, oraz podpowłokę np, którą zajmują pozostałe elektrony walencyjne
blok d, do którego należą pierwiastki z grup od 3. do 12.
blok f, który stanowią lantanowce i aktynowce.
Poniżej wymieniono symbole sześciu pierwiastków.
B C N O F Ne
Wybierz i podkreśl w każdym nawiasie poprawne uzupełnienie poniższych zdań.
Pierwiastki, których symbole wymieniono powyżej, stanowią w układzie okresowym fragment (II okresu / III okresu / 2. grupy / 3. grupy) i należą do bloku konfiguracyjnego (s / p). Atomy tych pierwiastków mają w stanie podstawowym jednakowe rozmieszczenie elektronów walencyjnych w podpowłoce (2s / 2p), a różnią się rozmieszczeniem elektronów walencyjnych w podpowłoce (2s / 2p). Największą liczbę elektronów walencyjnych ma atom (fluoru / neonu).
Pierwiastki, których symbole wymieniono powyżej, stanowią w układzie okresowym fragment (II okresu / III okresu / 2. grupy / 3. grupy) i należą do bloku konfiguracyjnego (s / p). Atomy tych pierwiastków mają w stanie podstawowym jednakowe rozmieszczenie elektronów walencyjnych w podpowłoce (2s / 2p), a różnią się rozmieszczeniem elektronów walencyjnych w podpowłoce (2s / 2p). Największą liczbę elektronów walencyjnych ma atom (fluoru / neonu).
Zadanie 50. (SP15)
W układzie okresowym pierwiastków wyróżnia się 4 bloki konfiguracyjne: blok s, który stanowią pierwiastki 1. i 2. grupy oraz hel – elektrony walencyjne atomów tych pierwiastków (w stanie podstawowym) zajmują w powłoce walencyjnej o numerze n podpowłokę ns blok p, do którego należą pierwiastki z grup od 13. do 18. z wyjątkiem helu – w powłoce walencyjnej o numerze n atomów tych pierwiastków (w stanie podstawowym) można wyróżnić podpowłokę ns, która jest całkowicie obsadzona elektronami, oraz podpowłokę np, którą zajmują pozostałe elektrony walencyjne blok d, do którego należą pierwiastki z grup od 3. do 12. blok f, który stanowią lantanowce i aktynowce.
Zaznacz znakiem X na poniższym schemacie fragmentu układu okresowego wszystkie pierwiastki, które należą do bloku p, a ich atomy w powłoce walencyjnej (w stanie podstawowym) mają dokładnie trzy elektrony.
Zadanie 51. (SP15)
Określ tendencję zmiany (wzrasta, maleje) promienia atomowego i elektroujemności pierwiastków bloków konfiguracyjnych s i p w grupach układu okresowego pierwiastków.
W grupie w miarę wzrostu liczby atomowej promień atomowy ……………………………………………. , a elektroujemność ……………………………………… .
W grupie w miarę wzrostu liczby atomowej promień atomowy wzrasta, a elektroujemność maleje.
Zadanie 52. (SP15)
Poniżej wymieniono symbole sześciu pierwiastków chemicznych.
Br Ca Cl K S Se
Napisz symbole tych spośród wymienionych pierwiastków, które tworzą jony proste o konfiguracji argonu, oraz tych, które tworzą jony proste o konfiguracji kryptonu.
Jony proste o konfiguracji argonu tworzą: Ca, Cl, K, S
Jony proste o konfiguracji kryptonu tworzą: Br, Se
Jeżeli zdający zamiast symboli pierwiastków, poda ich poprawne nazwy lub poprawne wzory jonów prostych, odpowiedź taką należy ocenić pozytywnie.
Zadanie 53. (SP15)
Na trwałość jądra atomowego ma wpływ stosunek liczby neutronów do liczby protonów. Kiedy jądro ma nadmiar neutronów, w jego wnętrzu może zajść przemiana β –, w której z neutronu powstają proton, elektron i antyneutrino.
Antyneutrino, ῡ, jest nienaładowaną elektrycznie cząstką o masie spoczynkowej bliskiej zeru.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010 oraz A. Czerwiński, Energia jądrowa i promieniotwórczość, Warszawa 1998
Izotop węgla C-14 ulega przemianie β –, której produktem jest trwały izotop azotu.
Określ wartość liczby atomowej i liczby masowej izotopu azotu, który powstaje w wyniku opisanej przemiany.
Liczba atomowa Z = 7
Liczba masowa A = 14
Zadanie 54. (SP15)
Na trwałość jądra atomowego ma wpływ stosunek liczby neutronów do liczby protonów. Kiedy jądro ma nadmiar neutronów, w jego wnętrzu może zajść przemiana β –, w której z neutronu powstają proton, elektron i antyneutrino.
Antyneutrino, ῡ, jest nienaładowaną elektrycznie cząstką o masie spoczynkowej bliskiej zeru.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010 oraz A. Czerwiński, Energia jądrowa i promieniotwórczość, Warszawa 1998
Wybierz i podkreśl w każdym nawiasie poprawne uzupełnienie poniższych zdań.
W wyniku przemiany β – powstaje jądro, którego liczba atomowa Z jest (równa liczbie atomowej / mniejsza o 1 od liczby atomowej / większa o 1 od liczby atomowej) jądra ulegającego tej przemianie i którego liczba masowa A jest (równa liczbie masowej / mniejsza o 1 od liczby masowej / większa o 1 od liczby masowej) jądra ulegającego tej przemianie.
W wyniku przemiany β – powstaje jądro, którego liczba atomowa Z jest większa o 1 od liczby atomowej jądra ulegającego tej przemianie i którego liczba masowa A jest równa liczbie masowej jądra ulegającego tej przemianie.
Zadanie 55. (SP16)
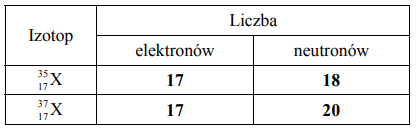
Pierwiastek X występuje w przyrodzie w postaci mieszaniny dwóch izotopów, których liczby masowe są równe 35 i 37. Uzupełnij poniższą tabelę – określ liczbę elektronów w atomach obu izotopów pierwiastka X oraz liczbę neutronów w jądrach atomowych tych izotopów.
Zadanie 56. (SP16)
Końcowym produktem szeregu promieniotwórczego uranowo-radowego jest trwały izotop ołowiu Pb-206. Jądro Pb-206 powstaje w wyniku emisji cząstki α przez jądro izotopu innego pierwiastka.
Podaj symbol tego pierwiastka. Określ liczbę masową A jego izotopu, który uczestniczy w opisanej przemianie α.
Symbol pierwiastka: Po Liczba masowa izotopu A: 210
Zadanie 57. (SP16)
Napisz konfigurację elektronową atomu (w stanie podstawowym) fosforu.
Zadanie 58. (SP16)
Spośród jonów o wzorach przedstawionych poniżej wybierz wszystkie, których konfiguracja elektronowa w stanie podstawowym jest taka sama jak konfiguracja elektronowa atomu neonu w stanie podstawowym. Wzory wybranych jonów podkreśl.
Br –, Cl –, F –, K +, Mg 2+, Na +, O 2–, S 2–
F– Mg2+ Na+ O2–
Zadanie 59. (SP16)
Poniżej przedstawiono fragment uproszczonego układu okresowego pierwiastków.
- – P 2. – F 3. – F 4. – F 5. – P 6. – F
Zadanie 60. (SP16)
Przeprowadzono reakcję amoniaku z tlenem zachodzącą według równania:
4NH3 (g) + 5O2 (g) → 4NO (g) + 6H2O (g)
Uzupełnij następujące zdania – wpisz liczbę moli, stosunek masowy oraz stosunek objętościowy reagentów reakcji przebiegającej zgodnie z powyższym równaniem.
Do utlenienia 8 moli NH3 potrzeba ……..……. moli O2. W wyniku reakcji powstanie ……..……. moli H2O. Stosunek masy NO powstającego w wyniku reakcji do masy użytego O2 jest równy: NO O2 m m: = ……..……. : ……..……. Stosunek objętości (w warunkach normalnych) substratów reakcji jest równy: VNH3:VO2 = ……..……. : ……..…….
- Do utlenienia 8 moli NH3 potrzeba 10 moli O2. W wyniku reakcji powstanie 12 moli H2O.
- Stosunek masy powstającego w wyniku reakcji NO do masy użytego O2 jest równy:
NO O2 m m: = 3 : 4.
- Stosunek objętości (w warunkach normalnych) substratów reakcji jest równy:
NH O 3 2 V V: = 4 : 5.
Uwaga: W zdaniu 2. poprawna jest każda odpowiedź odpowiadająca stosunkowi 120 : 160.
W zdaniu 3. poprawna jest każda odpowiedź odpowiadająca stosunkowi 4 : 5.
Zadanie 61. (SP17)
Poniżej podano informacje o dwóch pierwiastkach oznaczonych umownie literami A i D:
Pierwiastek A tworzy jednododatni kation o następującej konfiguracji elektronowej (w stanie podstatowym): 1s2 2s2 2p6 3s2 3p6 (K2 L8 M8).
Pierwiastek D leży w trzecim okresie i szesnastej grupie układu okresowego pierwiastków.
a) Podaj nazwę lub symbol chemiczny pierwiastka A oraz dokończ poniższe zdania.
- Nazwa lub symbol chemiczny pierwiastka A: …………………………………………………………….
- Kationy pierwiastka A o wzorze A+ mają konfigurację elektronową gazu szlachetnego o nazwie ………………………………………………………………………………………………………………. .
- Liczba atomowa Z pierwiastka A jest równa ……………………………………………………………. .
- Pierwiastek A leży w ……………..………. okresie i …………..………….. grupie układu okresowego pierwiastków.
b) Podaj nazwę lub symbol chemiczny pierwiastka D oraz dokończ poniższe zdania.
- Nazwa lub symbol chemiczny pierwiastka D: …………………………………………………………….
- Jądro atomowe pierwiastka D zawiera ……………………………………………………… protonów.
- Konfiguracja elektronów walencyjnych w atomie (w stanie podstawowym) pierwiastka D jest następująca: ……………………………………………………………………………………………………. .
- Najniższy stopień utlenienia pierwiastka D jest równy ……………..………., a najwyższy wynosi …………..………….. .
a)
- Nazwa lub symbol chemiczny pierwiastka A: potas lub K
- Kationy pierwiastka A o wzorze A+ mają konfigurację elektronową gazu szlachetnego o nazwie argon.
- Liczba atomowa Z pierwiastka A jest równa 19.
- Pierwiastek A leży w czwartym lub 4. lub IV okresie i pierwszej lub 1. lub I grupie układu kresowego pierwiastków.
b)
- Nazwa lub symbol chemiczny pierwiastka D: siarka lub S
- Jądro atomowe pierwiastka D zawiera 16 protonów.
- Konfiguracja elektronów walencyjnych w atomie (w stanie podstawowym) pierwiastka D jest następująca: 3s23p4 lub 3s2p4 lub s2p4 lub M6.
- Najniższy stopień utlenienia pierwiastka D jest równy – II, a najwyższy wynosi (+) VI.
Zadanie 62. (SP17)
Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.
- – P, 2. – F, 3. – P
Zadanie 63. (SP17)
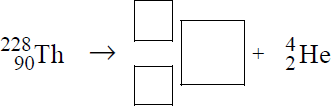
Izotop toru 228 90Th ulega przemianie α, tzn. emituje jądra helu.
Uzupełnij schemat opisanej przemiany – wpisz w odpowiednie pola symbol oraz liczbę atomową i liczbę masową powstającego izotopu.
Zadanie 64. (SP17)
W poniższej tabeli zestawiono wartości okresu półtrwania czterech izotopów promieniotwórczych polonu:
Spośród izotopów polonu wymienionych w tabeli wybierz najmniej trwały i napisz, ile neutronów znajduje się w jego jądrze.
Liczba neutronów: (212 – 84 =) 128
Zadanie 65. (SP17)
Poniżej podano wzory sześciu substancji. Spośród substancji, których wzory przedstawiono poniżej, wybierz wszystkie substancje niejonowe i podkreśl ich wzory.
CH3OH, HBr, O2
Zadanie 66. (SP18)
W stanie podstawowym atomy pewnego pierwiastka mają następującą konfigurację elektronów walencyjnych: 3s2 3p2 (M4 )
Podaj symbol tego pierwiastka oraz dane dotyczące jego położenia w układzie okresowym (numer grupy i okresu).
Symbol pierwiastka: Si,
Numer grupy: 14
Numer okresu: 3 lub III lub trzeci
Zadanie 67. (SP18)
W jądrze pierwiastka X znajduje się tyle protonów, ile neutronów zawiera jądro izotopu Ti-48. Liczba masowa jednego z izotopów pierwiastka X jest równa liczbie elektronów w atomie izotopu Ba-138.
Na podstawie powyższej informacji ustal liczbę atomową pierwiastka X oraz liczbę neutronów w jądrze opisanego izotopu pierwiastka X.
Liczba atomowa (Z): 26 Liczba neutronów: 30
Zadanie 68. (SP18)
Jądro promieniotwórczego izotopu pierwiastka E uległo przemianie β− zgodnie z poniższym schematem
Korzystając z układu okresowego, ustal symbol pierwiastka E lub podaj jego nazwę.
Co lub kobalt
Zadanie 69. (SP18)
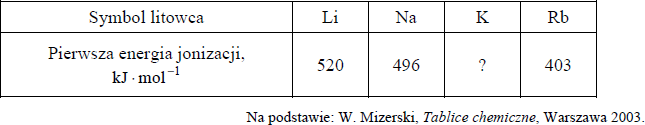
Elektrony w atomach są przyciągane przez jądro, więc usunięcie elektronu z powłoki wymaga nakładu energii, która jest nazywana energią jonizacji. Pierwsza energia jonizacji to minimalna energia potrzebna do oderwania jednego elektronu od atomu. Poniżej podane są wartości pierwszej energii jonizacji litu, sodu i rubidu.
Uzupełnij poniższe zdania, tak aby otrzymane informacje były prawdziwe.
Lit ma (niższą / wyższą) wartość pierwszej energii jonizacji niż sód, ponieważ w jego atomie elektron walencyjny znajduje się (bliżej jądra / dalej od jądra) niż elektron walencyjny w atomie sodu. Im mniejszy jest promień atomu litowca, tym (mniejsza / większa) jest energia potrzebna do oderwania elektronu od atomu. Pierwsza energia jonizacji potasu jest równa (510 / 419 / 376) 1 kJ mol .
Lit ma ( wyższą) wartość pierwszej energii jonizacji niż sód, ponieważ w jego atomie elektron walencyjny znajduje się (bliżej jądra ) niż elektron walencyjny w atomie sodu. Im mniejszy jest promień atomu litowca, tym ( większa) jest energia potrzebna do oderwania elektronu od atomu. Pierwsza energia jonizacji potasu jest równa ( 419 ) kJ mol .