Właściwości i reakcje wodorków?
Wodorki to związki wodoru z innymi pierwiastkami – metalami i niemetalami. Wodorki dzieli się na wodorki metali, które zawsze mają charakter zasadowy (np. NaH, CaH2) oraz wodorki niemetali – kwasowe (np. HCl), zasadowe (np. NH3), obojętne (np. CH4) i amfoteryczne (np. H2O). Wodór w wodorkach występuje na -I lub +I stopniu utlenienia.
Wzór ogólny
HnX lub XHn
Gdzie:
H – wodór
X – pierwiastek
n – wartościowość pierwiastka X
Nazewnictwo
Wodorki pierwiastków grup od 1 do 15 nazywane są analogicznie do tlenków. Odpowiadamy sobie na pytanie: wodorek czego? Litu LiH, sodu NaH itd. Ich wzory zapisujemy według schematu XHn. Wodorki pierwiastków grup 16 i 17 nazywane są według zasady „pierwiastko”-wodór, np. HCl – chlorowodór, H2S – siarkowodór. Ich wzory zapisujemy według schematu HnX.
Maksymalna wartościowość pierwiastków grup głównych względem wodoru
| Grupa układu okresowego | 1 | 2 | 13 | 14 | 15 | 16 | 17 |
| Maksymalna wartościowość względem wodoru | I | II | III | IV | III | II | I |
| Przykłady związków z wodorem | NaH | MgH2 | AlH3 | CH4 | NH3 | H2S | HCl |
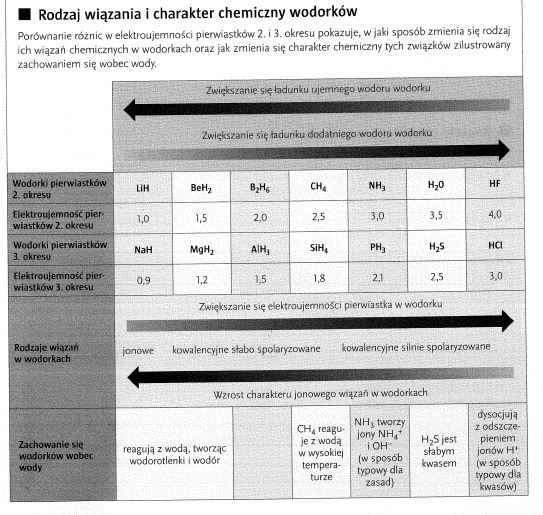
Charakter chemiczny wodorków
Charakter chemiczny wodorków może być wieloraki. Zmienia się wraz ze zmianą wartości elektroujemności pierwiastka w wodorku. Im większa elektroujemność pierwiastka w wodorku, tym silniejszy ładunek dodatni ma wodór i wykazuje bardziej kwasowy charakter. Im mniejsza elektroujemność pierwiastka, tym silniejszy ładunek ujemny ma wodór i wykazuje bardziej zasadowy charakter.
Podział wodorków
Wodorki dzieli się na:
- Metaliczne – produkty syntezy wodoru z metalami bloków d i f, odznaczają się połyskiem i własnościami metalicznymi, często tworzą związki niestechiometryczne.
- Międzywęzłowe – ciała stałe składające się z sieci krystalicznej z wbudowanymi w przestrzennie międzywęzłowe atomami wodoru.
- Kowalencyjne – gazy lub lotne ciecze. Tworzą je węglowce, azotowce, tlenowce i fluorowce oraz beryl, magnez i bor. Posiadają bardzo zróżnicowane własności chemiczne. Dzielą się na: wodorki o charakterze obojętnym np. CH4, SiH4, wodorki o charakterze zasadowym np. NH3, PH3, odorki o charakterze kwasowym np. H2
- Typu soli – związki tworzące sieci jonowe, powstające w wyniku reakcji wodoru z litowcami i berylowcami (oprócz berylu i magnezu). Zawierają jony wodorkowe H- ; w reakcji z wodą wydzielają wodór.
Otrzymywanie wodorków
- Większość wodorków jest otrzymywana w wyniku bezpośredniej syntezy wodoru z pierwiastkiem
H2 + S → H2S
- Litowce i fluor łączą się z wodorem samorzutnie
H2 + 2 Na → 2 NaH
H2 + F2 → 2 HF
- Aby zaszła reakcja wodoru z chlorem niezbędne jest światło
H2 + Cl2 → 2 HCl
- Reakcja otrzymywania amoniaku zachodzi w obecności katalizatora platynowego
N2 + 3 H2 → 2 NH3
- Wodorki fluorowców i siarki (czyli kwasy beztlenowe tych pierwiastków) można otrzymać w reakcjach ich soli beztlenowych z mocnymi kwasami
CaF2 + H2SO4 → CaSO4 + 2 HF
- Wodorki otrzymuje się także w innych metodach pośrednich.
Reaktywność wodorków
- Zasadowe wodorki metali reagują gwałtownie z wodą z wydzieleniem wodoru. W reakcji powstają zasady.
CaH2 + 2 H2O → Ca(OH)2 + H2↑
- Wodorki fluorowców i siarki rozpuszczają się w wodzie, tworząc kwasy beztlenowe.
H2O
HCl(g) → HCl(aq)
- Wodorki fluorowców i siarki reagują z zasadami, tworząc sole kwasów beztlenowych.
HI + KOH → KI + H2O
- Amoniak reaguje z wodą, tworząc jony amonu i wodorotlenkowe.
NH3 + H2O → NH4+ + OH–










