Aldehydy – otrzymywanie i charakterystyczne reakcje
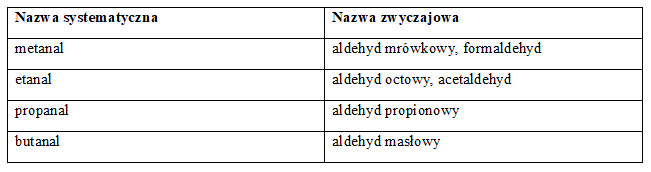
Aldehydy to związki organiczne, które zawierają w swojej cząsteczce grupę aldehydową, czyli -CHO, połączoną z atomem węgla. Tworzenie nazw tych związków polega na dodaniu przyrostka -al do nazwy odpowiadającego im węglowodoru, np. HCHO to metanal, a CH3CHO – etanal. Niektóre związki mają też nazwy zwyczajowe (w tabeli podano najważniejsze z nich).
Numerację atomów węgla w aldehydach zaczyna się zawsze od węgla grupy aldehydowej.
>> Chcesz dobrze zdać maturę z chemii? Zobacz ebook Chemia część 4.
Otrzymywanie aldehydów
Aldehydy są produktem reakcji utleniania alkoholi I-rzędowych.
R-CH2-OH + [O] → R-CHO + H2O – reakcja przebiega w podwyższonej temperaturze
Można je także otrzymać poprzez odwodornienie alkoholi I-rzędowych
R-CH2-OH → R-CHO + H2 – reakcja przebiega w podwyższonej temperaturze i w obecności Pb
lub redukcję kwasów karboksylowych:
- CH3-COOH → CH3-CHO
Aldehydy – charakterystyczne reakcje
Aldehydy to dobre reduktory, dlatego wykazują dodatnią próbę Tollensa i Trommera.
- W próbie Tollensa utleniaczem są jony srebra. Na ściankach probówki podczas przeprowadzania tej reakcji osadza się metaliczne srebro, tworząc lustro – stąd inna nazwa doświadczenia to próba lustra srebrnego. Dla najprostszego aldehydu, metanalu, reakcja zachodząca w probówce wygląda następująco: HCHO + Ag2O HCOOH + 2Ag↓
- W próbie Trommera wykorzystuje się natomiast roztwór siarczanu (VI) miedzi (II) i wodorotlenku sodu. Powstaje niebieski, koloidalny osad Cu(OH)2, który po ogrzaniu w obecności aldehydu zmienia barwę na ceglastoczerwoną – powstaje Cu2 Zachodzi reakcja:
HCHO + 2Cu(OH)2 → HCHO + Cu2O↓ + 2H2O
Próby te umożliwiają odróżnienie aldehydów i ketonów, gdyż te drugie nie ulegają wyżej wymienionym reakcjom.
Inne reakcje aldehydów
- Redukcja – aldehydy ulegają redukcji do alkoholi I-rzędowych, np.
CH3-CH2-CH2-CHO + H2 → CH3-CH2-CH2-CH2OH – reakcja przebiega w podwyższonej temperaturze, zmienionym ciśnieniu i w obecności katalizatora
- Spalanie w powietrzu, np.
HCHO + O2 → CO2 + H2O
- Polimeryzacja
n HCHO → -(CH2-O-)n–