Fenol – powstawanie i charakterystyczne reakcje
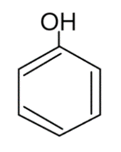
Najprostszy przedstawiciel związków z grupy fenoli to Fenol (inaczej benzenol). Charakteryzuje się tym, że grupa -OH jest połączona bezpośrednio z węglem pierścienia aromatycznego. Fenol jest bezbarwną, krystaliczną substancją, a jego wzór zapisuje się w sposób następujący:
Możliwy jest także zapis wzoru sumarycznego: C6H5OH.
Otrzymywanie fenolu
- Otrzymywanie fenolu z chlorobenzenu
Etap I – utworzenie fenolanu sodu z chlorobenzenu:
C6H5Cl + 2 NaOH C6H5ONa + NaCl + H2O – reakcja zachodzi w środowisku wodnym, w warunkach podwyższonego ciśnienia, zwiększonej temperatury i przy udziale katalizatora
Etap II – powstanie fenolu:
C6H5ONa + HCl C6H5OH + NaCl
- Metoda Kumenowa
Etap I – produktem reakcji jest 2-fenylopropan (kumen)
C6H6 + H3C-HC=CH2 C6H5-CH-(CH3)2 – reakcja zachodzi w obecności katalizatora – AlCl3
Etap II – utworzenie fenolu
C6H5-CH-(CH3)2 + O2 C6H5OH + H3C-CO-CH3 – reakcja zachodzi pod wpływem H2SO4
>> Chcesz dobrze zdać maturę z chemii? Zobacz ebook Chemia część 4.
Charakterystyka fenolu
- Fenol wykazuje właściwości kwasowe, dlatego reaguje z zasadami, np. NaOH
C6H5OH + NaOH → C6H5ONa + H2O – powstaje fenolan sodu
- Reaguje z metalami aktywnymi, co podobnie jak poprzednia reakcja, skutkuje powstaniem soli fenolu
2 C6H5OH + 2 Na → 2 C6H5ONa + H2↑
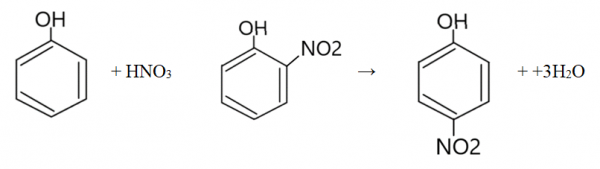
- Fenol ulega reakcjom substytucji, których przykładami są bromowanie (reakcja z Br2) oraz nitrowanie (reakcja z HNO3).
- Bromowanie fenolu
Produktem reakcji jest 2,4,6 – tribromofenol
- Nitrowanie fenolu
W wyniku reakcji powstaje mieszanina produktów – o-nitrofenol oraz p-nitrofenol. - Reakcja fenolu z formaldehydem – polikondensacja
Reakcja zachodzi pod wpływem podwyższonej temperatury, wymaga także katalizatora (NaOH albo HCl). Produktem jest żywica fenolowo – formaldehydowa.
- Fenol w środowisku wodnym ulega hydrolizie
C6H5OH C6H5O– + H+ – powstaje jon fenolowy - Wykrywanie fenolu w próbkach – doświadczenie
Do wodnego roztworu fenolu dodajemy roztwór FeCl3. Roztwór przybiera fioletową barwę, na skutek powstania związku kompleksowego.
3 C6H5OH + FeCl3 (aq) → (C6H5O)3Fe + 3HCl



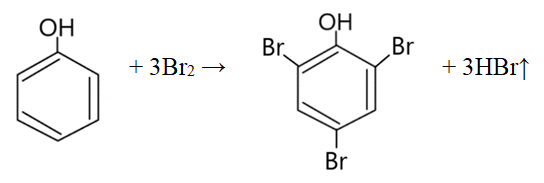 Produktem reakcji jest 2,4,6 – tribromofenol
Produktem reakcji jest 2,4,6 – tribromofenol
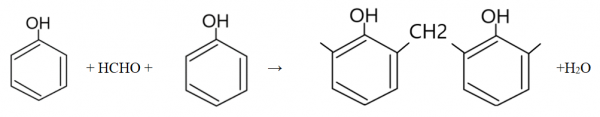 Reakcja zachodzi pod wpływem podwyższonej temperatury, wymaga także katalizatora (NaOH albo HCl). Produktem jest żywica fenolowo – formaldehydowa.
Reakcja zachodzi pod wpływem podwyższonej temperatury, wymaga także katalizatora (NaOH albo HCl). Produktem jest żywica fenolowo – formaldehydowa.






