Co to hybrydyzacja?
Aby móc rozmawiać o hybrydyzacji, musimy przypomnieć sobie krótko, czym są orbitale elektronowe. Orbital to matematyczna funkcja falowa, która opisuje prawdopodobieństwo znalezienia elektronu w przestrzeni. Jest to zatem jakiś obszar, po którym elektron się porusza, ale nie ma on sztywnych ram i nie można go w żaden sposób zobaczyć. Wyróżniamy orbitale s (w kształcie kuli), p (w kształcie trójwymiarowej ósemki), d (w kształcie trójwymiarowej czterolistnej koniczyny) i f (kombinacja kształtów trójwymiarowych ósemek i torusów).
Hybrydyzacja to operacja matematyczna, która polega na tworzeniu mieszanych orbitali elektronowych poprzez liniową kombinację funkcji falowych. Co to oznacza? Zabieg ten pozwala przewidzieć, w jakich obszarach poruszają się elektrony po stworzeniu wiązania chemicznego. Przy tworzeniu wiązań dochodzi do wymieszania pierwotnie występujących orbitali w atomie. Otrzymujemy zatem zupełnie nowy kształt zhybrydyzowanych orbitali stworzony na bazie orbitali elektronów tworzących wiązanie chemiczne. Nie tylko kształt orbitali po hybrydyzacji się zmienia, ale też ich gęstość elektronowa. Wszystkie nowo powstałe po hybrydyzacji orbitale mają taki sam kształt i energię. Suma energii powstałych orbitali zhybrydyzowanych jest równoważna z sumą energii orbitali pierwotnych.
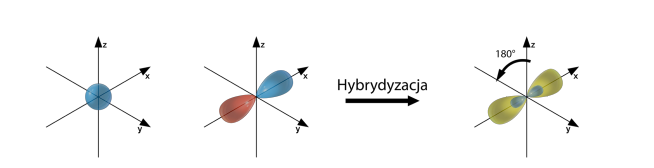
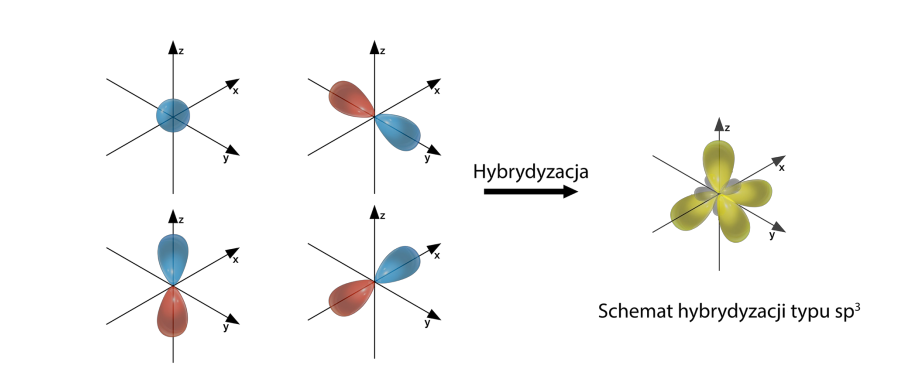
Podsumowując, podczas tworzenia wiązania chemicznego, orbitale mieszają się ze sobą, tworząc nowe orbitale. Np. w atomie C dwa elektrony walencyjne znajdują się na orbitalu s i po jednym na orbitalach px i py. Przed stworzeniem wiązania z innym atomem dochodzi do wzbudzenia i przeniesienia jednego z elektronów z orbitalu s na orbital pz. Tym sposobem mamy po jednym elektronie na orbitalach s, px, py i pz o różnym kształcie i energii. Po hybrydyzacji powstają 4 orbitale sp3 o takim samym kształcie i energii.
Jakie są typy hybrydyzacji?
Wyróżniamy różne typy hybrydyzacji i kształty orbitali zhybrydyzowanych. Zależą one od ilości i rodzaju orbitali, biorących udział w wiązaniu. Określenie typu hybrydyzacji jest stosunkowo proste. Należy policzyć, ile orbitali bierze udział w hybrydyzacji, a ich liczba wskaże typ hybrydyzacji. Skąd mamy wiedzieć, ile tych orbitali jest? W uproszczeniu: każdy podstawnik i wolna para elektronowa to osobny orbital. Np. w cząsteczce CH4 występują cztery orbitale, ponieważ węgiel tworzy cztery wiązania, po jednym z każdym atomem wodoru. Typ hybrydyzacji przekłada się też na kształt cząsteczki.
| Suma liczby podstawników i liczby wolnych par elektronowych | Orbitale biorące udział w hybrydyzacji | Typ hybrydyzacji | Nazwa hybrydyzacji | Kształt cząsteczki |
| 2 | s, px | sp | liniowa | liniowa |
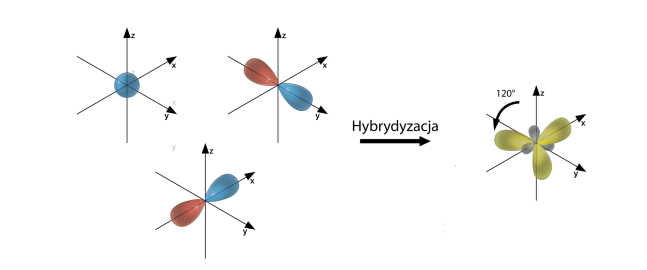
| 3 | s, px, py | sp2 | trygonalna | trójkąt płaski |
| 4 | s, px, py, pz | sp3 | tetraedryczna | Piramida trygonalna/tetraedr |
Hybrydyzacja typu sp
Hybrydyzacja sp występuje w przypadku atomów pierwiastków z drugiej grupy głównej, czyli posiadających tylko dwa elektrony walencyjne, np. BeH2, w przypadku wiązań podwójnych, gdy dwa wiązania podwójne występują przy jednym atomie, np. CO2 oraz w przypadku wiązań potrójnych, np. C2H2.
Hybrydyzacja typu sp2
Hybrydyzacja sp2 występuje dla atomów posiadających trzy elektrony walencyjne, np. BH3 lub gdy powstają wiązania podwójne, np. SO3.
Hybrydyzacja typu sp3
Hybrydyzacja typu sp3 występuje, kiedy atom posiada cztery elektrony walencyjne, np. CH4.