Odmiany alotropowe węgla – czym są, jakie znamy?
Alotropia to zjawisko występowania tych samych pierwiastków chemicznych w różnych postaciach, które mają odmienne właściwości fizyczne i chemiczne. Termin „alotropia” pochodzi z języka greckiego od słówn „allos” (inny) i „tropos” (rodzaj). Odmiany alotropowe pierwiastka mogą różnić się liczbą atomów w cząsteczce, jak ma to miejsce np. dla tlenu: O2 to tlen atmosferyczny, O3 – ozon, a O4 – tlen czerwony oraz budową sieci krystalicznej.
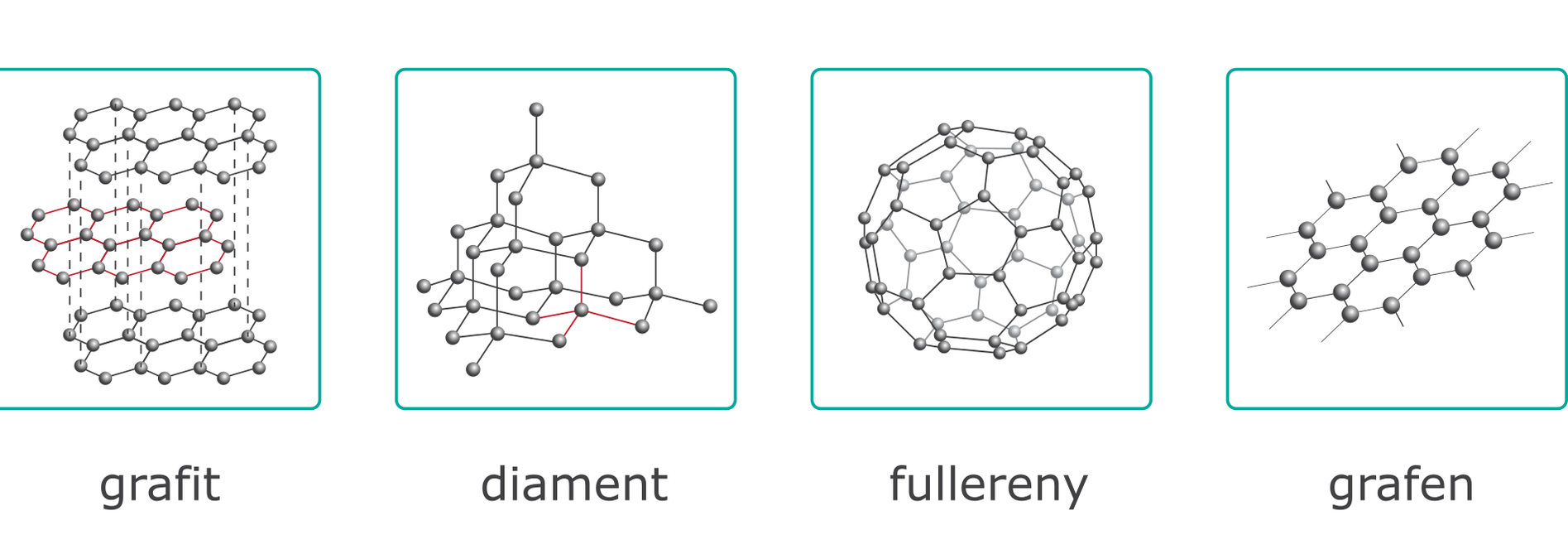
Odmiany alotropowe węgla różnią się właśnie budową sieci krystalicznej.
Grafit
Grafit to odmiana alotropowa węgla wykorzystywana przy pisaniu ołówkami. Grafit stanowi właśnie ich wypełnienie – rysik. Ma czarnoszarą barwę i metaliczny połysk. Jest tłusty w dotyku, wykazuje doskonałe właściwości smarne. Grafit nie rozpuszcza się w wodzie, jest mało aktywny chemicznie i nieszkodliwy dla środowiska. Zbudowany jest z pojedynczych, płaskich warstw ułożonych jedna nad drugą, które łączą się, tworząc sieć. Każda z warstw budową przypomina plaster miodu. Atomy węgla tworzą 6-atomowe pierścienie o regularnej budowie, które łączą się ze sobą, uwspólniając od 3 do 5 atomów węgla z drugim pierścieniem – mają one wspólne boki. Atomy węgla w warstwach połączone są silnymi wiązaniami kowalencyjnymi, natomiast między warstwami – słabymi oddziaływaniami van der Waalsa. Kryształy grafitu są miękkie i łatwo można je łupać. Grafit jest odporny na wysokie temperatury, wykazuje dużą odporność mechaniczną na ściskanie, ale niewielką na rozciąganie. Siła wiązań między warstwami grafitu jest mała, co wykorzystuje się podczas pisania i rysowania, gdyż poszczególne warstwy grafitu łatwo oddzielają się od siebie, pozostając na kartce papieru.
Grafit jest stosowany nie tylko do pisania. Wytwarza się z niego materiały ogniotrwałe takie jak beton grafitowy i cegły węglowe. Grafitu używa się do produkcji klocków hamulcowych, szczotek węglowych, farb antykorozyjnych, suchych smarów, elektrod, moderatorów w reaktorach atomowych i kompozytów grafitowych – lekkich materiałów konstrukcyjnych stosowanych do budowania np. bolidów.
Diament
Diamenty to najbardziej szlachetna odmiana alotropowa węgla. Powstały one około 4 miliardy lat temu 2 tysiące km pod ziemią w ekstremalnych warunkach ciśnienia i temperatury. Sieć przestrzenna diamentu zbudowana jest z atomów węgla łączących się w taki sposób, że tworzą cząstki o kształcie czworościanów foremnych. W diamentach każdy atom węgla łączy się z czterema innymi atomami węgla. Diament jest materiałem niezwykle twardym (10 w skali Mohsa), co zawdzięcza krótkim i mocnym wiązaniom kowalencyjnym między atomami węgla.
Czyste diamenty tworzą bezbarwne kryształy. Jednak większość z nich, występująca naturalnie, w sieci krystalicznej zawiera atomy innych pierwiastków, które nadają kryształom zabarwienie. W przyrodzie występują diamenty żółte, czerwone, niebieskie, fioletowe i czarne. Diamenty są nieaktywne chemicznie, nie przewodzą prądu elektrycznego, ale przewodzą ciepło. Są niezwykle twarde i ostre, ale przy tym kruche. Diamenty wykorzystuje się do produkcji wierteł, tarcz do szlifowania, czy ostrzy do cięcia. Nie można pominąć dekoracyjnej roli diamentów. Te kamienie będące synonimem bogactwa i luksusu po oszlifowaniu używane są do wyrobu biżuterii. Bardzo silnie załamują one i rozszczepiają światło. Oszlifowany diament to brylant.
Fullereny
Fullereny zostały odkryte w 1985 r. przez Harolda Kroto, Richarda Smalleya i Roberta Curla. Jednak nazwa tej odmiany węgla nie pochodzi od nazwiska żadnego z nich, a od postaci R. Buckminster Fullera, który konstruował struktury geodezyjne przypominające cząsteczki fullerenów. Zatem jaki kształt mają fullereny?
Fullereny to cząsteczki zbudowane z parzystej ilości atomów węgla, zawierające od 28 do około 1500 atomów. Atomy węgla łączą się w nich w pierścienie 5-atomowe oraz 6-atomowe. Najbardziej znany fulleren C60 wygląda, jak piłka futbolowa, ma kształt kulisty. Odkryto także fullereny o kształcie nanorurek oraz nanocebulek. Cząsteczki fullerenów są puste w środku.
Fullereny to czarne ciała stałe o metalicznym połysku. Nie rozpuszczają się w wodzie. Rozpuszczają się w rozpuszczalnikach aromatycznych takich jak benzen i toluen. Fullereny są mało aktywne chemicznie. Można natomiast w ich wnętrzach umieszczać inne pierwiastki. Fullereny stosuje się do produkcji kosmetyków niszczących wolne rodniki, nośników leków np. blokujących aktywne centra wirusa HIV, do wzmacniania folii aluminiowej, wydłużania trwałości żywności, produkcji materiałów fotoprzewodzących stosowanych w drukarkach, w elektrotechnice i katalizie, np. jako stabilizatory paliw lotniczych, diody, katalizatory, w nanotechnologii w układach mikroelektronicznych i wielu innych.
Grafen
Grafen to jedna z najpóźniej odkrytych odmian alotropowych węgla. Został uzyskany po raz pierwszy w 2004 roku przez Andre Geima i Kostyna Novoselova. Grafen to pojedyncza warstwa grafitu o grubości jednego atomu. Grafen ma niezwykłe właściwości. Jest twardszy nawet od diamentu, bardzo rozciągliwy, doskonale przewodzi ciepło i prąd, a naniesiony na inne materiały, nadaje im swoje właściwości. Jego wiązania atomowe są tak ścisłe, że nawet bakterie nie są w stanie przedostać się przez warstwę grafenu. Grafen prawdopodobnie zastąpi krzem w produkcji elektroniki, ponieważ elektrony w nim poruszają się 200 razy szybciej niż w krzemie. Grafen ma ogromny potencjał do wykorzystania w przyszłości, np. w materiałach opatrunkowych (nie przepuszcza bakterii), konstrukcji samolotów (ma bardzo niską gęstość), czy przede wszystkim w elektronice.
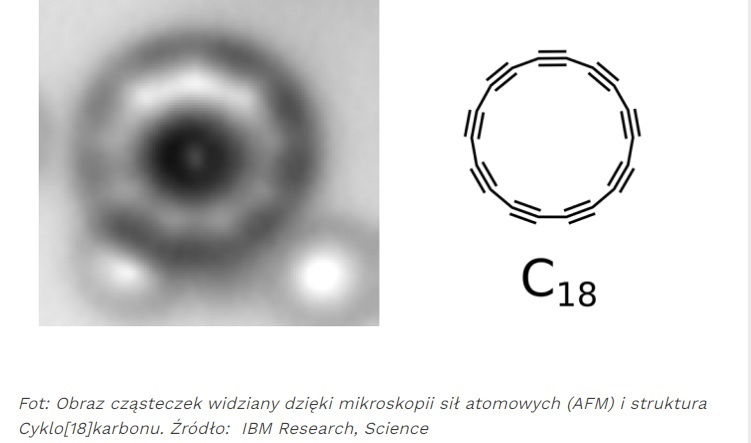
Cyklokarbon
Czy istnieje nowsze odkrycie w alotropii węgla niż grafen? Tak! Jest to cyklokarbon. Cyklokarbon został odkryty w 2019 roku. Ma postać pierścienia zbudowanego z 18 atomów węgla i grubość 1 atomu. Dotychczas o cyklokarbonie wiadomo niewiele. Prawdopodobnie ma właściwości półprzewodnika i może zostać wykorzystany do dalszej miniaturyzacji urządzeń elektronicznych.