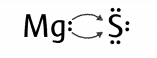Stopnie utlenienia pierwiastków
Stopień utlenienia jest pojęciem umownym. Często pokrywa się z wartościowością pierwiastka, ale nie można obu tych pojęć traktować jednoznacznie. Stopień utlenienia pierwiastka w danym związku chemicznym to liczba dodatnich lub ujemnych ładunków elementarnych, jakie można by przypisać atomom danego pierwiastka w związku, gdyby wszystkie wiązania utworzone przez ten atom były jonowe. Inaczej stopień utlenienia pierwiastka można wyjaśnić następująco: Jest to liczba oddanych lub przyjętych przez atom elektronów przy założeniu, że wszystkie wiązania w tym związku są wiązaniami jonowymi. Wartość stopnia utlenienia zapisujemy cyframi rzymskimi.
Przykład:
Magnez reaguje z siarką w taki sposób, że atom magnezu oddaje dwa elektrony, a atom siarki przyjmuje dwa elektrony. Ładunek magnezu zmniejsza się, więc jego stopień utlenienia jest dodatni +II. Ładunek siarki zwiększa się po przyjęciu elektronów, więc jej stopień utlenienia jest ujemny -II.
Jak obliczać stopnie utlenienia?
- Atomy i cząsteczki pierwiastków w stanie wolnym mają zawsze stopień utlenienia równy 0, np. Na, S, F2, O2.
- Suma wszystkich stopni utlenienia atomów budujących cząsteczkę jest równa 0.
- Stopień utlenienia pierwiastka w jonie prostym jest równy ładunkowi tego jonu.
- Suma stopni utlenienia wszystkich atomów wchodzących w skład jonu równa jest ładunkowi jonu.
- Wodór w większości związków występuje na +I stopniu utlenienia, jednak w wodorkach litowców i berylowców przyjmuje wartość -I.
- Tlen w większości związków występuje na -II stopniu utlenienia, jednak w nadtlenkach (np. H2O2) przyjmuje wartość -I, w ponadtlenakch (np. KO2) – 1/2, a w cząsteczce fluorku tlenu OF2 – II.
- Fluor w związkach zawsze występuje na -I stopniu utlenienia.
- Litowce w związkach chemicznych przyjmują zawsze stopień utlenienia +I, berylowce +II, a bor i glin +III.
- Metale w związkach występują na dodatnich stopniach utlenienia.
- Niemetale mogą przyjmować szeroki zakres dodatnich i ujemnych stopni utlenienia, np. azot i fosfor od -III do +V, siarka od -II do +VI, chlor od -I do +VII.
- W cząsteczkach związków chemicznych dodatni stopień utlenienia przyjmuje pierwiastek o niższej elektroujemności, a ujemny – o wyższej elektroujemności.
- Stopień utlenienia niemetalu w wchodzącego w skład jonu reszty kwasowej jest taki sam, jak stopień utlenienia tego niemetalu w odpowiednim kwasie.
- W związkach organicznych każdy atom węgla traktuje się oddzielnie. Suma stopni utlenienia węgla i połączonych z nim podstawników wynosi 0.
- W cząsteczkach estrów, gdy atom tlenu występuje jako element łańcucha węglowego, jego stopień utlenienia dzieli się równomiernie na dwa sąsiadujące atomy węgla.
Przykład:
Ustalanie stopni utlenienia poszczególnych pierwiastków w związku chemicznym KMnO4
K – leży w pierwszej grupie układu okresowego (należy do litowców), ma jeden elektron zdolny do tworzenia wiązań, jest metalem, zatem jego stopień utlenienia wynosi +I
O – tlen w związkach prawie zawsze przyjmuje stopień utlenienia -II
Mn – Ile będzie wynosił stopień utlenienia Mn? Stopień utlenienia całej cząsteczki musi być równy 0. Jeden atom K daje wartość +I, 4 atomy O o stopniu utlenienia -II dają wartość -VIII (4 x -2 = -8). Dodajemy obie wartości do siebie, otrzymujemy -VII. Zatem stopień utlenienia Mn musi być równy VII.