Zmydlanie tłuszczów
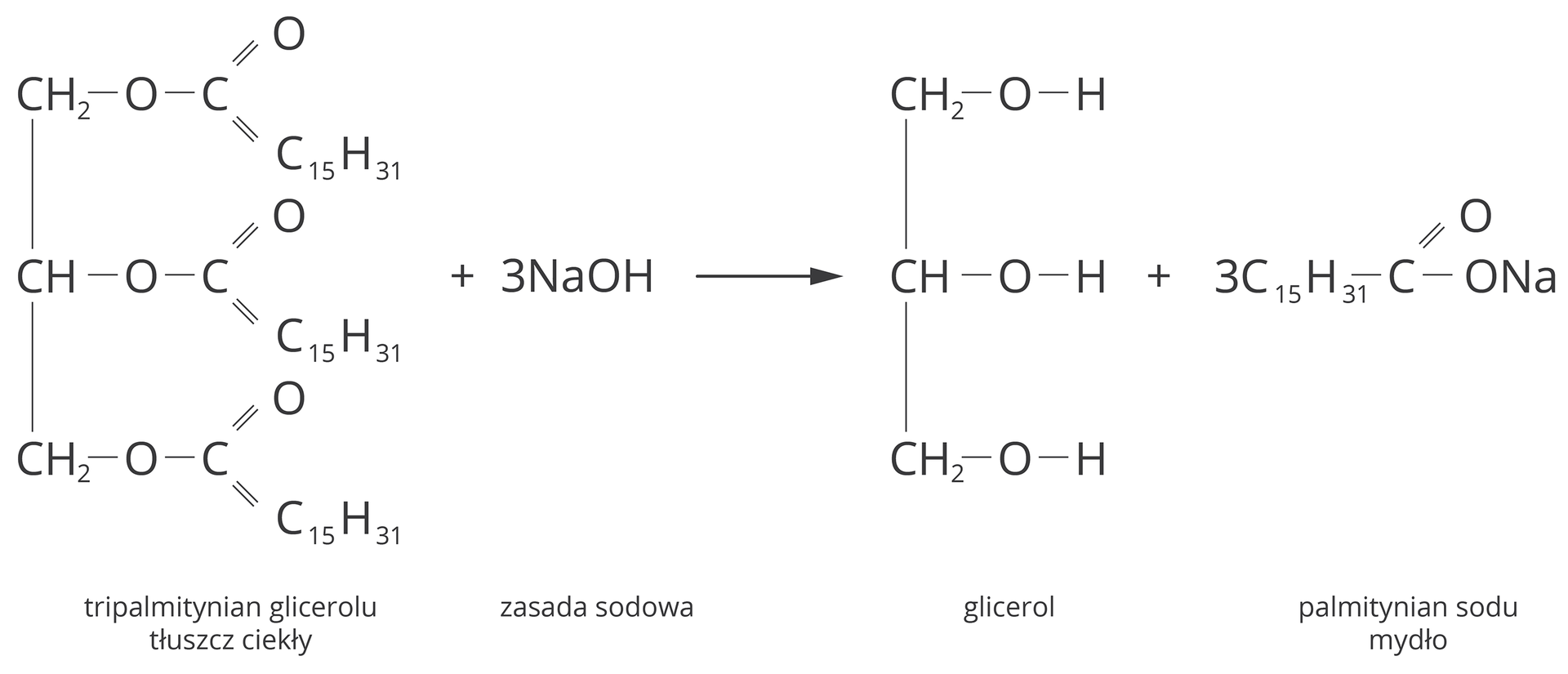
Reakcje tłuszczów (estrów glicerolu i wyższych kwasów karboksylowych) z zasadami (najczęściej sodową i potasową, ale też magnezową) nazywane są zmydlaniem, ponieważ prowadzą do otrzymania mydeł podczas ogrzewania mieszaniny. Zmydlanie nazywane jest także saponifikacją. Posługując się językiem fachowym, zmydlanie to alkaliczna (zasadowa) hydroliza estrów prowadząca do powstania soli kwasów karboksylowych i alkoholi wielowodorotlenowych.
Tłuszcze, które stanowią źródło wyższych kwasów karboksylowych do produkcji mydeł, nie mają jednorodnego składu, a triglicerydy, tworzące je, budowane są przez różnorodne wyższe kwasy karboksylowe. Jednak najbardziej popularne w przemysłowym zmydlaniu są:
- kwas palmitynowy C15H31COOH,
- kwas stearynowy C17H35COOH,
- kwas oleinowy C17H33
Obecnie do produkcji mydeł jako źródło kwasów tłuszczowych używa się głównie oleju palmowego, z nasion bawełny i kokosowego. Duże znaczenie ma także oliwa z oliwek.
Reakcja zmydlania przebiega następująco:
tłuszcz + silna zasada → mydło + glicerol
(ester glicerolu i zasada sodowa/potasowa) → (sól sodowa/potasowa kwasu karboksylowego i wyższych kwasów karboksylowych)
Mydła to sole wyższych kwasów karboksylowych, które rozpuszczają się w wodzie i pienią, dzięki czemu znalazły zastosowanie w usuwaniu brudu i praniu.
- Mydła sodowe – twarde, białe, bardzo dobrze rozpuszczalne w wodzie, z dodatkiem substancji zapachowych i barwników sprzedawane są jako mydła kostkowe.
- Mydła potasowe – miękkie, tzw. szare mydło, bardzo dobrze rozpuszczalne w wodzie, mniej popularne w sprzedaży niż mydła sodowe w kostkach, używane też do produkcji mydeł w płynie.
- Mydła magnezowe – ciekłe, trudno rozpuszczalne w wodzie, wykorzystuje się je w produkcji mydeł w płynie, płynów do kąpieli i szamponów.
Mydła produkuje się w procesie zmydlania tłuszczów roślinnych i zwierzęcych w obecności silnej zasady i podczas długiego gotowania. Aby uzyskać pożądaną żelową konsystencję mydła do mieszaniny reakcyjnej dodaje się NaCl. Następnie z mieszaniny poreakcyjnej usuwane są składniki niepożądane i nieprzereagowane, dodawane substancje zapachowe i barwniki.
W roztworze wodnym mydła ulegają dysocjacji elektrolitycznej według schematu:
mydło ↔ anion kwasu karboksylowego + kation metalu
C17H35COOK ↔ C17H35COO– + K+
Mydła ulegają hydrolizie anionowej jako sole słabych kwasów i mocnych zasad. Ich roztwory wodne mają odczyn zasadowy. Analizując zapis jonowy reakcji, można to potwierdzić poprzez występowanie zasadowych jonów OH–.
Zapis cząsteczkowy: C17H35COOK + H2O ↔ C17H35COOH + KOH
Zapis jonowy: C17H35COO– + K+ + H2O ↔ C17H35COOH + K+ + OH–
Zapis jonowy skrócony: C17H35COO– + H2O ↔ C17H35COOH + OH–
Budowa mydła i proces prania
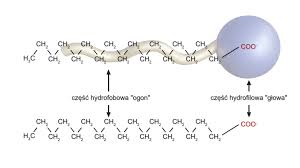
Mydła mają bardzo charakterystyczną budowę, która odpowiada za ich zdolności usuwania brudu. Cząsteczki brudu mają najczęściej charakter tłuszczowy – nie rozpuszczają się w wodzie.
Cząsteczki mydła zbudowane są z długiego łańcucha węglowego (R), który jest hydrofobowy („nie lubi wody, odpycha wodę”) oraz głowy -COO–, która jest hydrofilowa („lubi wodę”). Podczas procesu prania, czyli usuwania brudu hydrofobowy ogon wnika w cząsteczki brudu, a hydrofilowa głowa pozostaje na jego powierzchni, co pozwala na zwilżanie przez wodę i usuwanie brudu z powierzchni tkanin i innych materiałów. Mydła zmniejszają napięcie powierzchniowe wody, przez co łatwo wnika ona w pory tkanin i skóry. Ułatwia to usuwanie brudu.
Ze względu na to, że mydła obniżają napięcie powierzchniowe wody, zalicza się je do grupy surfaktantów – substancji powierzchniowo czynnych.
Mydła w twardej wodzie
Woda twarda to taka, która zawiera dużo jonów wapnia, magnezu… Mydła reagują z jonami metali w wodzie, tworząc trudnorozpuszczalne sole, wytrącające się w postaci osadu i znacznie utrudniające usuwanie brudu.
2 C17H35COO– + Ca2+ → (C17H35COO)2Ca↓