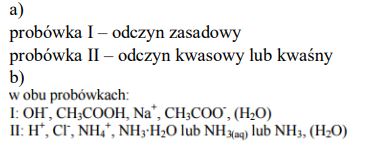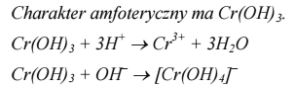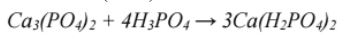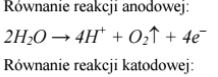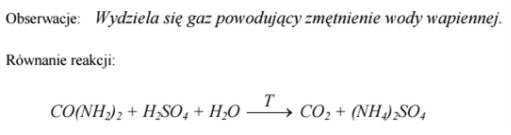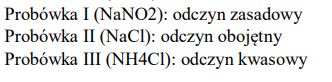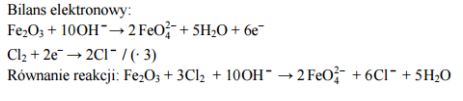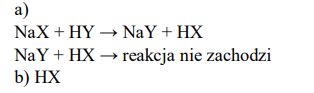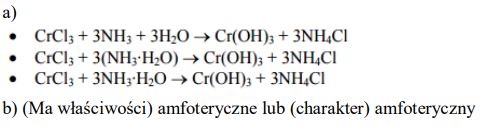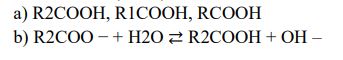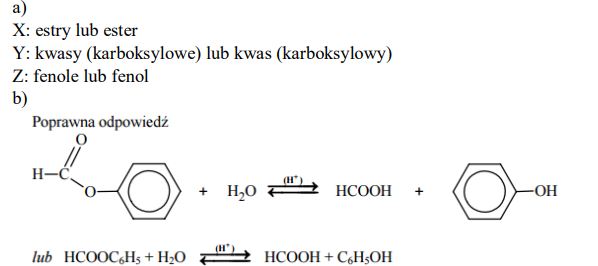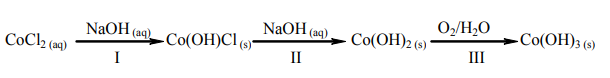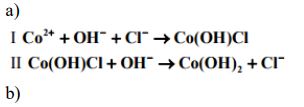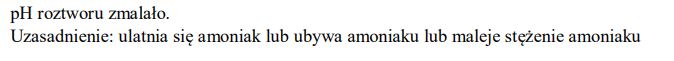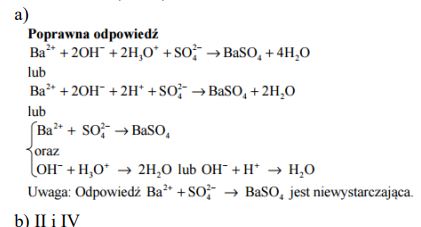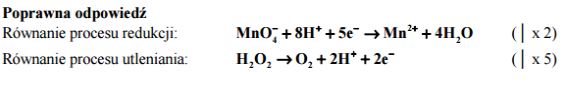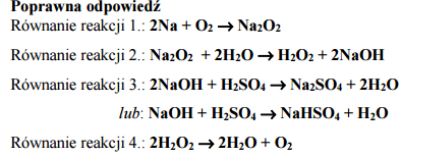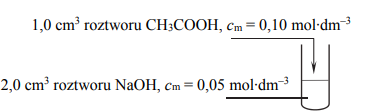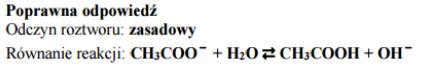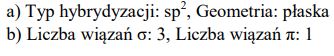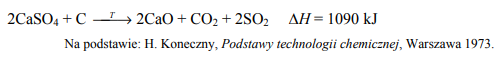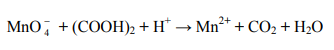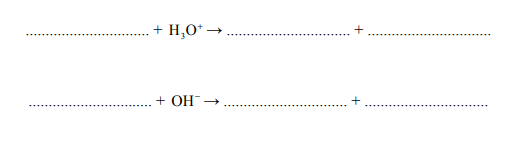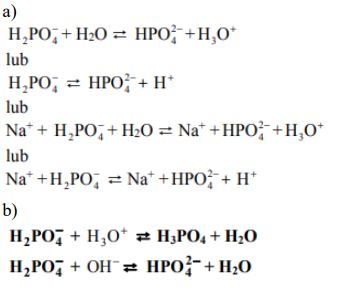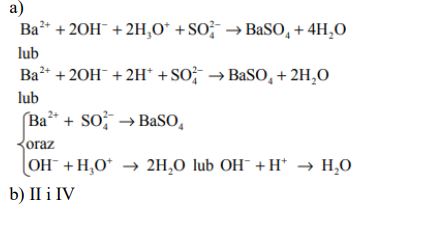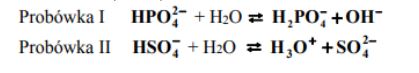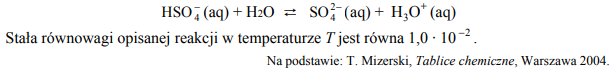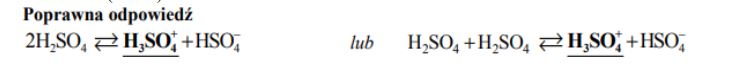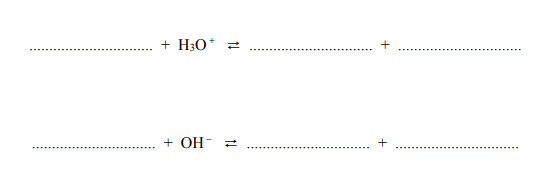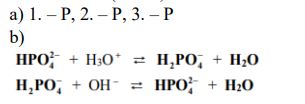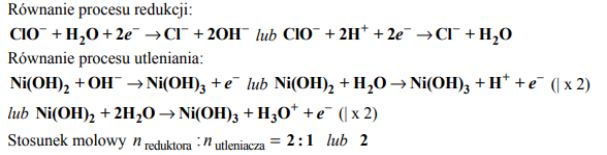Zadania maturalne z Chemii
Tematyka: tlenki, wodorotlenki, kwasy, sole; charakterystyczne reakcje, właściwości i otrzymywanie.
Zadania pochodzą z oficjalnych arkuszy maturalnych CKE, które służyły przeprowadzaniu majowych egzaminów. Czteroznakowy kod zapisany przy każdym zadaniu wskazuje na jego pochodzenie: S/N – „stara”/”nowa” formuła; P/R – poziom podstawowy/rozszerzony; np. 08 – rok 2008.
Zbiór zadań maturalnych w formie arkuszy, możesz pobrać >> TUTAJ <<.
Zadanie 111. (SR05)
Oceń, jak wpływa na ilość amoniaku powstającego w wyniku reakcji syntezy:
a) obniżenie ciśnienia,
b) podwyższenie temperatury,
c) wprowadzenie dodatkowej ilości azotu
Zadanie 112. (SR05)
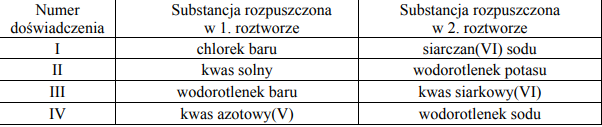
Na VI stopniu utlenienia chrom tworzy sole: chromiany (VI) i dichromiany (VI). Przeprowadzono doświadczenie, które zilustrowano za pomocą następujących jonowych równań reakcji:
Opisz, w jaki sposób wykonano ten eksperyment. W tym celu: a) określ potrzebne odczynniki, b) opisz doświadczenie słownie lub za pomocą schematycznego rysunku, c) napisz przewidywane spostrzeżenia, d) sformułuj wniosek dotyczący trwałości chromianów(VI) oraz wniosek dotyczący trwałości dichromianów (VI) w zależności od środowiska (odczynu roztworu).
Zadanie 113. (SR05)
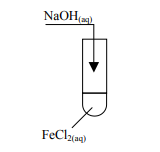
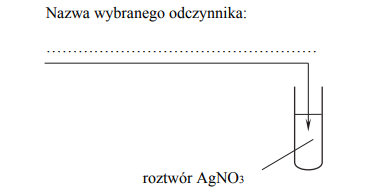
Przeprowadzono doświadczenie zgodnie z poniższym schematem:
Opisz przewidywane obserwacje (dokonane zaraz po dolaniu roztworu wodorotlenku i po pewnym czasie) oraz napisz równania zachodzących reakcji chemicznych.
Zadanie 114. (SR05)
W dwóch probówkach znajdują się wodne roztwory soli: I. octanu sodu II. chlorku amonu. Określ, jakie odczyny mają te roztwory. Uzasadnij swoją odpowiedź podając, jakie cząsteczki i jony znajdują się w roztworach po hydrolizie.
Zadanie 115. (SR06)
Poniżej przedstawiono wzory sumaryczne dwóch nierozpuszczalnych w wodzie wodorotlenków chromu.
Cr(OH)2 Cr(OH)3
Spośród podanych wzorów wybierz wzór tego wodorotlenku, który ma charakter amfoteryczny. Napisz w formie jonowej skróconej dwa równania reakcji, które dowodzą właściwości amfoterycznych wybranego wodorotlenku.
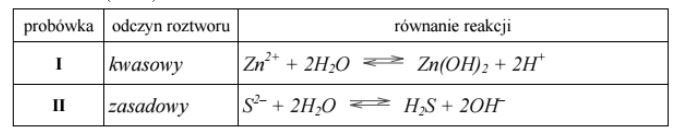
Zadanie 116. (SR06)
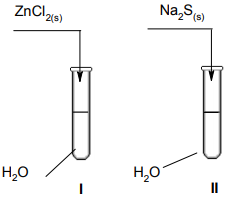
Przeprowadzono doświadczenia, które ilustruje poniższy rysunek.
Podaj odczyn roztworów otrzymanych w obu probówkach. Odpowiedź uzasadnij, pisząc w formie jonowej skróconej równania zachodzących reakcji.
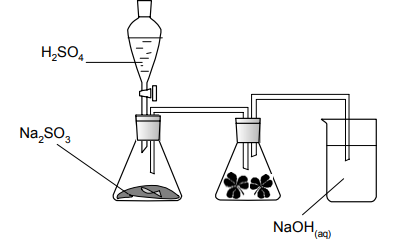
Zadanie 117. (SR06)
Na poniższym rysunku przedstawiono zestaw do otrzymywania tlenku siarki(IV) i badania jego wpływu na rośliny:
Napisz w formie cząsteczkowej równanie reakcji zachodzącej podczas otrzymywania tlenku siarki(IV) przedstawioną wyżej metodą.
Zadanie 118. (SR06)
W produkcji nawozu fosforowego z trudno rozpuszczalnego w wodzie ortofosforanu(V) wapnia otrzymuje się rozpuszczalny diwodoroortofosforan(V) wapnia. Napisz w formie cząsteczkowej równanie tej reakcji.
Zadanie 119. (SR06)
Wodny roztwór siarczanu(VI) sodu poddano elektrolizie z użyciem elektrod grafitowych. Napisz równania reakcji, które przebiegały na elektrodach w czasie opisanego procesu.
Zadanie 120. (SR07)
Tlenek cynku nie reaguje z wodą, ale reaguje z kwasami i z zasadami. W reakcji tlenku cynku z roztworem wodorotlenku sodu powstaje związek kompleksowy, w którym cynk ma liczbę koordynacyjną równą 4. Korzystając z powyższej informacji, określ charakter chemiczny tego tlenku. Napisz w formie cząsteczkowej równania reakcji tlenku cynku z kwasem solnym oraz z wodorotlenkiem sodu.
Zadanie 121. (SR07)
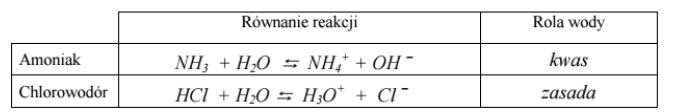
Korzystając z teorii Brönsteda, napisz równania reakcji ilustrujące zachowanie amoniaku i chlorowodoru w wodzie. Określ rolę wody w każdym z tych procesów.
Zadanie 122. (SR07)
Zaproponuj dwuetapową metodę otrzymywania tlenku miedzi(II) z roztworu chlorku miedzi(II), pisząc schemat procesu. W schemacie uwzględnij reagenty i warunki przeprowadzenia reakcji.
Zadanie 123. (SR07)
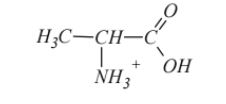
Alanina to kwas 2-aminopropanowy. Napisz wzór półstrukturalny (grupowy) jonu, jaki tworzy alanina w środowisku silnie kwasowym.
Zadanie 124. (SR07)
W celu potwierdzenia faktu, że mocznik CO(NH2)2 jest pochodną kwasu węglowego, przeprowadzono doświadczenie zilustrowane poniższym rysunkiem. Podaj obserwacje, które potwierdzają, że mocznik jest pochodną kwasu węglowego. Napisz równanie reakcji, której ulega mocznik podczas tego doświadczenia.
Zadanie 125. (SR08)
Skały wapienne, których głównym składnikiem jest CaCO3, ulegają erozji pod działaniem wody zawierającej rozpuszczony tlenek węgla(IV). W wyniku tego procesu woda staje się twarda. Napisz w formie jonowej równanie reakcji głównego składnika skał wapiennych z wodą zawierającą tlenek węgla(IV).
Zadanie 126. (SR08)
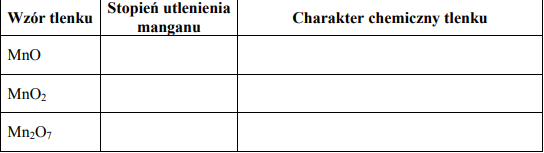
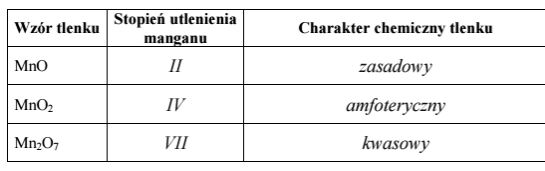
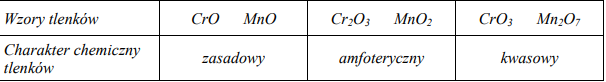
Uzupełnij poniższą tabelę, określając stopień utlenienia manganu w tlenkach, których wzory podano w tabeli, oraz charakter chemiczny tych tlenków.
Zadanie 127. (SR08)
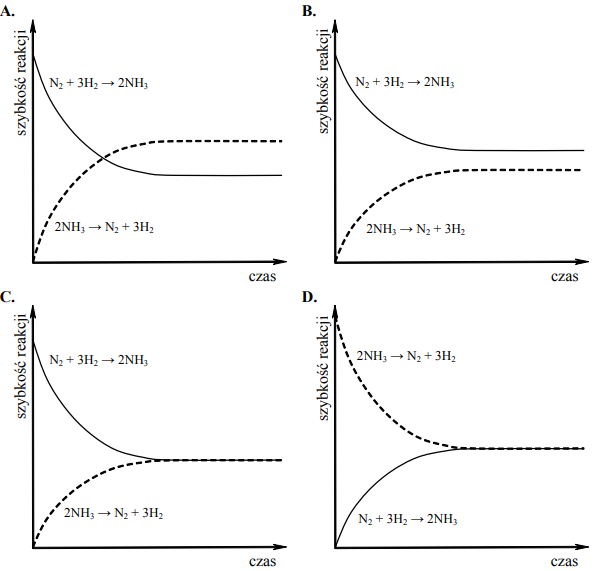
W zamkniętym reaktorze zmieszano znane ilości azotu i wodoru. Utrzymując wysoką, stałą temperaturę, mierzono zmiany stężeń azotu, wodoru i amoniaku aż do osiągnięcia przez układ stanu równowagi i pewien czas po tym momencie. Na podstawie wyników tych pomiarów wykonano wykres zależności szybkości reakcji od czasu. Z poniższych wykresów wybierz ten, który ilustruje zmiany szybkości reakcji tworzenia amoniaku i szybkości reakcji rozkładu amoniaku w czasie opisanego eksperymentu (zaznacz wykres A, B, C lub D).
Linia ciągła – oznacza szybkość rozkładu amoniaku na azot i wodór
Linia przerywana – oznacza szybkość reakcji tworzenia amoniaku
Zadanie 128. (SR08)
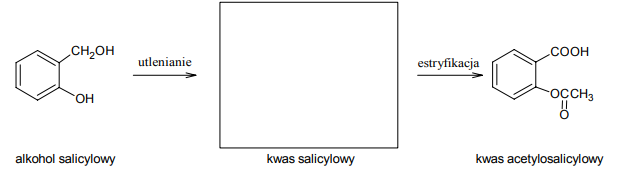
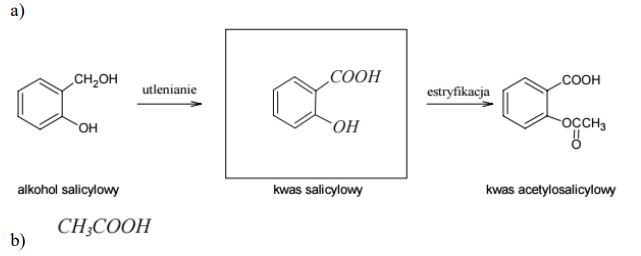
Kwas salicylowy, otrzymany przez utlenienie alkoholu salicylowego, jest bardzo skutecznym środkiem przeciwbólowym, przeciwzapalnym i przeciwgorączkowym. Niestety, związek ten okazał się zbyt niebezpieczny dla ścianek żołądka. Przekształcenie grupy fenolowej w grupę estrową pozwoliło otrzymać kwas acetylosalicylowy, który wykazuje skuteczność podobną do skuteczności kwasu salicylowego, ale jest mniej szkodliwy dla żołądka. Poniżej przedstawiono schemat przemian pozwalających na otrzymanie kwasu acetylosalicylowego z alkoholu salicylowego.Na podstawie: John McMurry „Chemia organiczna”, Warszawa 2000
Uzupełnij poniższy schemat, wpisując w nim wzór kwasu salicylowego.
Napisz wzór półstrukturalny (grupowy) związku, którego reakcja z kwasem salicylowym prowadzi do powstania kwasu acetylosalicylowego.
Zadanie 129. (SR09)
Poniżej przedstawiono wzory pięciu tlenków:
Na2O P4O10 ZnO CO SO3
Wpisz w odpowiednie miejsca tabeli wzory wszystkich tlenków reagujących z substancjami, których nazwy podano w tytule każdej kolumny. Uwaga: jeżeli dany tlenek reaguje z więcej niż jedną substancją, należy to uwzględnić.
Zadanie 130. (SR09)
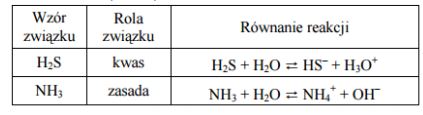
Określ, jaką rolę (kwasu czy zasady) pełnią według teorii Brönsteda siarkowodór i amoniak w roztworach wodnych. Uzasadnij swoją odpowiedź, zapisując w formie jonowej równania reakcji tych gazów z wodą.
Zadanie 131. (SR09)
Przedstaw projekt doświadczenia, które wykaże amfoteryczny charakter wodorotlenku chromu(III). W tym celu: a) uzupełnij poniższy opis doświadczenia, wpisując wzory lub nazwy potrzebnych odczynników, wybranych spośród następujących: kwas solny, chlorek sodu(aq), wodorotlenek sodu(aq) b) wymień obserwacje, które umożliwią wykazanie amfoterycznego charakteru wodorotlenku chromu(III) c) zapisz w formie jonowej skróconej równania zachodzących reakcji, wiedząc, że produktem jednej z reakcji jest jon heksahydroksochromianowy(III).
Zadanie 132. (SR09)
Tlenki niektórych pierwiastków bloku d wykazują różny charakter chemiczny w zależności od stopnia utlenienia pierwiastka. W poniższej tabeli przedstawiono charakter chemiczny wybranych tlenków chromu i manganu. Określ zależność pomiędzy wartościami stopni utlenienia chromu i manganu w tlenkach a charakterem chemicznym tlenków tych pierwiastków.
Zadanie 133. (SR09)
Oceń, jak zmieni się (wzrośnie czy zmaleje) wydajność reakcji tworzenia SO2 zilustrowanej równaniem:
Jeżeli w układzie będącym w stanie równowagi
a) podwyższymy temperaturę
b) usuniemy część wody
Zadanie 134. (SR09)
W dwóch nieoznakowanych probówkach znajdował się stężony i rozcieńczony roztwór kwasu azotowego(V). W celu zidentyfikowania tych roztworów przeprowadzono doświadczenie zilustrowane poniższym rysunkiem.
Uzupełnij poniższe zdania, wybierając brakujące określenia spośród podanych:
Rozcieńczony stężony NO NO2
Roztwór A to ……………………………………. kwas azotowy(V), a roztwór B to …………………………………………… kwas azotowy(V). Czerwonobrunatnym gazem, który wydzielał się w probówce I, jest tlenek azotu o wzorze …………………………….. W probówce II powstał bezbarwny tlenek o wzorze ……………………………..
Zadanie 135. (SR09)
Przeprowadzono dwuetapowe doświadczenie, które opisano poniżej. Do roztworu chlorku żelaza(II) dodano roztwór wodorotlenku sodu (etap 1). Następnie do otrzymanej mieszaniny wprowadzono roztwór nadtlenku wodoru (etap 2). Opisz, co zaobserwowano podczas tego doświadczenia. Napisz równania reakcji, które zachodzą podczas tego doświadczenia. Równanie reakcji zachodzącej podczas etapu 1 zapisz w formie jonowej skróconej, a równanie reakcji etapu 2 w formie cząsteczkowej.
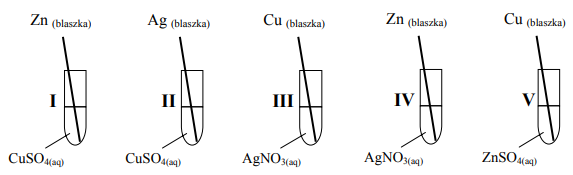
Zadanie 136. (SR09)
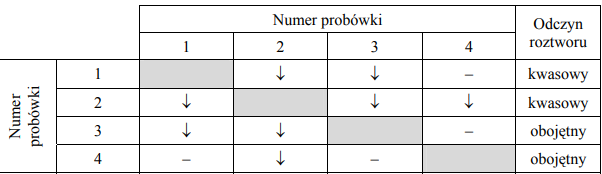
Zbadano zachowanie cynku, miedzi i srebra w roztworach soli.
Podaj numery probówek, w których zaobserwowano objawy reakcji.
Zadanie 137. (SR09)
Przeprowadzono doświadczenie zilustrowane poniższym rysunkiem. Określ odczyn wodnych roztworów soli w probówkach I, II i III.
Zadanie 138. (SR09)
Określ, jaką rolę (utleniacza czy reduktora) spełnia nadtlenek wodoru w reakcjach opisanych równaniami:
Zadanie 139. (SR09)
Tlenek żelaza(III) reaguje w obecności mocnych zasad z silnymi utleniaczami, np. z chlorem, według następującego schematu:
Dobierz i uzupełnij współczynniki stechiometryczne w podanym wyżej schemacie reakcji. Zastosuj metodę bilansu elektronowego.
Zadanie 140. (SR09)
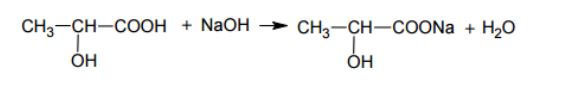
Zapisz, stosując wzory półstrukturalne (grupowe) związków organicznych, równanie reakcji kwasu 2-hydroksypropanowego (mlekowego) z wodnym roztworem wodorotlenku sodu.
Zadanie 141. (SR10)
Chlor tworzy tlenki, w których przyjmuje różne stopnie utlenienia. Tlenek, w którym chlor występuje na najwyższym stopniu utlenienia, otrzymuje się w reakcji odwodnienia (dehydratacji) kwasu chlorowego zawierającego chlor na tym samym stopniu utlenienia. Napisz równanie reakcji otrzymywania tego tlenku powyższą metodą.
Zadanie 142. (SR10)
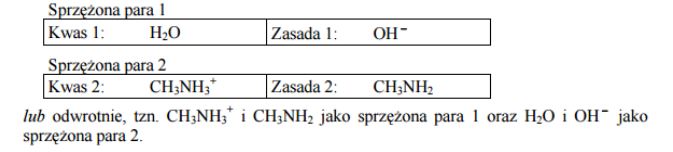
W teorii Brönsteda sprzężoną parą kwas-zasada nazywa się układ złożony z kwasu oraz zasady, która powstaje z tego kwasu przez odłączenie protonu. Dla przemiany przedstawionej równaniem:
Napisz wzory kwasów i zasad, które w tej reakcji tworzą sprzężone pary.
Zadanie 143. (SR10)
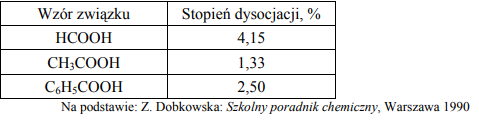
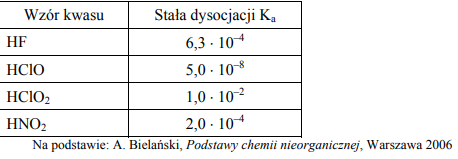
W poniższej tabeli podano wartości stopnia dysocjacji trzech kwasów karboksylowych w ich wodnych roztworach o stężeniu 0,1 mol/dm3 w temperaturze 25 ºC. Na podstawie podanych wartości stopnia dysocjacji uszereguj podane kwasy od najsłabszego do najmocniejszego.
Zadanie 144. (SR10)
Przygotowano wodne roztwory kwasów HX i HY oraz ich soli NaX i NaY, wszystkie o stężeniach 1 mol/dm3 . Stałe dysocjacji kwasowej HX i HY w temperaturze 25 ºC są odpowiednio równe:
a) Posługując się zapisem w formie cząsteczkowej, dopisz do podanych substratów produkty reakcji lub napisz, że przemiana nie zachodzi.
NaX + HY → ……………………………………………………………………………………………………………….
NaY + HX → ……………………………………………………………………………………………………………….
b) Wskaż kwas (HX lub HY), którego roztwór o stężeniu 1 mol/dm3 ma wyższe pH.
Zadanie 145. (SR10)
Do dwóch probówek wprowadzono po 5 cm3 wodnego roztworu chlorku chromu(III). Do każdej z nich dodano po 5 cm3 rozcieńczonej wody amoniakalnej i zaobserwowano wytrącenie się osadu o barwie szarozielonej. Następnie do pierwszej probówki dodano kilka cm3 stężonego roztworu wodorotlenku sodu, a do drugiej taką samą objętość kwasu solnego. Zaobserwowano, że szarozielony osad rozpuścił się w obu probówkach.
a) Napisz w formie cząsteczkowej równanie reakcji chlorku chromu(III) z wodą amoniakalną
b) Na podstawie opisanych wyników doświadczenia określ charakter chemiczny związku tworzącego osad o szarozielonej barwie.
Zadanie 146. (SR10)
Badano działanie świeżo strąconego wodorotlenku miedzi(II) na próbki wodnych roztworów glukozy i fruktozy. Używając uniwersalnego papierka wskaźnikowego, zbadano także odczyn wodnych roztworów obu związków. Obserwacje zestawiono w tabeli.
Korzystając z podanej informacji, uzupełnij poniższe zdania, wpisując w odpowiedniej formie gramatycznej określenia wybrane z poniższego zestawu.
związek kompleksowy, kwasowy, zasadowy, obojętny, utleniający, redukujący, hydroksylowa, alkilowa, aldehydowa, ketonowa, aldoza, ketoza
Glukoza i fruktoza są białymi, krystalicznymi substancjami stałymi. Bardzo dobrze rozpuszczają się w wodzie. Odczyn ich wodnych roztworów jest …………………………………….. . 2. Reakcja glukozy z wodorotlenkiem miedzi(II) prowadzona na zimno potwierdza obecność w jej cząsteczce kilku grup ………………………………………………………… związanych z sąsiednimi atomami węgla. Glukoza w reakcji z wodorotlenkiem miedzi(II) przeprowadzanej na gorąco wykazuje właściwości …………………………………………………………………………., co wiąże się z obecnością w jej cząsteczce grupy ………………………………………………. . 3. Fruktoza, podobnie jak glukoza, tworzy z wodorotlenkiem miedzi(II) rozpuszczalne ………………………………………………………………………., dlatego obserwujemy powstanie szafirowego roztworu. Wynik reakcji fruktozy z wodorotlenkiem miedzi(II) prowadzonej w podwyższonej temperaturze wskazuje, że związek ten ma także właściwości …………………………………………………………………………., mimo że fruktoza zaliczana jest do ……………
Zadanie 147. (SR11)
Zmierzono pH wodnych roztworów czterech soli o stężeniu 0,01 mol · dm−3 i wyniki zestawiono w poniższej tabeli.
Uszereguj kwasy RCOOH, R1COOH, R2COOH od najsłabszego do najmocniejszego.
Napisz w formie jonowej skróconej równanie reakcji hydrolizy soli o wzorze R2COONa.
Zadanie 148. (SR11)
W probówkach 1–4 znajdują się (w nieznanej kolejności) wodne roztwory następujących substancji: AgNO3, BaCl2, ZnSO4, NaCl. W celu zidentyfikowania zawartości probówek zbadano odczyn wodnego roztworu każdej soli oraz zmieszano kolejno ze sobą roztwory z poszczególnych probówek. Wyniki przeprowadzonych doświadczeń zapisano w poniższej tabeli.
Korzystając z powyższej informacji, napisz wzory substancji znajdujących się w probówkach 1–4. Napisz w formie jonowej skróconej równania reakcji, które umożliwiły identyfikację substancji znajdującej się w probówce 3.
Zadanie 149. (SR11)
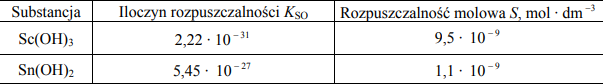
Rozpuszczalność substancji trudno rozpuszczalnej charakteryzują dwie wielkości:
- iloczyn rozpuszczalności (KSO), który opisuje stan równowagi między osadem trudno rozpuszczalnej substancji a stężeniem jej jonów w roztworze
- rozpuszczalność molowa (S), która wyrażona jest stężeniem molowym substancji w jej roztworze nasyconym
Wartości liczbowe podane są dla temperatury 25 o C.
Na podstawie: J. Sawicka, A. Janich-Kilian, W. Cejner-Mania, G. Urbańczyk, Tablice chemiczne, Gdańsk 2002
Korzystając z powyższej informacji, napisz wzór wodorotlenku, który jest lepiej rozpuszczalny w wodzie, oraz napisz, czy dokonując tego wyboru, należało porównać wartości rozpuszczalności molowych, czy też wartości iloczynów rozpuszczalności substancji.
Zadanie 150. (SR11)
Związek organiczny X o wzorze sumarycznym C7H6O2 ulega reakcji hydrolizy. Produktami tej reakcji w środowisku kwasowym są związki Y i Z. Substancja Y, jako jedyny przedstawiciel swojego szeregu homologicznego, ma właściwości redukujące. Związek Z w reakcji z chlorkiem żelaza(III) daje związek kompleksowy o fioletowej barwie.
Podaj nazwy grup związków, do których należą substancje organiczne X, Y i Z. X Napisz, stosując wzory półstrukturalne (grupowe) związków organicznych, równanie reakcji hydrolizy kwasowej związku organicznego X.
Zadanie 151. (SR12)
Związek między mocą kwasu Brönsteda i sprzężonej z tym kwasem zasady w roztworach wodnych przedstawia zależność:
Ka × Kb = Kw
gdzie Ka oznacza stałą dysocjacji kwasu, Kb stałą dysocjacji sprzężonej zasady, a Kw iloczyn jonowy wody, którego wartość wynosi 1,0 × 10–14 w temperaturze 298 K. W poniższej tabeli podano wartości stałej dysocjacji wybranych kwasów w temperaturze 298 K.
Na podstawie powyższej informacji napisz wzory zasad sprzężonych z kwasami wymienionymi w tabeli uporządkowane od najsłabszej do najmocniejszej.
Zadanie 152. (SR12)
W reakcji wodnego roztworu chlorku kobaltu(II) z wodnym roztworem wodorotlenku sodu najpierw powstaje niebieski osad hydroksosoli: chlorku wodorotlenku kobaltu(II) o wzorze Co(OH)Cl. Związek ten pod wpływem kolejnych porcji roztworu wodorotlenku sodu przechodzi w różowy osad wodorotlenku kobaltu(II), który praktycznie nie rozpuszcza się w nadmiarze tego odczynnika, ale brunatnieje wskutek utleniania obecnym w powietrzu tlenem. Opisane przemiany ilustruje poniższy schemat.
Napisz w formie jonowej skróconej równania reakcji oznaczonych numerami I i II. Napisz w formie cząsteczkowej równanie reakcji oznaczonej numerem III. Określ charakter chemiczny (kwasowo-zasadowy) wodorotlenku kobaltu(II).
Zadanie 153. (SR12)
Bufory pH to roztwory zawierające sprzężoną parę kwas–zasada Brönsteda w podobnych stężeniach. Roztwory te mają zdolność do utrzymywania stałej wartości pH po dodaniu do nich niewielkich ilości mocnych kwasów lub zasad. Działanie buforu pH polega na tym, że po dodaniu mocnego kwasu zasada Brönsteda reaguje z jonami H3O+ , a po dodaniu mocnej zasady kwas Brönsteda reaguje z jonami OH– . Przykładem roztworu buforowego jest bufor amonowy, który otrzymuje się przez rozpuszczenie w wodzie amoniaku NH3 i chlorku amonu NH4Cl. Sprzężoną parę kwas–zasada stanowią obecne w nim kationy amonowe i cząsteczki amoniaku.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, t. 1, Warszawa 2005
Napisz w formie jonowej skróconej równania reakcji, które zachodzą w buforze amonowym po dodaniu mocnego kwasu (reakcja I) i mocnej zasady (reakcja II).
W buforze amonowym reakcja cząsteczek amoniaku z cząsteczkami wody zachodzi w stopniu, który można pominąć. Przyczyną cofnięcia tej reakcji jest obecność kationów amonowych wprowadzonych do roztworu przez rozpuszczenie chlorku amonu, który jest całkowicie zdysocjowany. Oceń prawdziwość poniższych zdań. Wpisz do tabeli literę P, jeżeli zdanie jest prawdziwe, lub literę F, jeśli jest fałszywe.
O pH roztworu buforowego decyduje rodzaj zawartej w nim sprzężonej pary kwas–zasada oraz stosunek stężenia kwasu i sprzężonej z nim zasady. Oceń, jak wpłynie na pH buforu amonowego rozcieńczenie go wodą destylowaną. Uzupełnij poniższe zdanie, wpisując określenie wzrośnie, zmaleje lub nie zmieni się.
Zadanie 154. (SR12)
Do wodnego roztworu chromianu(VI) potasu dodano kilka kropli rozcieńczonego kwasu siarkowego(VI) i stwierdzono, że roztwór zmienił barwę z żółtej na pomarańczową. Świadczyło to o powstaniu anionów dichromianowych(VI) (reakcja I). Następnie do otrzymanego roztworu wprowadzono kilka kropli roztworu wodorotlenku potasu i roztwór z powrotem stał się żółty (reakcja II). a) Napisz w formie jonowej skróconej równania reakcji I i II.
Spośród poniższych zdań wybierz wszystkie, które są wnioskami wynikającymi z opisanego doświadczenia. I Chromiany(VI) są silnymi utleniaczami, a ich właściwości utleniające zależą od pH środowiska reakcji. II Przemiana anionów chromianowych(VI) w aniony dichromianowe(VI) jest reakcją odwracalną. III W środowisku zasadowym trwałe są aniony chromianowe(VI), a w środowisku kwasowym – aniony dichromianowe(VI). IV W środowisku zasadowym trwałe są aniony dichromianowe(VI), a w środowisku kwasowym – aniony chromianowe(VI).
Zadanie 155. (SR12)
Odczynnik Tollensa, potocznie nazywany amoniakalnym roztworem tlenku srebra, otrzymuje się przez dodanie wody amoniakalnej do wodnego roztworu AgNO3. Potoczna nazwa odczynnika nie jest poprawna, ponieważ jon O2– nie występuje w roztworach wodnych. Początkowo wytrąca się czarnobrunatny osad tlenku srebra(I). W miarę dodawania kolejnych porcji wody amoniakalnej osad ten ulega roztworzeniu, ponieważ jony srebra(I) tworzą z cząsteczkami amoniaku jony kompleksowe o wzorze Ag(NH3)2+ . W wyniku tej reakcji powstaje bezbarwny roztwór, który jest odczynnikiem Tollensa.
Uzupełnij poniższe zapisy, tak aby otrzymać równania (w formie jonowej) opisanych reakcji. Wpisz wzory produktów oraz brakujące współczynniki stechiometryczne.
Równanie reakcji powstawania tlenku srebra(I): ……. Ag+ + ……. OH– → ………………………
Równanie reakcji tlenku srebra(I) z amoniakiem: ……. Ag2O + ..….. NH3 + ..….. H2O → …………….. Określ odczyn roztworu będącego odczynnikiem Tollensa.
Zadanie 156. (SR13)
Dane są wzory:
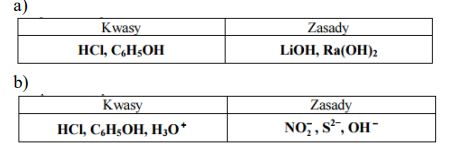
Spośród wymienionych powyżej wzorów wybierz i wpisz do tabeli
a) wzory wszystkich kwasów i wzory wszystkich zasad w teorii Arrheniusa.
b) wzory wszystkich drobin, które w roztworach wodnych mogą pełnić rolę kwasów, i wzory wszystkich drobin, które w roztworach wodnych mogą pełnić rolę zasad w teorii Brönsteda
Zadanie 157. (SR13)
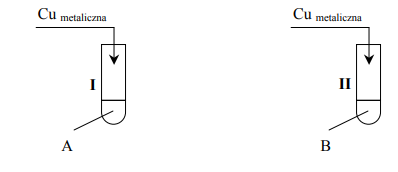
Przeprowadzono doświadczenie, w którym zmieszano wodny roztwór siarczanu(VI) miedzi(II) z wodnym roztworem wodorotlenku potasu. Zaobserwowano wytrącenie osadu. Następnie do wytrąconego osadu dodano wodny roztwór pewnej substancji X. Po energicznym wstrząśnięciu zawartości probówki zaobserwowano pojawienie się roztworu o barwie szafirowej. Spośród wymienionych związków: etanol, propanal, propanon, fruktoza wybierz ten związek, którego użyto w doświadczeniu jako substancję X, i napisz jego nazwę.
Zadanie 158. (SR14)
Kwas ortoborowy H3BO3 jest bardzo słabym jednoprotonowym kwasem, który w roztworach wodnych działa nie jako donor protonów, lecz jako akceptor jonów wodorotlenkowych, reagując z wodą zgodnie z równaniem:
Stała równowagi tej reakcji jest równa 5,8 · 10–10 . W obecności środków odciągających wodĊ, np. stężonego H2SO4, kwas ortoborowy tworzy z alkoholami estry.
Zadanie 159. (SR14)
Nazwij typ wiązania (ze względu na sposób jego powstawania), jakie tworzy się między atomem boru w cząsteczce kwasu ortoborowego i anionem wodorotlenkowym.
Według teorii Arrheniusa kwasy to związki dysocjujące w roztworze wodnym na kationy wodoru i aniony reszty kwasowej. Brønsted zdefiniował kwasy jako donory protonów. Oznacza to, że kwasy to cząsteczki i jony oddające proton. Zgodnie z teorią Lewisa kwasem nazywamy atom, cząsteczkę lub jon będący akceptorem jednej lub kilku par elektronów. Wybierz teorię kwasów i zasad, zgodnie z którą H3BO3 – na podstawie reakcji z wodą opisanej powyżej – jest kwasem. Uzupełnij poniższe zdanie, podkreślając nazwisko autora tej teorii. Na podstawie opisanej reakcji z wodą można stwierdził, że H3BO3 jest kwasem według teorii kwasów i zasad (Arrheniusa / Brønsteda / Lewisa).
Napisz, posługując się wzorami pół strukturalnymi (grupowymi) związków organicznych, równanie reakcji kwasu ortoborowego z metanolem, w której stosunek molowy kwasu do alkoholu jest równy 1 : 3.
Zadanie 160. (SR14)
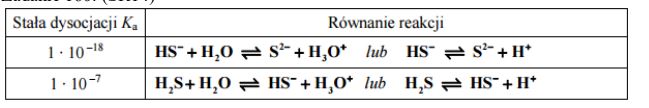
Napisz równania reakcji etapów dysocjacji kwasu siarkowodorowego, którym odpowiadają wartości stałej dysocjacji podane w tabeli.
Zadanie 161. (SR14)
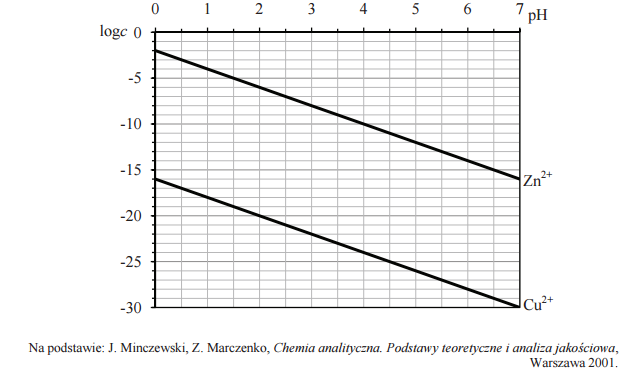
Siarczki są solami słabego kwasu siarkowodorowego, dlatego możliwość ich wytrącenia zależy nie tylko od iloczynu rozpuszczalności, lecz także od pH roztworu. W roztworach o niskim pH stężenie jonów siarczkowych jest bardzo małe, więc stężenie jonów metalu musi być odpowiednio duże, aby został przekroczony iloczyn rozpuszczalności. Dla roztworu o znanym pH można obliczyć najmniejsze stężenie molowe kationów danego metalu c, jakie musi istnieć w roztworze o tym pH, aby zaczął się wytrącać osad siarczku tego metalu. Na poniższym wykresie przedstawiono zależność logarytmu z najmniejszego stężenia c kationów Cu2+ i Zn2+ (logc), przy którym następuje strącanie siarczków miedzi(II) i cynku, od pH roztworu.
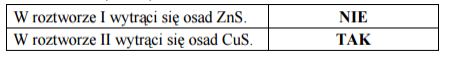
Przygotowano dwa roztwory wodne, których pH było równe 1. Roztwór I zawierał jony Zn2+ o stężeniu c równym 10–5 mol · dm–3, a roztwór II zawierał jony Cu2+ o stężeniu c równym 10–5 mol · dm–3. Czy w roztworze I wytrąci się osad ZnS, a w roztworze II osad CuS? Wpisz TAK albo NIE w odpowiednie rubryki tabeli.
Zadanie 162. (SR14)
Nadtlenek wodoru H2O2 jest gęstą, syropowatą cieczą, która miesza się z wodą w każdym stosunku. W roztworach wodnych ulega w niewielkim stopniu dysocjacji według równania:
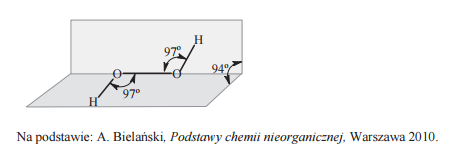
Przestrzenne rozmieszczenie atomów w cząsteczce nadtlenku wodoru ilustruje poniższy rysunek.
Korzystając z informacji na temat dysocjacji nadtlenku wodoru w wodzie, wypełnij tabelę, wpisując literę P, jeżeli zdanie jest prawdziwe, lub literę F, jeżeli jest fałszywe.
Korzystając z informacji na temat struktury cząsteczki nadtlenku wodoru, uzupełnij poniższe zdania. Wybierz i podkreśl jedno określenie spośród podanych w każdym nawiasie. 1. W cząsteczce nadtlenku wodoru atomy wodoru połączone są z atomami tlenu wiązaniami kowalencyjnymi (spolaryzowanymi / niespolaryzowanymi), a między atomami tlenu występuje wiązanie kowalencyjne (spolaryzowane / niespolaryzowane). 2. Cząsteczka nadtlenku wodoru jest (polarna / niepolarna). 3. Kształt cząsteczki nadtlenku wodoru można wyjaśnić, jeśli się założy hybrydyzację typu (sp3 / sp2 / sp) walencyjnych orbitali atomowych tlenu.
Zadanie 163. (SR14)
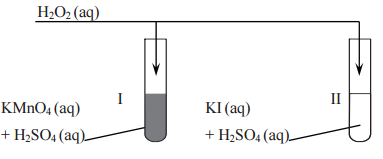
Do probówek zawierających zakwaszone roztwory wodne odpowiednio manganianu(VII) potasu (probówka I) i jodku potasu (probówka II) dodano roztwór wodny nadtlenku wodoru. Zaobserwowano zmiany barwy zawartości obu probówek i inne objawy świadczące o przebiegu reakcji chemicznych.
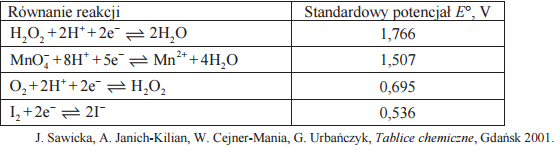
W tabeli podano wartości standardowych potencjałów wybranych układów redoks.
Opisz obserwowane zmiany barw, które świadczą o przebiegu reakcji w probówkach I i II (uwzględnij barwę zawartości obu probówek przed reakcją i po jej zajściu).
Podaj wzór chemiczny utleniacza i reduktora w reakcjach zachodzących w probówkach I i II.
Napisz w formie jonowej skróconej równania reakcji chemicznych, które przebiegły w probówkach I i II.
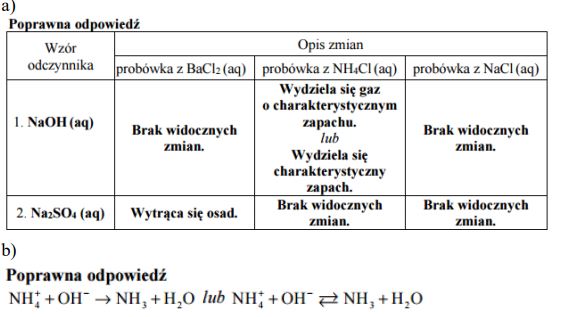
Zadanie 164. (SR16)
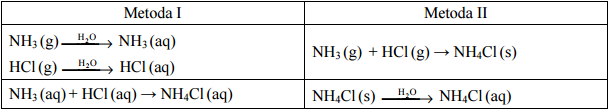
Wodny roztwór chlorku amonu można otrzymać dwiema metodami (I i II) podanymi poniżej. W obu metodach substancjami wyjściowymi są: gazowy HCl, gazowy NH3 oraz woda.
Do otrzymania wodnego roztworu chlorku amonu zastosowano metodę I i metodę II. W obu metodach wszystkie etapy prowadzono pod jednakowym ciśnieniem p. Każdą metodą otrzymano po 1 dm3 roztworu NH4Cl o stężeniu molowym cm i temperaturze T.
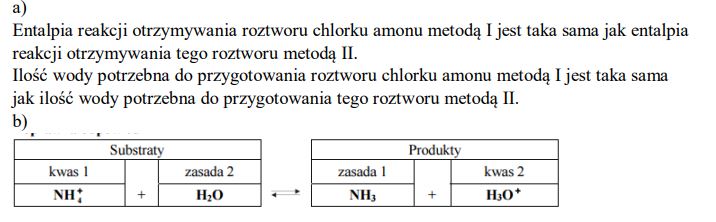
Uzupełnij poniższe zdania – wpisz określenie mniejsza niż, większa niż lub taka sama jak. Entalpia reakcji otrzymywania roztworu chlorku amonu metodą I jest ………………………………………. entalpia reakcji otrzymywania tego roztworu metodą II. Ilość wody potrzebna do przygotowania roztworu chlorku amonu metodą I jest ………………………………………. ilość wody potrzebna do przygotowania tego roztworu metodą II.
Stosując definicje kwasu i zasady Brønsteda, napisz równanie reakcji, która potwierdza kwasowy odczyn wodnego roztworu chlorku amonu.
Zadanie 165. (SR16)
Wodny roztwór amoniaku ogrzano, a następnie ochłodzono do początkowej temperatury. Objętość roztworu praktycznie się nie zmieniła, ale jego pH uległo zmianie. Oceń, jak zmieniło się (wzrosło czy zmalało) pH tego roztworu. Odpowiedź uzasadnij.
Zadanie 166. (SR16)
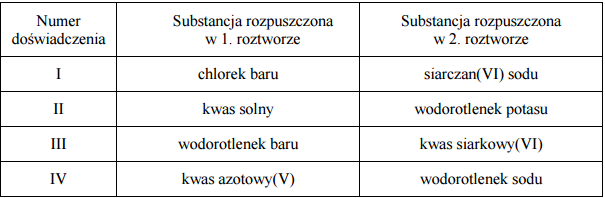
W celu zbadania efektu cieplnego reakcji chemicznych przeprowadzono cztery doświadczenia oznaczone numerami I–IV. Mieszano po 100 cm3 wodnych roztworów substancji, wymienionych w odpowiednich wierszach tabeli, o stężeniu molowym 0,2mol*dm-3 i o początkowej temperaturze równej 25 ºC. Następnie zmierzono temperaturę każdej z otrzymanych mieszanin.
Zaobserwowano, że w każdym doświadczeniu temperatura uzyskanych mieszanin była wyższa niż temperatura użytych roztworów i że przyrost temperatury ΔT w niektórych doświadczeniach był taki sam.
Napisz w formie jonowej równanie reakcji ilustrujące przemiany, które dokonały się podczas doświadczenia oznaczonego numerem III.
Napisz numery wszystkich doświadczeń, w których zaobserwowany wzrost temperatury ΔT był jednakowy.
Zadanie 167. (SR16)
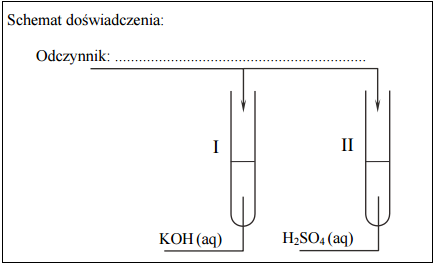
Zaprojektuj doświadczenie, które pozwoli na odróżnienie rozcieńczonych wodnych roztworów: roztworu KOH znajdującego się w probówce I od roztworu H2SO4 obecnego w probówce II.
Uzupełnij schemat doświadczenia – wpisz wzór odczynnika wybranego spośród następujących:
– K2CrO4 (aq)
– KNO3 (aq)
– KMnO4 (aq)
Napisz w formie jonowej skróconej równanie reakcji, która zaszła podczas przeprowadzonego eksperymentu.
Napisz, jakie obserwacje potwierdzą, że w probówce I znajdował się wodny roztwór wodorotlenku potasu, a w probówce II – wodny roztwór kwasu siarkowego(VI). Wypełnij poniższą tabelę.
Zadanie 168. (SR16)
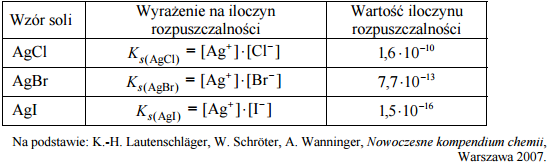
Halogenki srebra są związkami trudno rozpuszczalnymi w wodzie. Ich iloczyny rozpuszczalności w temperaturze 25 ºC wynoszą:
Podaj wzór halogenku srebra, którego rozpuszczalność w wodzie jest najmniejsza.
Zadanie 169. (SR16)
Do zakwaszonego wodnego roztworu manganianu(VII) potasu dodano wodny roztwór nadtlenku wodoru. Zaobserwowano, że początkowo fioletowy roztwór uległ odbarwieniu, a zawartość probówki zaczęła się pienić. Napisz w formie jonowej skróconej z uwzględnieniem pobranych lub oddanych elektronów (zapis jonowo-elektronowy) równania procesów redukcji i utleniania, zachodzących w czasie opisanej reakcji. Uwzględnij, że reakcja przebiega w środowisku kwasowym.
Zadanie 170. (SR17)
Spośród substancji, których wzory podano poniżej, wybierz wszystkie związki jonowe. Podkreśl wzory wybranych substancji.
CH3OH CH3CH2I CH3CH2NH3Cl C6H5ONa SrCl2
Zadanie 171. (SR17)
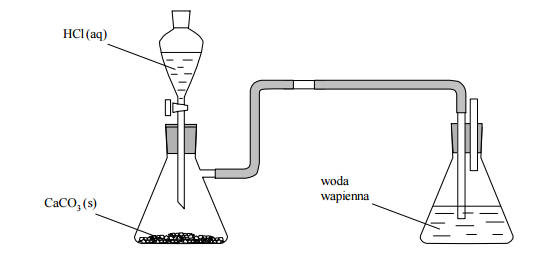
Wykonano doświadczenie, którego przebieg zilustrowano na rysunku.
Przed wykonaniem doświadczenia woda wapienna była klarownym roztworem. W czasie doświadczenia zaobserwowano, że woda wapienna początkowo zmętniała pod wpływem gazu do niej wprowadzonego. Podczas dalszego nasycania jej gazem zmętnienie zanikło.
Napisz w formie jonowej równanie reakcji kwasu solnego ze stałym węglanem wapnia (reakcja 1.), równanie reakcji, w której wyniku nastąpiło zmętnienie wody wapiennej (reakcja 2.), oraz równanie reakcji powodującej zanik zmętnienia wody wapiennej (reakcja 3.)
Zadanie 172. (SR17)
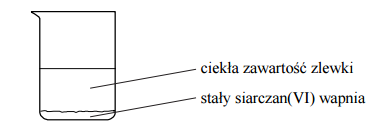
W temperaturze 25 ºC do zlewki z wodą destylowaną wsypano krystaliczny siarczan(VI) wapnia. Zawartość zlewki dokładnie wymieszano, następnie odstawiono. Stwierdzono, że na dnie zlewki pozostał nierozpuszczony siarczan(VI) wapnia – co przedstawiono na poniższym rysunku.
Wybierz i podkreśl w każdym nawiasie poprawne uzupełnienie poniższych zdań. Ciekła zawartość zlewki to (woda / roztwór rzeczywisty / koloid). Aby oddzielić ciekłą zawartość zlewki od stałego siarczanu(VI) wapnia, można zastosować dekantację, w której wykorzystuje się różnicę (gęstości / wielkości cząstek) składników układu, lub filtrację – dzięki różnicy (gęstości / wielkości cząstek) składników układu.
Zadanie 173. (SR17)
W temperaturze T przygotowano wodne roztwory sześciu elektrolitów: NaBr, NH4NO3, HCl, HCOOH, NaClO, NaClO4 o jednakowym stężeniu molowym równym 0,1 mol* dm−3 . Porównaj pH tych roztworów. Uzupełnij zdania wyrażeniami wybranymi spośród podanych poniżej.
wyższe niż równe niższe niż
pH wodnego roztworu NaBr jest ………………………………… pH wodnego roztworu NH4NO3.
pH wodnego roztworu HCl jest …………………………………. pH wodnego roztworu HCOOH.
pH wodnego roztworu NaClO jest ………………………………. pH wodnego roztworu NaClO4.
Zadanie 174. (SR17)
Do probówki wprowadzono bezbarwny klarowny roztwór azotanu(III) sodu, który zakwaszono rozcieńczonym roztworem kwasu siarkowego(VI), a następnie dodano do niego kroplami bezbarwny roztwór jodku potasu o stężeniu 2% masowych oraz roztwór skrobi o stężeniu 1% masowych.
Uzupełnij tabelę – wpisz barwy zawartości probówki przed reakcją i po reakcji, jakie można było zaobserwować w czasie opisanego doświadczenia.
Zadanie 175. (SR17)
Trichlorek fosforu reaguje z wodą zgodnie z równaniem:
Oceń, czy opisana reakcja jest reakcją utleniania i redukcji. Odpowiedź uzasadnij.
Zadanie 176. (SR18)
Produktem spalania sodu w tlenie jest nadtlenek tego metalu o wzorze Na2O2 (reakcja 1.). Do wody z dodatkiem kilku kropli fenoloftaleiny wprowadzono nadtlenek sodu. Przebiegła gwałtowna reakcja, w wyniku której powstał m.in. nadtlenek wodoru, a roztwór zabarwił się na malinowo (reakcja 2.). Następnie do otrzymanej mieszaniny dodano wodny roztwór kwasu siarkowego(VI), czego skutkiem stało się odbarwienie roztworu (reakcja 3.). Otrzymany roztwór ogrzano, co doprowadziło do wydzielenia bezbarwnego i bezwonnego gazu, który podtrzymuje palenie (reakcja 4.). Napisz w formie cząsteczkowej równania czterech opisanych przemian.
Zadanie 177. (SR18)
Przeprowadzono doświadczenie zilustrowane na poniższym schemacie.
Określ odczyn otrzymanego roztworu. Zapisz w formie jonowej skróconej równanie reakcji, którym potwierdzisz wskazany odczyn.
Zadanie 178. (SR18)
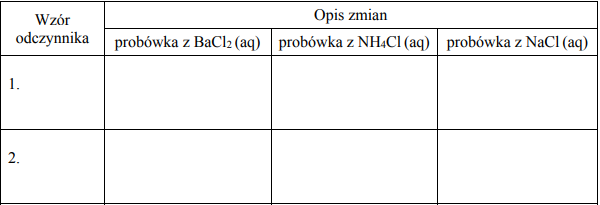
W trzech nieopisanych probówkach znajdują się wodne roztwory następujących soli: BaCl2, NH4Cl oraz NaCl. W każdej probówce znajduje się roztwór tylko jednej soli.
Z poniższej listy wybierz dwa odczynniki, których zastosowanie pozwoli jednoznacznie określić zawartość każdej probówki.
NaOH (aq) NaNO3 (aq) AgNO3 (aq) HCl (aq) Na2SO4 (aq)
Wypełnij poniższą tabelę – wpisz wzory wybranych odczynników oraz opisz zmiany możliwe do zaobserwowania (lub zaznacz brak zmian), zachodzące po dodaniu wybranych odczynników do probówek z wodnymi roztworami soli.
Napisz w formie jonowej skróconej równanie reakcji, która pozwoliła na jednoznaczne określenie zawartości probówki zawierającej wodny roztwór NH4Cl.
Zadanie 179. (SR18)
Wodorotlenek niklu(II) strąca się jako zielonkawy osad z wodnego roztworu soli niklu(II) pod działaniem wodnego roztworu wodorotlenku sodu. Wodorotlenek niklu(II) nie rozpuszcza się w nadmiarze zasady, ale reaguje z kwasami. Pod wpływem utleniaczy ten wodorotlenek przechodzi w czarnobrunatny wodorotlenek niklu(III).
Na podstawie: J. Minczewski, Z. Marczenko, Chemia analityczna. Podstawy teoretyczne i analiza jakościowa, Warszawa 2001.
Do probówki z wodnym roztworem chlorku niklu(II) dodano nadmiar wodnego roztworu wodorotlenku sodu. Napisz w formie jonowej skróconej równanie reakcji otrzymywania wodorotlenku niklu(II) w sposób opisany powyżej. Określ charakter chemiczny (kwasowy, zasadowy, obojętny, amfoteryczny) wodorotlenku niklu(II).
Utlenianie wodorotlenku niklu(II) do wodorotlenku niklu(III) za pomocą chloranu(I) sodu przebiega w środowisku wodnym zgodnie ze schematem:
Napisz w formie jonowej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równania procesów redukcji i utleniania zachodzących podczas opisanej reakcji. Określ stosunek molowy reduktora do utleniacza w tej reakcji.
Do probówki zawierającej zielony roztwór chlorku niklu(II) dodano wodny roztwór wodorotlenku sodu, a następnie – bezbarwny wodny roztwór chloranu(I) sodu, zgodnie ze schematem:
Opisz wygląd zawartości probówki na początku doświadczenia oraz po reakcji I i po reakcji II. Uwzględnij rodzaj mieszaniny (roztwór, zawiesina) oraz jej barwę.
Zadanie 180. (SR18)
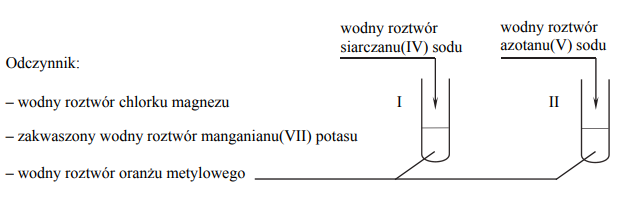
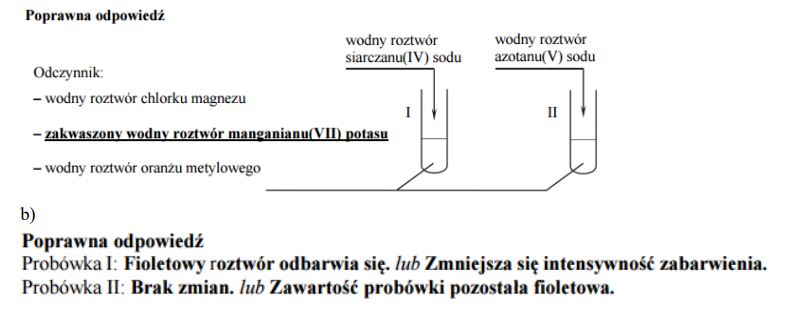
Zaprojektuj doświadczenie, którego przebieg pozwoli na potwierdzenie, że wodny roztwór siarczanu(IV) sodu wprowadzono do probówki I, a wodny roztwór azotanu(V) sodu – do probówki II.
Uzupełnij schemat doświadczenia: podkreśl nazwę odczynnika, który – po dodaniu do niego roztworów opisanych związków i wymieszaniu zawartości probówek – umożliwi zaobserwowanie różnic w przebiegu doświadczenia z udziałem siarczanu(IV) sodu i azotanu(V) sodu.
Opisz zmiany możliwe do zaobserwowania w czasie doświadczenia (lub zaznacz brak zmian), pozwalające na potwierdzenie, że do probówki I wprowadzono roztwór siarczanu(IV) sodu, a do probówki II – roztwór azotanu(V) sodu.
Zadanie 181. (NR15)
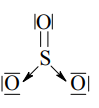
Budowa cząsteczki tlenku siarki(VI) jest skomplikowana. Poniżej przedstawiono jeden ze wzorów opisujących strukturę elektronową SO3.
Określ typ hybrydyzacji orbitali atomu siarki (sp, sp2 , sp3 ) i geometrię cząsteczki (liniowa, płaska, tetraedryczna).
Napisz, ile wiązań σ i π występuje w cząsteczce SO3 o przedstawionej powyżej strukturze.
Zadanie 182. (NR15)
Tlenek siarki(IV) na skalę techniczną można otrzymać w wyniku redukcji siarczanu(VI) wapnia (anhydrytu) węglem w temperaturze 900 °C. Proces ten opisano poniższym równaniem.
Uzupełnij poniższe zdania. Podkreśl właściwe określenie spośród wymienionych w każdym nawiasie. Podniesienie temperatury, w której prowadzony jest proces otrzymywania tlenku siarki(IV), będzie przyczyną (zmniejszenia / zwiększenia) wydajności reakcji, gdyż jest to proces (egzoenergetyczny / endoenergetyczny). Stopień rozdrobnienia anhydrytu i węgla (ma wpływ / nie ma wpływu) na szybkość tej reakcji.
Zadanie 183. (NR15)
Dysponujesz niezbędnym sprzętem laboratoryjnym oraz następującymi odczynnikami:
– mieszaniną dwóch soli: stałego chlorku magnezu i stałego chlorku sodu
– wodą destylowaną
– kwasem solnym
– wodnym roztworem wodorotlenku sodu.
Zaprojektuj doświadczenie, w wyniku którego otrzymasz czysty stały chlorek magnezu. Opisz kolejne etapy wykonania tego doświadczenia.
Zadanie 184. (NR15)
W temperaturze T przygotowano następujące roztwory:
- wodny roztwór Ba(OH)2 o stężeniu 0,05 mol · dm–3
- wodny roztwór KOH o stężeniu 0,1 mol · dm–3
- wodny roztwór NH3 o stężeniu 0,1 mol · dm–3
- wodny roztwór CH3COOH o stężeniu 0,1 mol · dm–3
Porównaj pH przygotowanych roztworów. Uzupełnij zdania wyrażeniami wybranymi spośród podanych poniżej.
Niższe niż równe wyższe niż
pH roztworu 1. jest ……………………… pH roztworu 2. pH roztworu 2. jest ……………………… pH roztworu 3. pH roztworu 3. jest ……………………… pH roztworu 4.
Zadanie 185. (NR15)
Uzupełnij poniższe zdania. Podkreśl właściwe określenie spośród wymienionych w każdym nawiasie. Po porównaniu stałych dysocjacji kwasu chlorowego(I) i kwasu chlorowego(III) można stwierdzić, że w cząsteczce kwasu chlorowego(I) wiązanie O–H jest (bardziej / mniej) spolaryzowane niż w cząsteczce kwasu chlorowego(III). Wodny roztwór kwasu chlorowego(I) ma więc (niższe / wyższe) pH od roztworu kwasu chlorowego(III) o tym samym stężeniu molowym. W wodnych roztworach soli sodowych tych kwasów uniwersalny papierek wskaźnikowy (pozostaje żółty / przyjmuje czerwone zabarwienie / przyjmuje niebieskie zabarwienie).
Zadanie 186. (NR15)
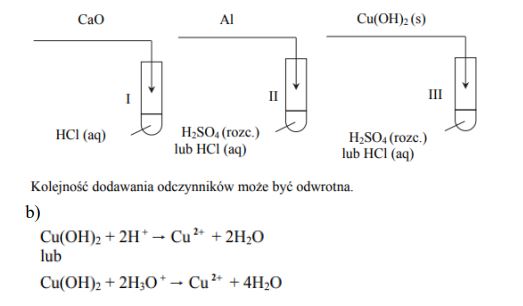
Sole można otrzymać między innymi w reakcjach: 1. tlenków metali z kwasami 2. metali z kwasami 3. wodorotlenków z kwasami.
Zaprojektuj doświadczenie, które pozwoli otrzymać rozpuszczalne w wodzie sole metodą 1. (probówka I), metodą 2. (probówka II) i metodą 3. (probówka III). Na schemacie doświadczenia wpisz wzory użytych odczynników wybranych spośród: Ag (s) HCl (aq) Al (s) CaO (s) H2SO4 (rozc.) Cu(OH)2 (s).
Napisz w formie jonowej skróconej równanie reakcji przebiegającej w probówce III.
Zadanie 187. (NR15)
Manganian(VII) potasu reaguje z kwasem szczawiowym (kwasem etanodiowym HOOC–COOH) w środowisku kwasowym według następującego schematu:
Napisz w formie jonowej, z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy), równania procesów redukcji i utleniania zachodzących podczas tej przemiany.
Dobierz i uzupełnij współczynniki stechiometryczne w poniższym schemacie.
Napisz wzory drobin (cząsteczek lub jonów), które w opisanej przemianie pełnią funkcję utleniacza i reduktora.
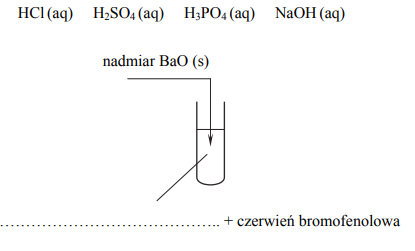
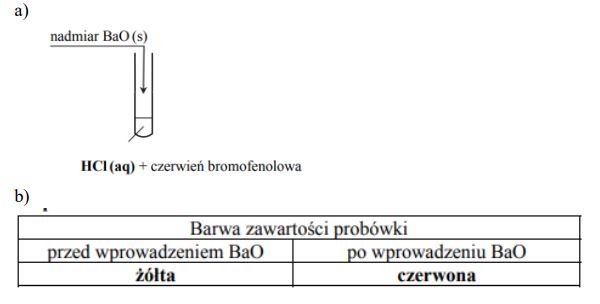
Zadanie 188. (NR16)
Aby potwierdzić zasadowy charakter tlenku baru, przeprowadzano reakcję tego tlenku z pewnym odczynnikiem w obecności wskaźnika pH, którym była czerwień bromofenolowa. Wskaźnik ten w roztworach o pH < 5,2 ma barwę żółtą, a w roztworach o pH > 6,8 przyjmuje barwę czerwoną. W roztworach o 5,2 < pH < 6,8 barwi się na kolor pośredni między żółtym a czerwonym (różne odcienie barwy pomarańczowej). Do probówki wprowadzono wybrany odczynnik z dodatkiem czerwieni bromofenolowej, a następnie dodano nadmiar stałego tlenku baru, dokładnie mieszając jej zawartość. Zaobserwowano, że dodany tlenek baru roztworzył się całkowicie, a powstały w probówce klarowny roztwór zmienił zabarwienie.
Uzupełnij poniższy schemat wykonania doświadczenia. Wpisz wzór odczynnika wybranego spośród następujących:
Napisz, jakie było zabarwienie zawartości probówki przed wprowadzeniem tlenku baru i po jego wprowadzeniu do roztworu znajdującego się w probówce.
Zadanie 189. (NR16)
Jednym z tlenowych kwasów siarki jest kwas trioksotiosiarkowy (nazwa zwyczajowa: kwas tiosiarkowy) o wzorze H2S2O3. Anion S2O32− (tiosiarczanowy) ma strukturę analogiczną do struktury jonu siarczanowego(VI), z tą różnicą, że zamiast jednego atomu tlenu zawiera atom siarki. Centralnemu atomowi siarki w jonie S2O32− odpowiada stopień utlenienia (VI), a skrajnemu – stopień utlenienia (–II). Kwas tiosiarkowy jest substancją nietrwałą, trwałe są natomiast sole tego kwasu – tiosiarczany. Spośród tych soli największe znaczenie ma tiosiarczan sodu – zwykle występujący jako pentahydrat o wzorze Na2S2O3 · 5H2O. Znajduje on zastosowanie w przemyśle włókienniczym jako substancja służąca do usuwania resztek chloru używanego do bielenia tkanin. Podczas zachodzącej reakcji chlor utlenia jony S2O32− do jonów siarczanowych(VI). W przemianie tej udział bierze również woda.
Napisz w formie jonowej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równanie reakcji redukcji i równanie reakcji utleniania zachodzących podczas procesu usuwania resztek chloru użytego do bielenia tkanin za pomocą jonów tiosiarczanowych. Uwzględnij, że w przemianie bierze udział woda.
Napisz w formie jonowej skróconej sumaryczne równanie opisanej reakcji usuwania chloru.
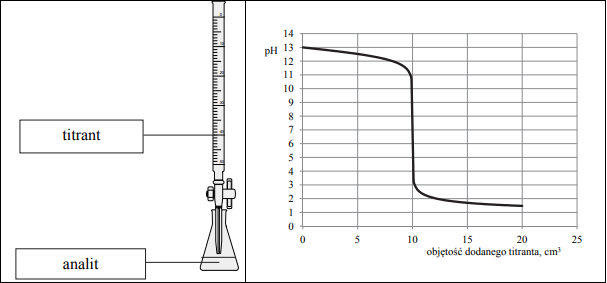
Zadanie 190. (NR16)
Przeprowadzono doświadczenie, podczas którego do 10 cm3 wodnego roztworu wodorotlenku sodu dodawano kroplami wodny roztwór pewnego elektrolitu o stężeniu cm = 0,1 mol · dm–3, mierząc pH mieszaniny reakcyjnej. Przebieg doświadczenia zilustrowano schematem.
Opisane doświadczenie jest przykładem miareczkowania alkacymetrycznego (kwasowo-zasadowego), które polega na dodawaniu z biurety roztworu, nazywanego titrantem, do kolby z próbką, nazywaną analitem. W miareczkowaniu wykorzystuje się stechiometryczną zależność między substancjami obecnymi w analicie i titrancie.
Uzupełnij poniższe zdania. Podkreśl właściwy odczyn roztworu, a w miejsca kropek wpisz odpowiednie wzory związków. Można stwierdzić, że otrzymany roztwór, który powstał po zmieszaniu roztworów zawierających stechiometryczne ilości reagentów, miał odczyn (kwasowy / obojętny / zasadowy) oraz że analitem był wodny roztwór …………………………. . Informacje te pozwalają na jednoznaczny wybór spośród wodnych roztworów elektrolitów:
HCOOH (aq), CH3COOH (aq), HCl (aq), NH3 (aq), NaOH (aq)
związku, którego wodny roztwór pełnił podczas opisanego doświadczenia funkcję titranta. Związek ten ma wzór …………………………………………… .
Na podstawie analizy wykresu określ, jaką barwę przyjąłby żółty uniwersalny papierek wskaźnikowy, gdyby podczas przeprowadzanego doświadczenia został on zanurzony w roztworze, do którego dodano: 5 cm3 , 10 cm3 oraz 15 cm3 titranta.
Aby roztwór przewodził prąd elektryczny, muszą być w tym roztworze obecne jony. Im większa jest ich ruchliwość, tym przewodnictwo jest większe. Dwa najbardziej ruchliwe jony to kationy wodorowe (H+ ) i aniony wodorotlenkowe (OH– ).Ruchliwość innych jonów jest znacznie mniejsza.
Gdy analizuje się ruchliwość jonów obecnych w roztworze w danym momencie opisanego miareczkowania, można przewidzieć, jak zmienia się jego przewodnictwo (inne czynniki można tu pominąć). Zaznacz poprawne dokończenie zdania. W miarę dodawania titranta do wodnego roztworu wodorotlenku sodu
- zarówno pH, jak i przewodnictwo roztworu rosną.
- pH roztworu rośnie, a przewodnictwo roztworu maleje.
- pH roztworu maleje, a przewodnictwo najpierw maleje, a potem rośnie.
- pH roztworu maleje, a przewodnictwo najpierw rośnie, a potem maleje.
Zadanie 191. (NR16)
W wyniku niektórych reakcji chemicznych powstają mieszaniny niejednorodne. Zaprojektuj doświadczenie prowadzące do powstania niejednorodnej mieszaniny, w której skład wchodzi wodny roztwór kwasu siarkowego(VI).
Uzupełnij schemat doświadczenia. Wybierz i zaznacz po jednym wzorze odczynnika w zestawach I i II.
Opisz obserwowane zmiany zawartości probówki podczas przeprowadzonego doświadczenia przy założeniu, że reagentów użyto w ilościach stechiometrycznych (należy opisać wygląd zawartości probówki przed dodaniem odczynnika z zestawu I oraz po zajściu reakcji chemicznej).
Napisz w formie jonowej skróconej równanie reakcji zachodzącej podczas przeprowadzonego doświadczenia przy założeniu, że reagentów użyto w ilościach stechiometrycznych.
Podaj nazwę metody, którą należy zastosować w celu wyodrębnienia wodnego roztworu kwasu siarkowego(VI) z mieszaniny poreakcyjnej.
Zadanie 192. (NR16)
Przeprowadzono doświadczenie zilustrowane poniższym schematem.
Powstanie malinowego zabarwienia roztworu zaobserwowano tylko w jednej probówce, a pH wodnego roztworu w probówce, w której nie uzyskano malinowego roztworu, było mniejsze od 7.
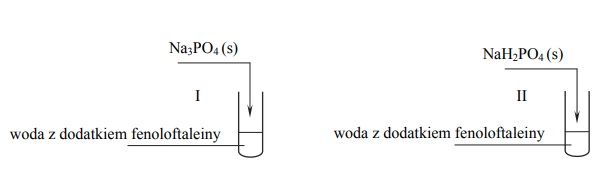
Napisz w formie jonowej równanie procesu decydującego o odczynie wodnego roztworu tej soli, po której wprowadzeniu do probówki z wodą i fenoloftaleiną nie uzyskano malinowego roztworu.
Z dwóch jonów: PO3-4 i H2PO–4 , tylko jeden może pełnić zarówno funkcję zasady Brønsteda, jak i funkcję kwasu Brønsteda. Wybierz ten jon. Uzupełnij podane poniżej zapisy, tak aby otrzymać dwa równania reakcji (w środowisku kwasowym i zasadowym) z udziałem wybranego jonu.
Zadanie 193. (NR16)
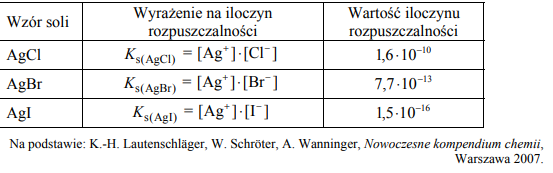
Iloczyn rozpuszczalności Ks soli i wodorotlenków jest stałą równowagi dynamicznej, jaka ustala się między nasyconym roztworem substancji a jej osadem. W poniższej tabeli zestawiono wartości iloczynu rozpuszczalności trzech trudno rozpuszczalnych w wodzie soli srebra w temperaturze 298 K.
W probówce umieszczono 3 cm3 wodnego roztworu azotanu(V) srebra o stężeniu 0,1mol*dm-3. Następnie przygotowano trzy odczynniki:
− wodny roztwór chlorku potasu o stężeniu 0,1mol*dm-3
− wodny roztwór bromku potasu o stężeniu 0,1mol*dm-3
− wodny roztwór jodku potasu o stężeniu 0,1mol*dm-3
Wybierz odczynnik, którego dodanie do roztworu azotanu(V) srebra w ilości stechiometrycznej spowoduje, że stężenie jonów Ag+ w roztworze po reakcji będzie najmniejsze. Uzupełnij schemat doświadczenia – wpisz nazwę wybranego odczynnika. Uzasadnij swój wybór.
Zadanie 194. (NR16)
W celu zbadania efektu cieplnego reakcji chemicznych przeprowadzono cztery doświadczenia oznaczone numerami I–IV. Mieszano po 100 cm3 wodnych roztworów substancji, wymienionych w odpowiednich wierszach tabeli, o stężeniu molowym 3 0,2 mol dm− ⋅ i o początkowej temperaturze równej 25 ºC. Następnie zmierzono temperaturę każdej z otrzymanych mieszanin.
Zaobserwowano, że w każdym doświadczeniu temperatura uzyskanych mieszanin była wyższa niż temperatura użytych roztworów i że przyrost temperatury ΔT w niektórych doświadczeniach był taki sam.
Napisz w formie jonowej równanie reakcji ilustrujące przemiany, które dokonały się podczas doświadczenia oznaczonego numerem III.
Napisz numery wszystkich doświadczeń, w których zaobserwowany wzrost temperatury ΔT był jednakowy.
Zadanie 195. (NR17)
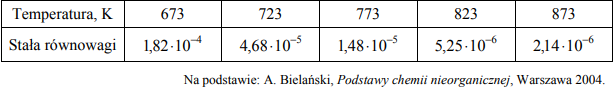
Reakcja syntezy amoniaku przebiega zgodnie z równaniem:
W poniższej tabeli zestawiono wartości stałej równowagi reakcji syntezy amoniaku w różnych temperaturach.
Przeanalizuj dane dotyczące syntezy amoniaku. Następnie uzupełnij zdania wyrażeniami spośród podanych poniżej.
Zmaleje wzrośnie się nie zmieni
Jeżeli w układzie będącym w stanie równowagi nastąpi wzrost temperatury w warunkach izobarycznych (p = const), to wydajność reakcji syntezy amoniaku ………………………………………. , natomiast przy wzroście ciśnienia w warunkach izotermicznych (T = const) wydajność tego procesu ………………………………………. . Jeżeli zmaleje temperatura w układzie, to szybkość reakcji syntezy amoniaku ………………………………………. .
Zadanie 196. (NR17)
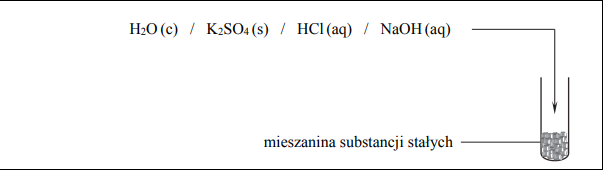
Zaprojektuj doświadczenie, którym potwierdzisz, że w uzyskanej mieszaninie substancji stałych znajduje się węglan. Uzupełnij schemat doświadczenia – podkreśl wzór jednego odczynnika, którego dodanie (w nadmiarze) do mieszaniny znajdującej się w probówce doprowadzi do potwierdzenia obecności węglanu, oraz opisz zmiany możliwe do zaobserwowania w czasie doświadczenia.
Zadanie 197. (NR17)
Węglany w roztworach wodnych ulegają hydrolizie anionowej, która polega na dysocjacji zasadowej anionu, zgodnie z równaniem:
Drugi etap hydrolizy polegający na reakcji jonu HCO3 − z wodą zachodzi w tak małym stopniu, że nie ma wpływu na pH roztworu.
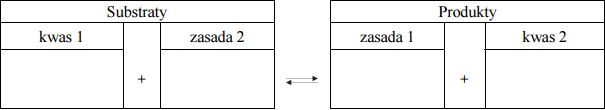
Dla przemiany zilustrowanej powyższym równaniem napisz wzory kwasów i zasad tworzących w tej reakcji sprzężone pary. Uzupełnij poniższą tabelę.
Oceń, czy podwyższenie pH roztworu, w którym przebiegła reakcja zilustrowana powyższym równaniem, poskutkuje zmniejszeniem, czy – zwiększeniem stężenia anionów węglanowych CO2-3.
Zadanie 198. (NR17)
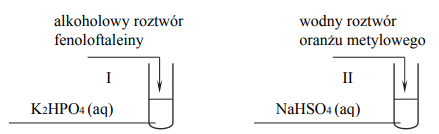
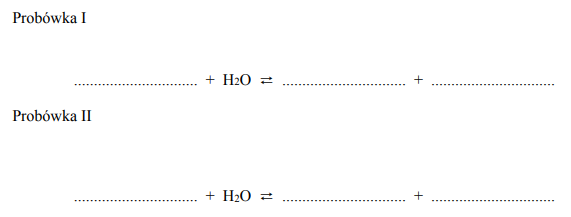
Przeprowadzono doświadczenie, którego przebieg zilustrowano na schemacie:
Podczas przeprowadzonego doświadczenia zaobserwowano, że zawartość probówki I przybrała zabarwienie malinowe, a zawartość probówki II – czerwone. Uzupełnij poniższe zapisy, tak aby otrzymać w formie jonowej skróconej równania procesów zachodzących w probówkach I oraz II i decydujących o odczynie wodnych roztworów soli.
Zadanie 200. (NR18)
Kwas siarkowy(VI) w temperaturze pokojowej jest oleistą cieczą o gęstości prawie dwukrotnie większej niż gęstość wody. Czysty, bezwodny kwas siarkowy(VI) ulega częściowej autodysocjacji, dzięki czemu przewodzi prąd elektryczny. W wyniku reakcji kwasu siarkowego(VI) z wodorotlenkiem sodu, w której stosunek molowy substratów jest równy 1 : 1, powstaje wodorosiarczan(VI) sodu. Wodny roztwór wodorosiarczanu(VI) sodu charakteryzuje się kwasowym odczynem, ponieważ jony obecne w roztworze ulegają reakcji zgodnie z poniższym równaniem:
Napisz równanie autodysocjacji kwasu siarkowego(VI) polegającej na przeniesieniu protonu z jednej cząsteczki H2SO4 do drugiej. W równaniu podkreśl wzór kwasu Brønsteda sprzężonego z cząsteczką H2SO4 jako zasadą Brønsteda.
Zadanie 201. (NR18)
Wartości pH wody oraz wodnych roztworów kwasów i wodorotlenków mogą ulegać znacznym zmianom podczas dodawania do nich mocnych kwasów lub zasad. Istnieją jednak roztwory, których pH zmienia się nieznacznie po dodaniu mocnego kwasu lub zasady na skutek reakcji składników roztworu z jonami wodorowymi lub jonami wodorotlenkowymi. Nazywamy je buforami pH. Buforowe właściwości mają roztwory zawierające sprzężoną parę kwas–zasada Brønsteda w podobnych stężeniach, np.: słaby kwas i jego sól z mocną zasadą, słabą zasadę i jej sól z mocnym kwasem, słaby kwas wieloprotonowy i jego wodorosól lub mieszaninę wodorosoli.
Przykładem buforu pH jest bufor octanowy, który otrzymuje się przez rozpuszczenie w wodzie kwasu etanowego (octowego) i etanianu (octanu) sodu. Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.
Jednym z buforów odpowiedzialnych za utrzymanie równowagi kwasowo-zasadowej krwi jest bufor fosforanowy, który można otrzymać przez rozpuszczenie dwóch wodorosoli kwasu ortofosforowego(V) w wodzie. Napisz w formie jonowej skróconej dwa równania reakcji ilustrujące działanie opisanego buforu fosforanowego. Przyjmij, że substraty reagują w stosunku molowym 1 : 1.
Zadanie 202. (NR18)
Do probówki z wodnym roztworem chlorku niklu(II) dodano nadmiar wodnego roztworu wodorotlenku sodu. Napisz w formie jonowej skróconej równanie reakcji otrzymywania wodorotlenku niklu(II) w sposób opisany powyżej. Określ charakter chemiczny (kwasowy, zasadowy, obojętny, amfoteryczny) wodorotlenku niklu(II).
Zadanie 203. (NR18)
Utlenianie wodorotlenku niklu(II) do wodorotlenku niklu(III) za pomocą chloranu(I) sodu przebiega w środowisku wodnym zgodnie ze schematem:
Napisz w formie jonowej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równania procesów redukcji i utleniania zachodzących podczas opisanej reakcji. Określ stosunek molowy reduktora do utleniacza w tej reakcji.
Zadanie 204. (NR18)
Do probówki zawierającej zielony roztwór chlorku niklu(II) dodano wodny roztwór wodorotlenku sodu, a następnie – bezbarwny wodny roztwór chloranu(I) sodu – zgodnie ze schematem:
Opisz wygląd zawartości probówki na początku doświadczenia oraz po reakcji I i po reakcji II. Uwzględnij rodzaj mieszaniny (roztwór, zawiesina) oraz jej barwę.