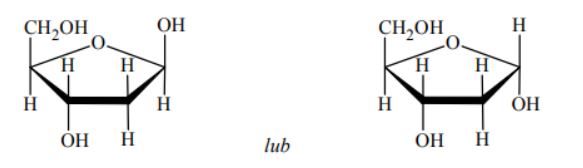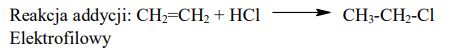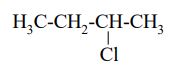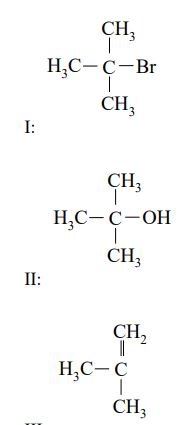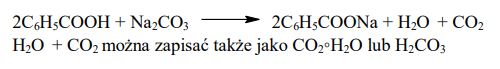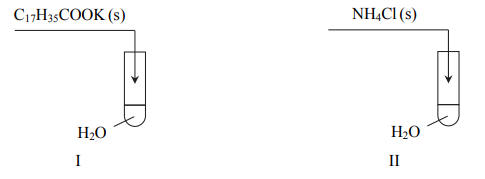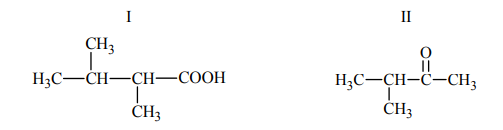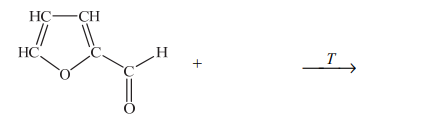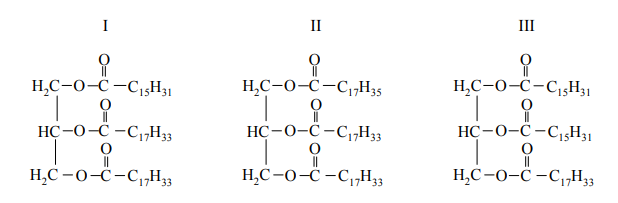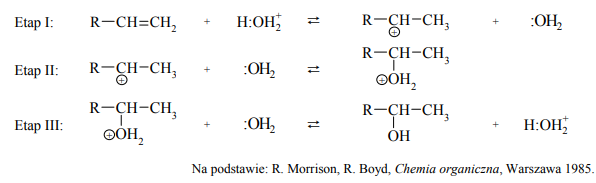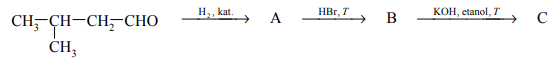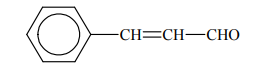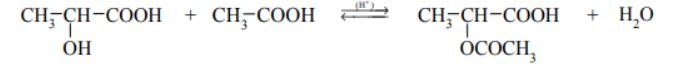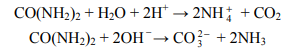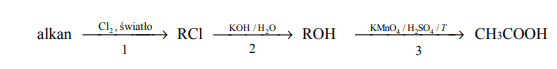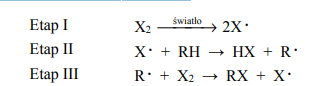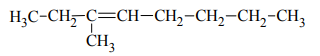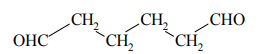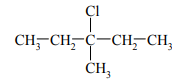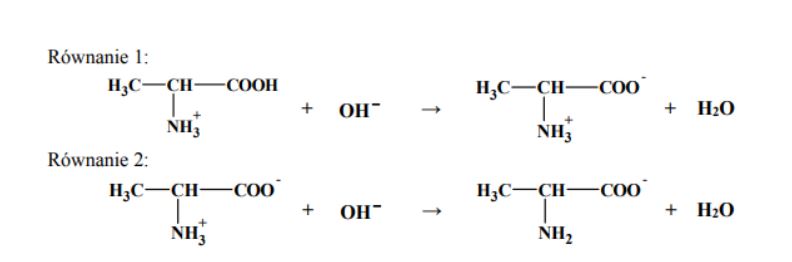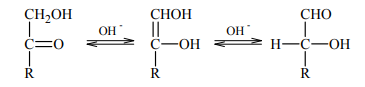Zadania maturalne z Chemii
Tematyka: tłuszcze, aminokwasy, peptydy, białka, cukry, izomeria optyczna.
Zadania pochodzą z oficjalnych arkuszy maturalnych CKE, które służyły przeprowadzaniu majowych egzaminów. Czteroznakowy kod zapisany przy każdym zadaniu wskazuje na jego pochodzenie: S/N – „stara”/”nowa” formuła; P/R – poziom podstawowy/rozszerzony; np. 08 – rok 2008.
Zbiór zadań maturalnych w formie arkuszy, możesz pobrać >> TUTAJ <<.
Zadanie 170. (SR17)
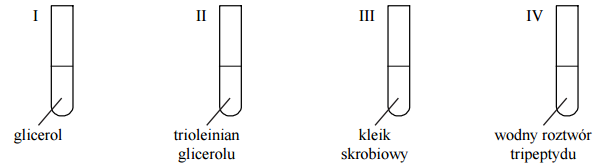
W czterech probówkach umieszczono próbki substancji organicznych lub ich wodnych roztworów – zgodnie z poniższym rysunkiem.
Obecność niektórych substancji organicznych można potwierdzić przez wykonanie próby, czyli poddanie ich działaniu wybranych odczynników, którymi mogą być m.in.: a) woda bromowa b) roztwór jodu w wodnym roztworze jodku potasu c) zawiesina świeżo wytrąconego wodorotlenku miedzi(II) na zimno. Przeprowadzono doświadczenie, w którym do każdej probówki I–IV wprowadzono wybrany odczynnik a) – c). Wyniki wykonanych prób potwierdziły obecność substancji organicznej znajdującej się w każdej probówce. Do zawartości każdej probówki I–IV dobierz jedną z wymienionych prób umożliwiającą potwierdzenie obecności substancji organicznej znajdującej się w probówce. Wpisz do tabeli literę, którą oznaczono tę próbę, oraz napisz, jaki możliwy do zaobserwowania efekt tej próby będzie potwierdzeniem obecności danej substancji. Uwzględnij fakt, że każda próba została przeprowadzona co najmniej raz.
Zadanie 171. (SR17)
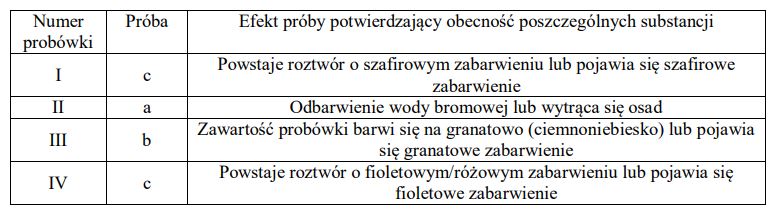
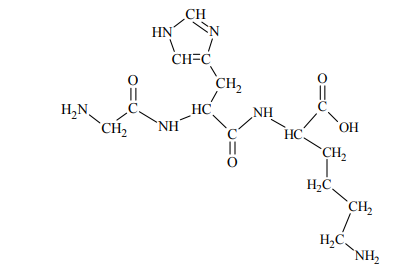
Tripeptyd, którego wzór przedstawiono poniżej, zbudowany jest z reszt trzech różnych aminokwasów.
Napisz wzór półstrukturalny (grupowy) tego aminokwasu, którego grupa karboksylowa i grupa aminowa uczestniczyły w utworzeniu wiązania peptydowego w cząsteczce opisanego tripeptydu. Oceń, czy cząsteczka tego aminokwasu jest chiralna. Odpowiedź uzasadnij.
Zadanie 172. (SR17)
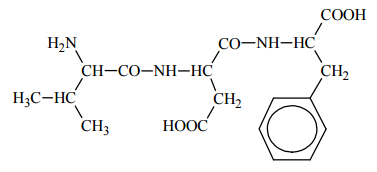
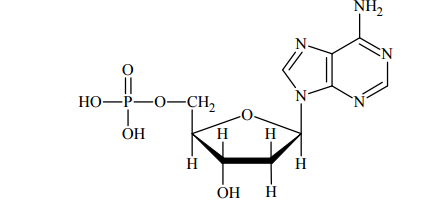
Poniższy wzór ilustruje budowę deoksyrybonukleotydu: Napisz wzór taflowy Hawortha formy pierścieniowej monosacharydu, którego reszta wchodzi w skład tego deoksyrybonukleotydu.
Zadanie 173. (SR17)
Nylon jest syntetycznym tworzywem sztucznym o następującym wzorze ogólnym:
Powstaje on w wyniku reakcji polikondensacji odpowiedniej diaminy i odpowiedniego kwasu dikarboksylowego.
Napisz wzory półstrukturalne (grupowe) diaminy oraz kwasu dikarboksylowego, z których to substancji otrzymuje się nylon w reakcji polikondensacji.
Poniżej wymieniono nazwy związków, które powstają w wyniku kondensacji związków o mniejszych cząsteczkach. Spośród wymienionych grup wybierz grupę tych związków, w których cząsteczkach powstały w wyniku reakcji kondensacji takie same wiązania, jakie powstają w wyniku kondensacji diaminy i kwasu dikarboksylowego.
A. glicerydy
B. polipeptydy
C. polisacharydy
Wzór diaminy: H2N-(CH2)6-NH2
Wzór kwasu dikarboksylowego: HOOC-(CH2)4-COOH
B.polipeptydy
Zadanie 174. (SR18)
Chloroetan (chlorek etylu) można otrzymać w reakcji addycji lub w reakcji substytucji. Do zapoczątkowania jednej z opisanych reakcji konieczna jest np. obecność światła. W obu tych przemianach substratem organicznym jest węglowodór – inny w każdej z przemian. O węglowodorach tych wiadomo, że należą do dwóch różnych szeregów homologicznych.
Zapisz równania opisanych reakcji, z uwzględnieniem faktu, że jedna z nich zachodzi w obecności światła. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
Określ, według jakiego mechanizmu (elektrofilowego, nukleofilowego, rodnikowego) przebiegają opisane reakcje addycji i substytucji, w wyniku których można otrzymać chloroetan. Uzupełnij tabelę.
Zadanie 175. (SR18)
Cząsteczki jednego z izomerów konstytucyjnych o wzorze C4H9Cl są chiralne.
Narysuj wzór półstrukturalny (grupowy) tego izomeru.
Zadanie 176. (SR18)
Poniżej przedstawiono ciąg przemian chemicznych:
O związkach organicznych I, II i III wiadomo, że:
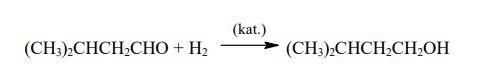
- związek I jest monobromopochodną alkanu
- związek II jest alkoholem trzeciorzędowym
- w cząsteczce związku III są cztery atomy węgla i osiem atomów wodoru.
Zidentyfikuj związki I, II i III i napisz ich wzory półstrukturalne (grupowe)
Zadanie 177. (SR18)
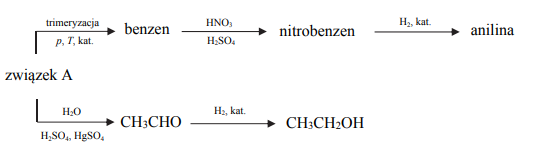
Poniżej przedstawiono ciągi przemian, w wyniku których otrzymano anilinę oraz etanol.
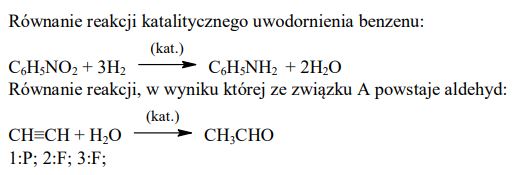
Napisz, stosując wzory półstrukturalne (grupowe) lub uproszczone wzory związków organicznych, równanie reakcji katalitycznego uwodornienia nitrobenzenu oraz równanie reakcji, w wyniku której ze związku A powstaje aldehyd.
Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.
Zadanie 178. (SR18)
Podstawnik już obecny w pierścieniu aromatycznym wywiera wpływ na miejsce wprowadzenia do niego kolejnego podstawnika w reakcjach elektrofilowych. Grupy alkilowe, –Cl, –Br, –NH2, –OH kierują kolejny podstawnik w pozycje orto- i para- w stosunku do własnego położenia. Obecność w pierścieniu aromatycznym grupy –NO2, –COOH czy –CHO powoduje, że kolejny podstawnik jest wprowadzany głównie w pozycję meta-. Na lekcji chemii uczniowie projektowali ciąg przemian chemicznych opisany poniższym schematem.
benzen → związek organiczny X → m-chloronitrobenzen
Uczeń I zaproponował, aby najpierw przeprowadzić reakcję benzenu z chlorem (stosunek molowy reagentów 1 : 1) w obecności FeCl3 jako katalizatora, a następnie na otrzymany produkt podziałać mieszaniną nitrującą. Uczeń II stwierdził, że należy najpierw przeprowadzić reakcję benzenu z mieszaniną nitrującą i otrzymać mononitropochodną, a dopiero później na otrzymany produkt podziałać chlorem (stosunek molowy reagentów 1 : 1) w obecności FeCl3 jako katalizatora. Oceń projekty doświadczeń obu uczniów i wskaż ucznia (I albo II), który błędnie zaprojektował doświadczenie. Uzasadnij swoje stanowisko.
Błędnie zaprojektował doświadczenie uczeń I. Uzasadnienie: Grupa nitrowa jest podstawnikiem II rodzaju i kieruje kolejny podstawnik w pozycję meta. Gdyby kolejność przemian była odwrotna, chlor – jako podstawnik I rodzaju – skierowałby kolejny podstawnik w pozycję orto i para i powstałyby dwa produkty inne niż ten, który należało otrzymać.
Lub
W pierwszej kolejności trzeba wprowadzić podstawnik II rodzaju (grupę nitrową), który skieruje kolejny w położenie meta. lub Chlor skieruje kolejny podstawnik w położenie orto i para, czyli nie otrzyma się izomeru meta.
Zadanie 179. (SR18)
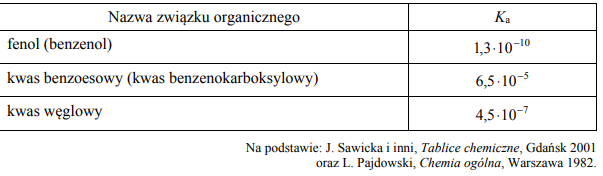
W poniższej tabeli podane są wartości stałej dysocjacji wybranych związków w temperaturze T.
W dwóch nieoznakowanych probówkach znajdują się oddzielnie wodne roztwory kwasu benzoesowego i fenolu.
Wyjaśnij, dlaczego możliwe jest odróżnienie wodnego roztworu kwasu benzoesowego od wodnego roztworu fenolu przy użyciu stałego Na2CO3.
Napisz w formie cząsteczkowej równanie reakcji, która jest podstawą eksperymentu.
Zadanie 180. (SR18)
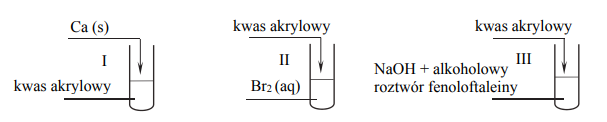
Kwas akrylowy jest związkiem o wzorze CH2=CHCOOH W warunkach laboratoryjnych jest on cieczą.
Przeprowadzono doświadczenie z udziałem kwasu akrylowego zgodnie z poniższym schematem:
Opisz możliwe do zaobserwowania objawy reakcji w każdej probówce, jeżeli w każdej z przemian kwas akrylowy był reagentem użytym w nadmiarze.
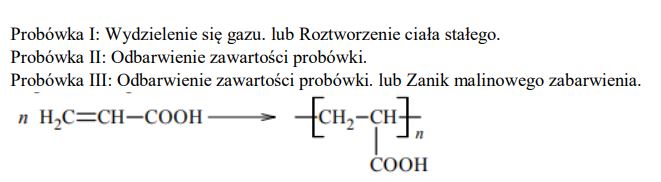
Dokończ, stosując wzory półstrukturalne (grupowe), poniższy zapis, tak aby przedstawiał on równanie reakcji polimeryzacji kwasu akrylowego, lub zaznacz, że taka przemiana nie zachodzi.
n CH2=CHCOOH → …..
Napisz, czy wzór półstrukturalny CH2=CHCOOH odpowiada dwóm izomerom geometrycznym cis–trans. Odpowiedź uzasadnij.
Zadanie 181. (SR18)
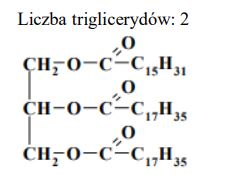
Produktami hydrolizy pewnego triglicerydu są glicerol oraz kwasy – palmitynowy C15H31COOH i stearynowy C17H35COOH – w stosunku molowym 1 : 2. Podaj liczbę wszystkich triglicerydów (bez uwzględniania stereoizomerów), które mogły być poddane opisanej reakcji hydrolizy. Narysuj wzór półstrukturalny (grupowy) tego triglicerydu, który jest związkiem czynnym optycznie.
Zadanie 182. (SR18)
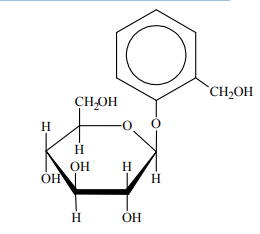
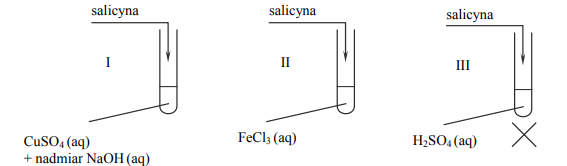
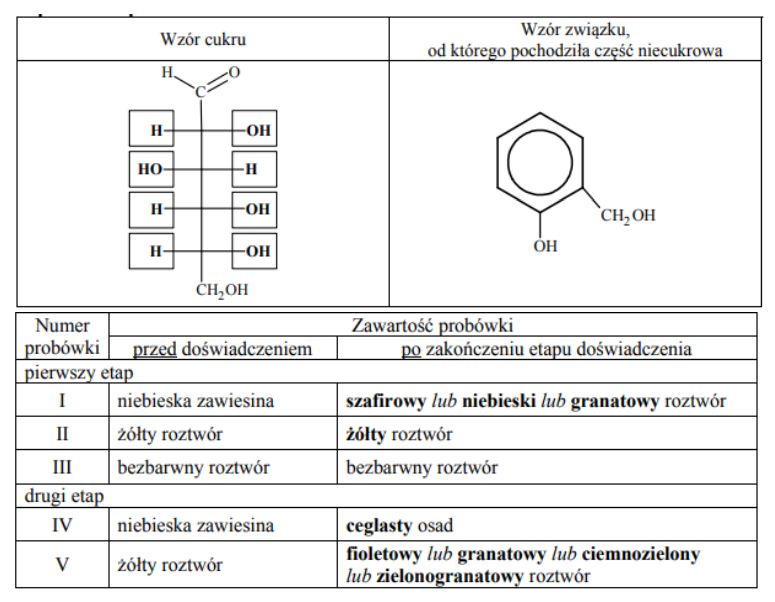
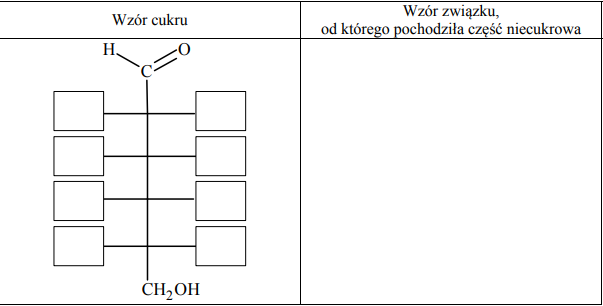
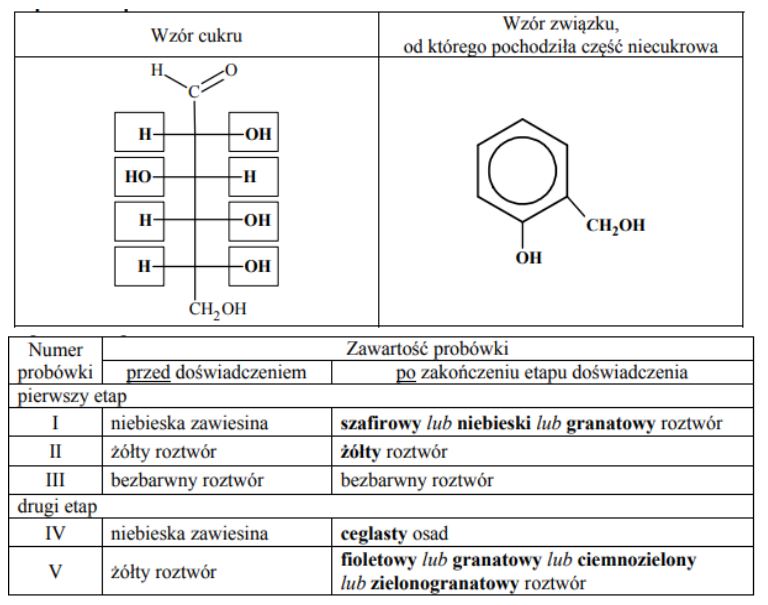
Glikozydy to grupa związków organicznych stanowiących połączenie cukrów z innymi substancjami. Cząsteczka glikozydu jest złożona z części cukrowej oraz części niecukrowej. Ważną grupę glikozydów stanowią O-glikozydy, których cząsteczki powstają w wyniku reakcji kondensacji z udziałem grupy hydroksylowej cząsteczki cukru. Jednostki cukrowe występują zwykle w formie cyklicznej i łączą się z częścią niecukrową za pośrednictwem anomerycznego atomu węgla. Jednym z glikozydów jest salicyna o wzorze:
Salicyna tworzy bezbarwne kryształy.
W środowisku kwasowym O-glikozydy ulegają hydrolizie. Jej produktami są cukier i związek, od którego pochodziła niecukrowa część glikozydu. Napisz wzór łańcuchowy (w projekcji Fischera) cukru powstającego w wyniku hydrolizy salicyny. Uzupełnij poniższy schemat – wpisz w odpowiednie pola wzory grupy –OH lub symbole atomów wodoru. Narysuj wzór półstrukturalny (grupowy) związku, od którego pochodziła niecukrowa część glikozydu.
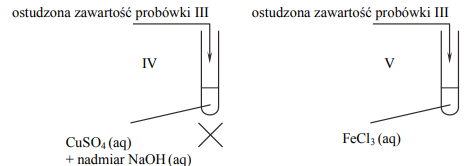
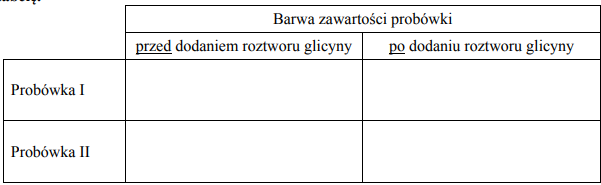
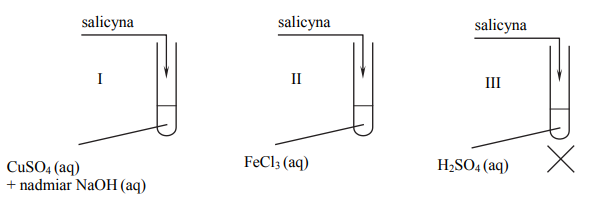
W celu zbadania właściwości salicyny przeprowadzono dwuetapowe doświadczenie, którego przebieg zilustrowano na schemacie. W pierwszym etapie salicynę wprowadzono do probówek I–III, w których znajdowały się następujące odczynniki:
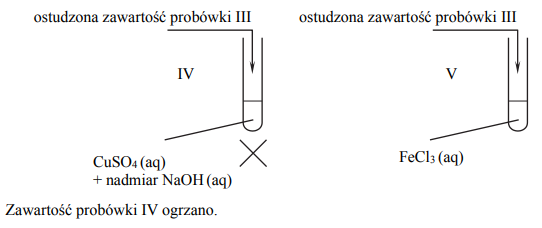
Zawartość probówki III ogrzano. W każdej probówce otrzymano roztwór. W drugim etapie mieszaninę poreakcyjną otrzymaną w probówce III ostudzono i rozdzielono na dwie probówki: IV i V, w których znajdowały się następujące odczynniki:
Zawartość probówki IV ogrzano. Uzupełnij poniższą tabelę – opisz barwę zawartości każdej probówki po zakończeniu danego etapu doświadczenia.
Zadanie 183. (SR18)
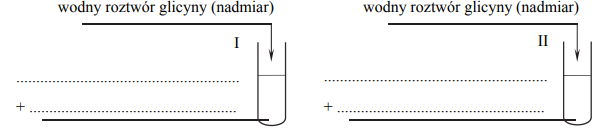
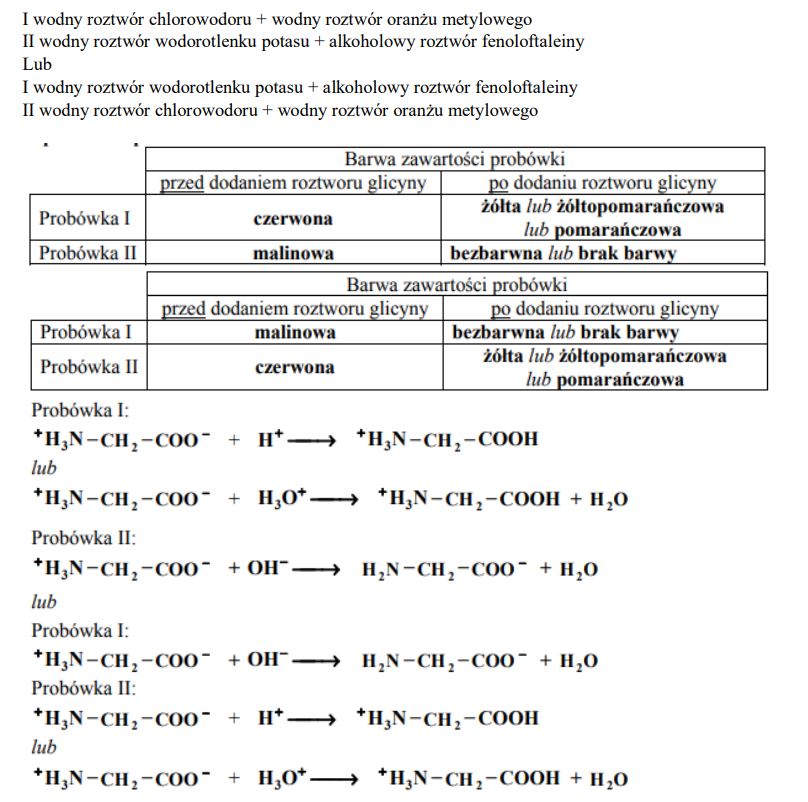
Zaprojektuj doświadczenie, którego przebieg pozwoli wykazać, że glicyna (kwas aminoetanowy) jest związkiem amfoterycznym.
Z poniżej zaproponowanych odczynników i wskaźników wybierz te, których użycie potwierdzi amfoteryczne właściwości glicyny. Uzupełnij schemat doświadczenia – wpisz nazwy odczynników i wskaźników wybranych z podanej poniżej listy.
– wodny roztwór chlorku sodu
– alkoholowy roztwór fenoloftaleiny
– wodny roztwór wodorowęglanu sodu
– wodny roztwór wodorotlenku potasu
– wodny roztwór chlorowodoru
– wodny roztwór oranżu metylowego
Schemat doświadczenia:
Opisz zmiany potwierdzające amfoteryczne właściwości glicyny. Wypełnij poniższą tabelę.
Stosując wzór jonu obojnaczego glicyny, napisz w formie jonowej skróconej równania reakcji zachodzących po wprowadzeniu wodnego roztworu tego aminokwasu do probówek I i II.
Zadanie 184. (SR18)
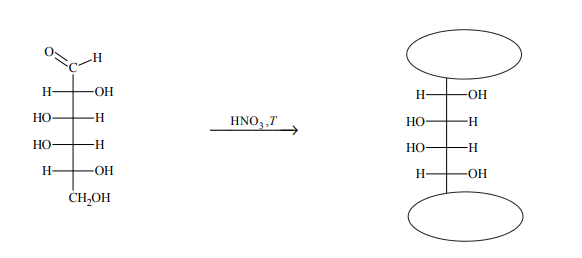
Aldozy utleniają się tak samo łatwo, jak inne aldehydy, dlatego redukują np. odczynnik Tollensa. Działanie na aldozę kwasem azotowym(V), który jest silnym utleniaczem, skutkuje utlenieniem nie tylko grupy –CHO, lecz także grupy –CH2OH. Produktami utlenienia aldoz kwasem azotowym(V) są kwasy dikarboksylowe.
Na podstawie: R. Morrison, R. Boyd, Chemia organiczna, Warszawa 1985.
Przeprowadzono reakcję chemiczną, w której na D-galaktozę podziałano kwasem azotowym(V). Uzupełnij poniższy schemat – wpisz w zaznaczone pola wzory odpowiednich fragmentów cząsteczki związku organicznego. Oceń, czy cząsteczka powstałego związku organicznego jest chiralna. Uzasadnij odpowiedź.
Zadanie 185. (NR15)
Substancje o tym samym typie wzoru chemicznego, tworzące ten sam typ sieci przestrzennej i o takich samych lub bardzo zbliżonych rozmiarach komórki elementarnej, nazywamy substancjami izomorficznymi. Mogą one tworzyć roztwory stałe, czyli kryształy mieszane. Tworzenie kryształów mieszanych polega na tym, że atomy lub jony wykazujące taki sam ładunek oraz zbliżone rozmiary mogą się wzajemnie zastępować w sieci przestrzennej. KCl i KBr mają identyczne sieci przestrzenne i wykazują zdolność tworzenia stałych roztworów. Natomiast w przypadku KCl i NaCl izomorfizm nie występuje mimo tego samego typu sieci. W tabeli podano wielkości promienia jonowego czterech jonów
Wyjaśnij, dlaczego chlorek potasu i chlorek sodu nie mogą tworzyć kryształów mieszanych.
KCl i NaCl nie mogą tworzyć kryształów mieszanych, bo chociaż tworzą ten sam typ sieci przestrzennej, są związkami o tym samym typie wzoru chemicznego i ich jony wykazują taki sam ładunek, kationy potasu i kationy sodu znacznie różnią się rozmiarami, więc nie mogą się zastępować w sieci przestrzennej.
Lub
KCl i NaCl tworzą kryształy, które różnią się rozmiarem komórki elementarnej.
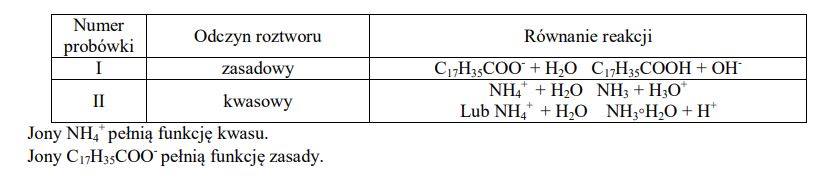
Zadanie 186. (NR15)
Wykonano doświadczenie zilustrowane na poniższym schemacie.
Określ odczyn roztworu powstałego w probówce I i odczyn roztworu powstałego w probówce II oraz napisz w formie jonowej skróconej równania reakcji zachodzących podczas tego doświadczenia.
Określ, jaką funkcję (kwasu czy zasady) według teorii Brønsteda−Lowry’ego pełnią w reakcjach zachodzących podczas opisanego doświadczenia jony NH+ 4 i jony C17H35COO− .
Zadanie 187. (NR15)
W cząsteczce pewnego optycznie czynnego nasyconego łańcuchowego alkoholu monohydroksylowego o nierozgałęzionym łańcuchu jest pięć atomów węgla. W wyniku utlenienia tego alkoholu powstaje keton. Narysuj wzór półstrukturalny (grupowy), podaj nazwę systematyczną oraz określ rzędowość opisanego alkoholu.
Wzór: CH3-CH(OH)-CH2-CH2-CH3
Nazwa: pentan-2-ol
Rzędowość: II rzędowy
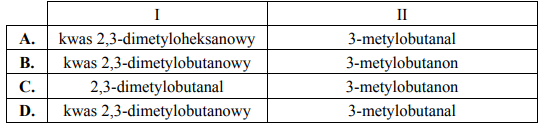
Zadanie 188. (NR15)
Poniżej przedstawiono wzory dwóch związków organicznych.
Zaznacz odpowiedź, w której podano poprawne nazwy systematyczne związków I i II.
Z podanych niżej informacji wybierz i zaznacz te, które są prawdziwe dla związku II.
- W wyniku redukcji tego związku wodorem powstaje 3-metylobutan-2-ol.
- Po dodaniu tego związku do świeżo strąconego wodorotlenku miedzi(II) i ogrzaniu obserwuje się zmianę zabarwienia zawartości probówki z niebieskiej na ceglastą.
- Związek ten powstaje w wyniku utleniania alkoholu II-rzędowego.
- Związek ten reaguje bezpośrednio z sodem, w wyniku czego tworzy sól.
B
Zdanie 1 i 3.
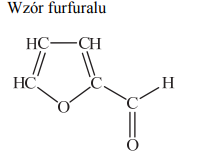
Zadanie 189. (NR15)
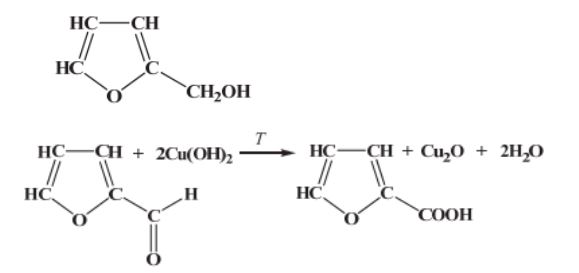
Furfural jest pochodną furanu. W cząsteczce furfuralu występuje grupa funkcyjna, która łatwo redukuje się w obecności wodoru, co prowadzi do powstania alkoholu furfurylowego. Na gorąco, pod wpływem wodorotlenku miedzi(II), grupa ta się utlenia, w wyniku czego powstaje kwas pirośluzowy.
Narysuj wzór półstrukturalny (grupowy) lub uproszczony alkoholu furfurylowego, otrzymanego na drodze redukcji furfuralu.
Uzupełnij poniższy schemat, tak aby otrzymać równanie opisanej reakcji otrzymywania kwasu pirośluzowego. Zastosuj wzory półstrukturalne (grupowe) lub uproszczone związków organicznych.
Zadanie 190. (NR15)
Moc kwasów można porównać na podstawie analizy ich stałych dysocjacji albo metodą doświadczalną. Stała dysocjacji kwasu pirogronowego jest równa Ka = 4,1·10 −3 w t = 25 °C.
Na podstawie: J. Sawicka i inni, Tablice chemiczne, Gdańsk 2004.
Porównaj wartości stałych dysocjacji kwasu pirogronowego i kwasu etanowego, a następnie zaprojektuj doświadczenie, w którym zajdzie reakcja potwierdzająca, że jeden z nich jest mocniejszy.
Uzupełnij poniższy schemat doświadczenia, wpisując wzory użytych odczynników wybranych spośród:
– CH3COCOOH (aq)
– CH3COCOONa (aq)
– CH3COOH (aq)
– CH3COONa (aq)
– NaOH (aq)
Opisz zmiany, które potwierdzają, że wybrany kwas jest mocniejszy od drugiego.
Zadanie 191. (NR15)
W dwóch nieoznakowanych probówkach znajdują się parafina i stearyna. Zaznacz poprawne dokończenie zdania. W celu zidentyfikowania tych substancji należy
- porównać ich rozpuszczalność w wodzie.
- zbadać ich zachowanie wobec wody bromowej.
- zbadać ich zachowanie wobec wodorotlenku sodu.
- zbadać ich zachowanie wobec stężonego kwasu azotowego(V).
Zadanie 192. (NR15)
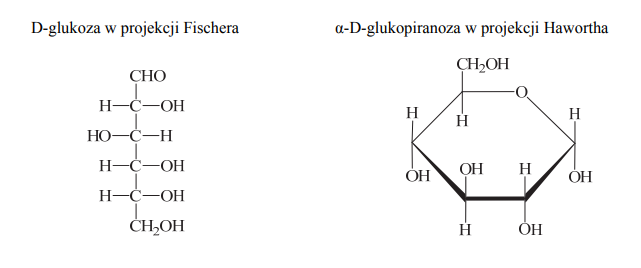
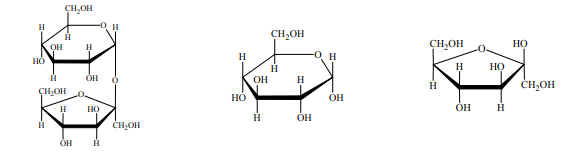
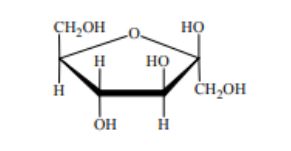
Wzory monosacharydów można przedstawiać, posługując się projekcją Fischera (wzory liniowe) lub projekcją Hawortha (wzory taflowe). Poniżej przedstawiono wzór D-glukozy w projekcji Fischera oraz wzór α-D-glukopiranozy w projekcji Hawortha.
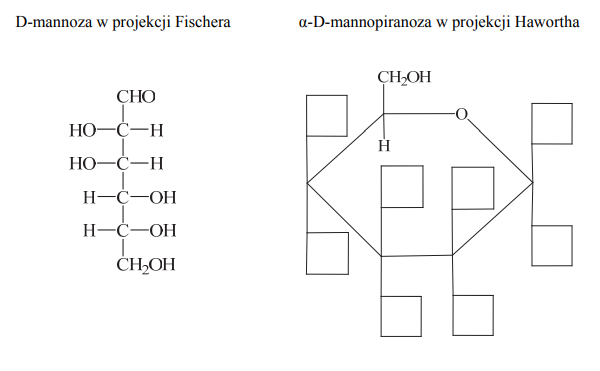
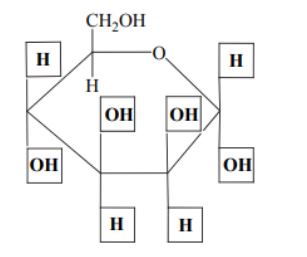
Przeanalizuj wzór D-mannozy w projekcji Fischera i uzupełnij schemat, tak aby przedstawiał on wzór α-D-mannopiranozy w projekcji Hawortha.
Zadanie 193. (NR15)
Liczba jodowa jest miarą liczby wiązań nienasyconych, np. w tłuszczach. Określa ona liczbę gramów jodu, który może przyłączyć w warunkach standardowych 100 gramów tłuszczu. Poniżej podano wzory trzech tłuszczów.
Uszereguj tłuszcze o podanych wzorach zgodnie ze wzrastającą liczbą jodową − zapisz w kolejności numery, którymi je oznaczono.
III, II, I.
Zadanie 194. (NR15)
W czterech naczyniach (I–IV) znajdowały się wodne roztwory: glukozy, fenolu (benzenolu), glicerolu (propano-1,2,3-triolu) i glicyloalanyloglicyny. W celu ich identyfikacji przeprowadzono trzy serie doświadczeń. W pierwszej serii doświadczeń, po dodaniu wodnego roztworu chlorku żelaza(III) do próbek pobranych z czterech naczyń, próbka z naczynia I przyjęła fioletowe zabarwienie. W drugiej serii doświadczeń, po dodaniu świeżo strąconego wodorotlenku miedzi(II) do próbek pobranych z trzech naczyń (II, III i IV), próbka z naczynia II przyjęła fioletowe zabarwienie, a w pozostałych próbkach pojawiło się szafirowe zabarwienie. W trzeciej serii doświadczeń, po ogrzaniu szafirowych roztworów otrzymanych w serii drugiej, w roztworze powstałym z próbki z naczynia III pojawił się ceglasty osad.
Podaj nazwy związków, które zidentyfikowano w wyniku każdej z serii doświadczeń.
Podaj nazwę reakcji chemicznej przeprowadzonej w drugiej serii doświadczeń, w wyniku której roztwór z naczynia II przyjął fioletowe zabarwienie.
Napisz, jaki element budowy cząsteczek związków znajdujących się w roztworach z naczyń III i IV zadecydował o powstaniu szafirowego zabarwienia roztworów w drugiej serii doświadczeń.
Wyjaśnij, dlaczego w trzeciej serii doświadczeń ceglasty osad powstał w wyniku ogrzania roztworu otrzymanego po dodaniu świeżo strąconego wodorotlenku miedzi(II) do roztworu z naczynia III, a nie powstał w wyniku ogrzania roztworu otrzymanego po dodaniu świeżo strąconego wodorotlenku miedzi(II) do roztworu z naczynia IV.
Seria I (naczynie I): roztwór fenolu lub benzenolu
Seria II (naczynie II): roztwór glicyloalanyloglicyny
Seria III (naczynie III): roztwór glukozy
(naczynie IV): roztwór glicerolu lub propano-1,2,3-triolu
Reakcja biuretowa lub reakcja Piotrowskiego.
Obecność grup hydroksylowych – wicynalnych lub położonych przy sąsiednich atomach węgla – w cząsteczkach glicerolu i glukozy.
Glukoza ma właściwości redukujące, a glicerol nie ma właściwości redukujących.
W cząsteczce glukozy znajduje się grupa aldehydowa, a w cząsteczce glicerolu nie ma grupy aldehydowej.
Zadanie 195. (NR15)
Pewien tripeptyd tworzą tylko reszty glicyny (Gly) i alaniny (Ala). W doświadczeniu I tripeptyd ten poddano częściowej hydrolizie polegającej na rozerwaniu wyłącznie N-końcowego wiązania peptydowego. Otrzymano mieszaninę dwóch optycznie czynnych produktów. W doświadczeniu II przeprowadzono hydrolizę badanego tripeptydu, tak że rozerwaniu uległo wyłącznie C-końcowe wiązanie peptydowe. W jej wyniku otrzymano mieszaninę produktów, spośród których tylko jeden był optycznie czynny.
Napisz wzór sekwencji badanego tripeptydu, posługując się trzyliterowymi symbolami aminokwasów. Pamiętaj, że w tej notacji z lewej strony umieszcza się symbol aminokwasu, który zawiera wolną grupę aminową.
Ala-Ala-Gly
Zadanie 196. (NR16)
Do określania położenia podwójnego wiązania w cząsteczkach alkenów wykorzystuje się ich utlenianie, np. za pomocą roztworu KMnO4 w środowisku kwasowym i w podwyższonej temperaturze. W tych warunkach dochodzi do rozerwania wiązania podwójnego węgiel – węgiel. W zależności od budowy cząsteczki alkenu mogą powstać kwasy karboksylowe, ketony lub tlenek węgla(IV).
Izomeryczne alkeny A i B utleniano KMnO4 w środowisku kwasowym. W wyniku przemiany, której uległ alken A, otrzymano jeden organiczny produkt, natomiast w wyniku utleniania alkenu B powstały dwa związki należące do różnych grup związków organicznych. W reakcji 1 mola alkenu B z 1 molem wodoru powstaje 2-metylopentan. Alken A występuje w postaci izomerów geometrycznych cis–trans.
Napisz wzory półstrukturalne (grupowe) alkenów A i B. Wyjaśnij, dlaczego alken B nie występuje w postaci izomerów geometrycznych cis–trans.
Podaj nazwy wszystkich związków organicznych, które powstały w wyniku utleniania alkenów A i B.
A: CH3CH2CH=CHCH2CH3
B: (CH3)2C=CHCH2CH3
Ponieważ przy jednym z atomów węgla połączonych wiązaniem podwójnym są dwa identyczne podstawniki (dwie grupy alkilowe).
Kwas propanowy lub kwas propionowy oraz propanon lub aceton lub keton dimetylowy.
Zadanie 197. (NR16)
Woda przyłącza się do alkenów w obecności silnie kwasowego katalizatora H3O+. Addycja ta przebiega poprzez tworzenie kationów z ładunkiem dodatnim zlokalizowanym na atomie węgla, czyli tzw. karbokationów. Mechanizm tej reakcji dla alkenów o wzorze ogólnym R–CH=CH2 (R – grupa alkilowa) można przedstawić w trzech etapach. Uwaga: w poniższych równaniach etapów reakcji wzór wody przedstawiono jako :OH2, a wzór kwasowego katalizatora zapisano jako H:OH+2.
Uzupełnij poniższe zdania. Wybierz i zaznacz jedno właściwe określenie spośród podanych w każdym nawiasie. Podczas etapu I alken ulega działaniu reagenta (wolnorodnikowego / nukleofilowego / elektrofilowego). W etapie II karbokation łączy się z cząsteczką wody, w wyniku czego powstaje protonowany alkohol. Na tym etapie przemiany woda działa jako (nukleofil / elektrofil). Podczas etapu III protonowany alkohol (oddaje / pobiera) proton, co prowadzi do powstania obojętnego alkoholu oraz do odtworzenia katalizatora.
Spośród alkoholi o podanych niżej wzorach wybierz te, których nie można (jako produktu głównego) otrzymać podczas hydratacji alkenów prowadzonej w obecności kwasu. Podkreśl wzory wybranych alkoholi i uzasadnij swój wybór.
CH3CH2OH CH3CH(OH)CH3 CH3CH2CH2OH CH3CH2CH(OH)CH3 CH3CH2CH2CH2OH
Podczas etapu I alken ulega działaniu reagenta (wolnorodnikowego / nukleofilowego / elektrofilowego). W etapie II karbokation łączy się z cząsteczką wody, w wyniku czego powstaje protonowany alkohol. Na tym etapie przemiany woda działa jako (nukleofil / elektrofil). Podczas etapu III protonowany alkohol (oddaje / pobiera) proton, co prowadzi do powstania obojętnego alkoholu oraz odtworzenie katalizatora.
CH3CH2CH2OH
CH3CH2CH2CH2OH
Zadanie 198. (NR16)
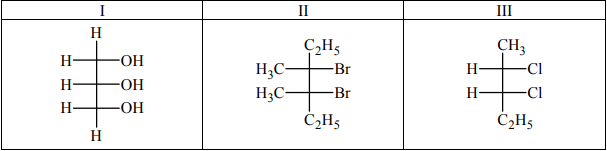
Poniżej przedstawiono wzory stereochemiczne Fischera trzech związków organicznych. Dwa z nich nie są optycznie czynne – ich cząsteczki nie są chiralne.
Spośród podanych wzorów związków chemicznych wybierz wzory tych, które nie są optycznie czynne. Wpisz do poniższej tabeli numery, którymi oznaczono te związki, i w każdym przypadku uzasadnij swój wybór.
Zadanie 199. (NR16)
Przeprowadzono ciąg przemian opisany poniższym schematem.
Napisz równanie reakcji prowadzącej do otrzymania produktu A. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
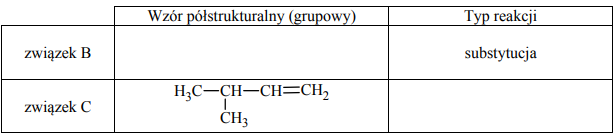
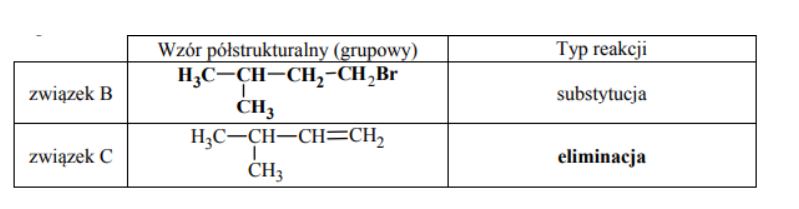
Uzupełnij poniższą tabelę. Podaj wzór półstrukturalny (grupowy) związku organicznego oznaczonego na schemacie literą B. Określ typ reakcji (addycja, eliminacja, substytucja), w wyniku której powstaje związek C.
Zadanie 200. (NR16)
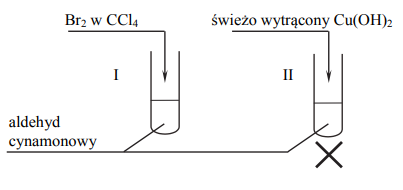
Aldehyd cynamonowy to związek o wzorze:
Aldehyd ten występuje w przyrodzie w konfiguracji trans.
Napisz wzór izomeru trans aldehydu cynamonowego.
W celu zbadania właściwości aldehydu cynamonowego wykonano eksperyment, którego przebieg zilustrowano na rysunku.
Porównaj przebieg reakcji w obu probówkach. Dokończ poniższe zdania – wybierz i podkreśl właściwe opisy spostrzeżeń spośród podanych w nawiasach.
- Po dodaniu odczynnika do probówki I zaobserwowano, że roztwór bromu (uległ odbarwieniu / zabarwił się na fioletowo / nie zmienił zabarwienia).
- W probówce II w wyniku ogrzewania zawiesiny wodorotlenku miedzi(II) z aldehydem cynamonowym powstał (szafirowy roztwór / ceglasty osad / różowy roztwór).
Zadanie 201. (NR16)
Kwas 2-hydroksypropanowy w reakcji ze związkiem X tworzy ester o wzorze sumarycznym C5H8O4. Orbitalom walencyjnym każdego z atomów węgla budujących cząsteczkę związku X przypisuje się inny typ hybrydyzacji. Ponadto wiadomo, że w cząsteczce związku X występuje tylko jedna grupa funkcyjna. Ustal wzór związku X, którego użyto do estryfikacji kwasu 2-hydroksypropanowego, i napisz równanie reakcji otrzymywania opisanego estru. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
Zadanie 202. (NR16)
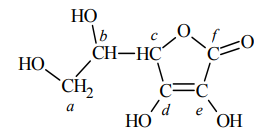
W cząsteczce kwasu askorbinowego (witaminy C) występują dwa enolowe atomy węgla, czyli atomy węgla o hybrydyzacji sp2 z przyłączonymi grupami hydroksylowymi. Cząsteczka tego związku zawiera ponadto dwa asymetryczne atomy węgla – o hybrydyzacji sp3 z przyłączonymi czterema różnymi podstawnikami. Poniżej przedstawiono wzór witaminy C, w którym małymi literami oznaczono poszczególne atomy węgla.
Napisz litery (a–f), którymi oznaczono w powyższym wzorze kwasu askorbinowego wszystkie enolowe atomy węgla oraz wszystkie asymetryczne atomy węgla.
Określ formalne stopnie utlenienia atomów węgla oznaczonych w podanym wzorze kwasu askorbinowego literami a, b i f. Uzupełnij poniższą tabelę.
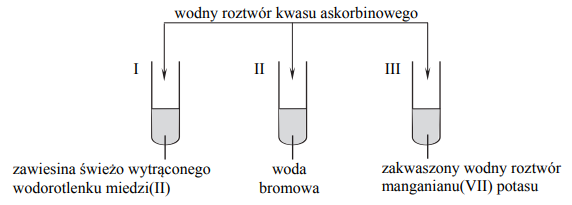
W celu zbadania właściwości kwasu askorbinowego przeprowadzono doświadczenie, którego przebieg zilustrowano na poniższym rysunku.
Przed dodaniem wodnego roztworu kwasu askorbinowego zawartość każdej probówki była barwna. Napisz numery probówek, w których po dodaniu roztworu kwasu askorbinowego zaobserwowano odbarwianie się ich zawartości.
Enolowe atomy węgla: d, e
Asymetryczne atomy węgla: b, c
Stopnie utlenienia: a (-1), b 0, f (+3)
Numery probówek, w których po dodaniu roztworu kwasu askorbinowego zaobserwowano odbarwianie się ich zawartości: II, III
Zadanie 203. (NR16)
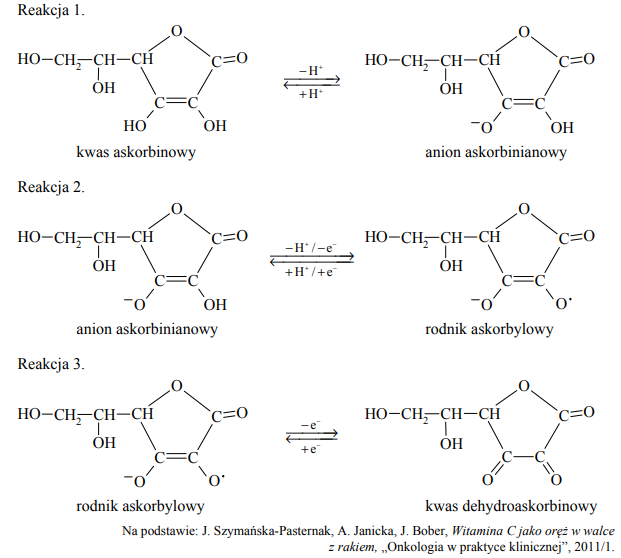
Kwas askorbinowy ulega przemianie w kwas dehydroaskorbinowy zgodnie z poniższym schematem. Odszczepienie jednego protonu od cząsteczki witaminy C prowadzi do powstania anionu askorbinianowego (reakcja 1.). W wyniku oddania przez anion askorbinianowy elektronu i drugiego protonu powstaje rodnik askorbylowy (reakcja 2.). Wskutek utraty elektronu przez rodnik askorbylowy tworzy się kwas dehydroaskorbinowy (reakcja 3.).
Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.
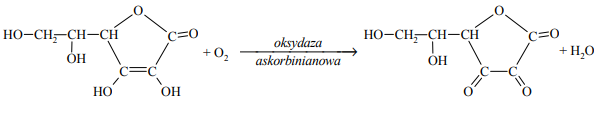
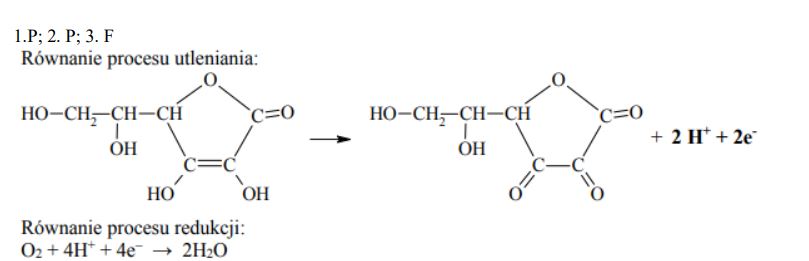
Poniżej przedstawiono schemat reakcji utleniania witaminy C tlenem z powietrza. Reakcja ta jest katalizowana przez enzym o nazwie oksydaza askorbinianowa.
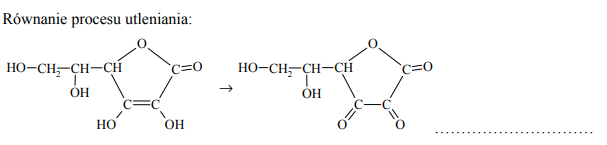
Napisz równanie procesu utleniania (uzupełnij schemat) i równanie procesu redukcji zachodzących podczas opisanej przemiany. Oba równania przedstaw w formie jonowej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo- -elektronowy).
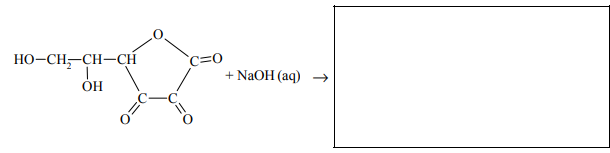
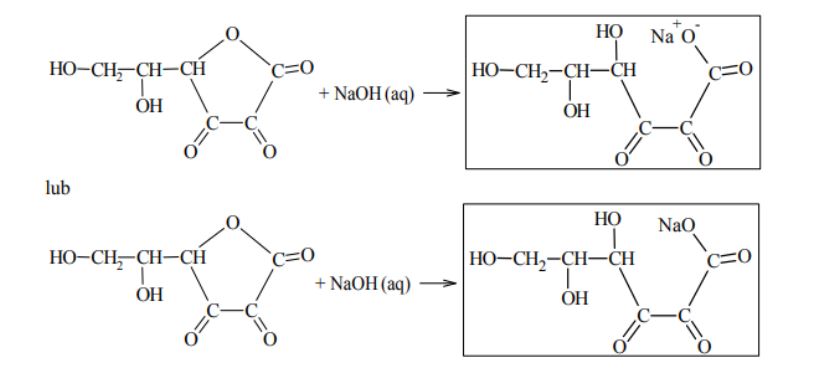
Roztwór wodny kwasu dehydroaskorbinowego ma odczyn obojętny. Kwas ten ulega jednak działaniu wodnych roztworów wodorotlenków metali, w wyniku czego tworzą się sole. W tej reakcji rozerwaniu ulega wiązanie estrowe, co prowadzi do otwarcia pierścienia cząsteczki. Uzupełnij podany niżej schemat opisanej reakcji – wpisz wzór półstrukturalny (grupowy) jej organicznego produktu.
Zadanie 204. (NR16)
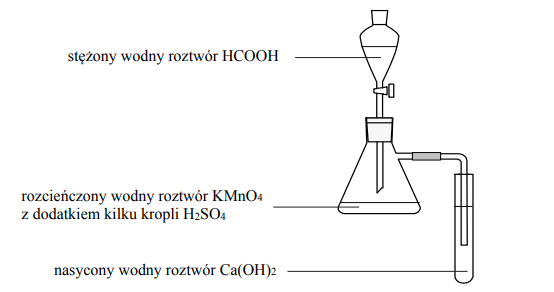
Mocznik jest diamidem kwasu węglowego. Ogrzewany z roztworami mocnych kwasów i z zasadami, ulega przemianom zilustrowanym poniższymi równaniami:
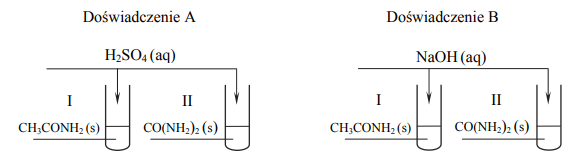
W celu porównania właściwości acetamidu i mocznika przeprowadzono dwa doświadczenia A i B zilustrowane na schemacie.
Po zmieszaniu reagentów zawartość każdej probówki ogrzano. Stwierdzono, że we wszystkich probówkach przebiegły reakcje chemiczne.
Napisz w formie jonowej skróconej równanie reakcji zachodzącej podczas ogrzewania acetamidu
- w wodnym roztworze kwasu siarkowego(VI) (doświadczenie A, probówka I)
- w wodnym roztworze wodorotlenku sodu (doświadczenie B, probówka I).
Oceń, które z przeprowadzonych doświadczeń (A czy B) można wykorzystać w celu odróżnienia acetamidu od mocznika, i uzasadnij swoje stanowisko. W uzasadnieniu odwołaj się do zmian możliwych do zaobserwowania w probówkach I i II (w wybranym doświadczeniu) i pozwalających na odróżnienie acetamidu od mocznika.
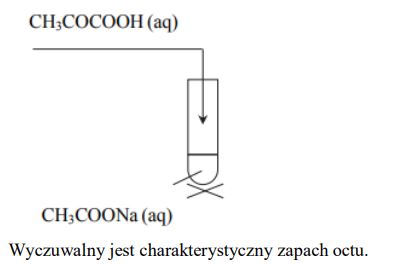
Doświadczenie A: Probówka I: CH3CONH2 + H2O + H+ → CH3COOH + NH4+ Doświadczenie B: Probówka I: CH3CONH2 + OH − → CH3COO − + NH3
W celu odróżnienia acetamidu od mocznika należy przeprowadzić doświadczenie A. Uzasadnienie: Probówka I – Wyczuwa się charakterystyczny zapach octu. Probówka II -Nie wyczuwa się charakterystycznego zapachu lub Wydziela się bezwonny gaz.
albo
Probówka I -Nie wydziela się gaz. Probówka II – Wydziela się gaz.
Zadanie 205. (NR16)
Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.|
1.P 2.F 3.P
Zadanie 206. (NR16)
Jednym z naturalnie występujących tripeptydów jest związek o poniższym wzorze.
Napisz wzór sekwencji przedstawionego tripeptydu, posługując się trzyliterowymi kodami aminokwasów. Pamiętaj, że w tej notacji z lewej strony umieszcza się kod aminokwasu, którego reszta zawiera wolną grupę aminową połączoną z atomem węgla α.
Gly-His-Lys
Zadanie 207. (NR17)
Zależność między mocą kwasu Brønsteda a mocą zasady sprzężonej z tym kwasem opisuje równanie: Ka · Kb = Kw gdzie: Ka – stała dysocjacji kwasu, Kb – stała dysocjacji sprzężonej zasady, a Kw – iloczyn jonowy wody.
Dane są kwasy karboksylowe o wzorach:
I CH3COOH II CH3CH2COOH III C6H5COOH
Uzupełnij poniższe zdania. Wpisz w wyznaczone miejsca odpowiednie wzory i podkreśl właściwe określenie spośród wymienionych w nawiasie. Spośród związków oznaczonych numerami I, II i III najmocniejszym kwasem jest ……………………………. . Spośród zasad sprzężonych z kwasami I, II i III najsłabszą zasadą jest ……………………………. . W sprzężonej parze kwas–zasada im słabszy jest kwas, tym (mocniejsza / słabsza) jest sprzężona z nim zasada.
Spośród związków oznaczonych numerami I, II i III najmocniejszym kwasem jest C6H5COOH. Spośród zasad sprzężonych z kwasami I, II i III najsłabszą zasadą jest C6H5COO− . W sprzężonej parze kwas–zasada im słabszy jest kwas, tym mocniejsza jest sprzężona z nim zasada.
Zadanie 208. (NR17)
Poniżej podano ciąg przemian chemicznych:
gdzie R – grupa alkilowa
Halogenowanie alkanów (przemiana oznaczona na schemacie numerem 1) w obecności światła przebiega przez następujące etapy:
Szybkość tworzenia się halogenku alkilu zależy od szybkości, z jaką powstaje rodnik alkilowy. Podkreśl numer najwolniejszego etapu reakcji oznaczonej na schemacie numerem
Etap I Etap II Etap III
Określ typ reakcji (addycja, eliminacja, substytucja) oraz mechanizm (elektrofilowy, nukleofilowy, rodnikowy) reakcji oznaczonych na schemacie numerami 1 i 2.
Przeprowadzono doświadczenie, podczas którego przebiegła reakcja oznaczona na schemacie numerem 3. Uzupełnij tabelę – wpisz barwy mieszaniny reakcyjnej przed reakcją i po reakcji, jakie można było zaobserwować w czasie
Zadanie 209. (NR17)
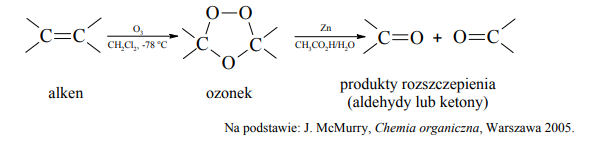
Ozon, odczynnik utleniający, ma zdolność rozszczepiania wiązania podwójnego. W niskiej temperaturze ozon szybko przyłącza się do wiązań podwójnych, w wyniku czego daje cykliczne produkty pośrednie, które ulegają przegrupowaniu do ozonków. Ostatecznym efektem reakcji ozonolizy jest rozszczepienie wiązania podwójnego. Każdy z dwóch atomów węgla, pierwotnie związanych wiązaniem podwójnym, w produktach rozszczepienia jest połączony podwójnym wiązaniem z atomem tlenu.
Poniżej przedstawiono wzór półstrukturalny (grupowy) węglowodoru, który poddano ozonolizie
Podaj nazwy systematyczne końcowych produktów reakcji ozonolizy, której poddano ten węglowodór.
Pewien związek organiczny ma następujący wzór półstrukturalny (grupowy):
Spośród podanych poniżej wzorów węglowodorów I–III wybierz wzór związku, który – poddany ozonolizie – utworzył tylko jeden produkt przedstawiony powyższym wzorem. Podaj numer, którym oznaczono wzór wybranego związku. Następnie napisz wzór półstrukturalny (grupowy) węglowodoru, który – poddany ozonolizie – utworzył tylko jeden produkt końcowy o nazwie etanal.
Butanon i pentanal
Numer, którym oznaczono wzór wybranego związku: III
Wzór węglowodoru, który poddany ozonolizie utworzył etanal jako jedyny produkt: CH3CH=CHCH3
Zadanie 210. (NR17)
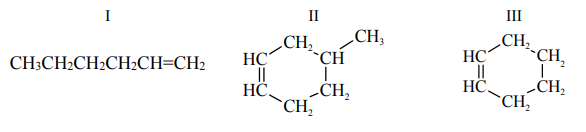
Spośród izomerycznych alkenów o wzorze sumarycznym C6H12 tylko alkeny A i B utworzyły w reakcji z HCl (jako produkt główny) halogenek alkilowy o wzorze:
O tych alkenach wiadomo także, że alken A występuje w postaci izomerów geometrycznych cis–trans, a alken B – nie. Napisz wzory półstrukturalne (grupowe) alkenów A i B. Wyjaśnij, dlaczego alken B nie występuje w postaci izomerów geometrycznych cis–trans.
Wzór alkenu A CH3CH=C(CH3)CH2CH3
Wzór alkenu B CH2=C(CH2CH3)2
-Przy każdym z atomów o hybrydyzacji sp2 są dwa identyczne podstawniki.
-Ponieważ przy jednym z atomów węgla połączonych wiązaniem podwójnym są dwa identyczne podstawniki (dwie identyczne grupy alkilowe).
-Ponieważ przy jednym z atomów węgla połączonych wiązaniem podwójnym są dwa identyczne podstawniki (dwa atomy wodoru).
Zadanie 211. (NR17)
Alkiny o wzorze ogólnym R−C≡CH (tzw. alkiny terminalne) reagują z amidkiem sodu (NaNH2), w wyniku czego tworzą acetylenki sodu (R−C≡CNa) zgodnie z równaniem:
Jeden z izomerycznych alkinów o wzorze sumarycznym C4H6, który umownie nazwano związkiem I, reaguje z amidkiem sodu. Drugi z izomerycznych alkinów, który umownie nazwano związkiem II, takiej reakcji nie ulega. Uzupełnij poniższą tabelę. Napisz wzór półstrukturalny (grupowy) substancji, która jest organicznym produktem reakcji związku I z amidkiem sodu, oraz wzór półstrukturalny (grupowy) związku II.
Wzór organicznego produktu reakcji związku I z amidkiem sodu CH3−CH2−C≡C–Na+ lub CH3−CH2−C≡CNa
Wzór związku II CH3−C≡C−CH3
Zadanie 212. (NR17)
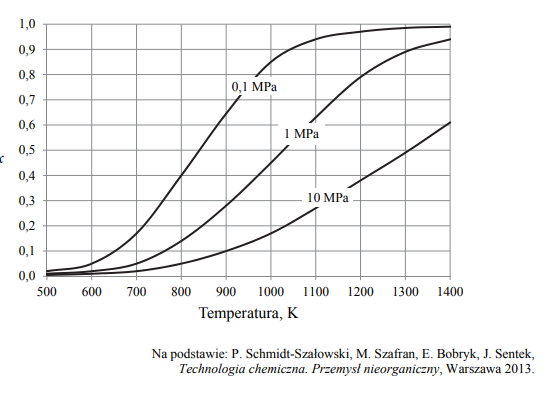
W wysokiej temperaturze może zachodzić rozkład metanu na substancje proste zgodnie z
równaniem:
Miarą wydajności tej reakcji jest równowagowy stopień przemiany metanu x, który wyraża się wzorem:
W tym wzorze n0[CH4 ] oznacza początkową liczbę moli metanu, a n[CH4] – liczbę moli tego gazu pozostałego po ustaleniu się stanu równowagi. Poniżej przedstawiono zależność równowagowego stopnia przemiany metanu x od temperatury dla trzech wartości ciśnienia.
Określ, czy ΔH opisanej reakcji rozkładu metanu jest większa od zera, czy – mniejsza od zera. Odpowiedź uzasadnij.
Wyjaśnij, dlaczego wydajność opisanej reakcji maleje ze wzrostem ciśnienia.
Dla reakcji rozkładu metanu ΔH > 0, ponieważ wydajność tej reakcji wzrasta ze wzrostem temperatury.
ΔH tej reakcji jest większa od zera, ponieważ im wyższa jest temperatura, tym równowagowy stopień przemiany jest większy.
Wydajność opisanej reakcji maleje ze wzrostem ciśnienia:
Ponieważ liczba moli gazowego substratu jest mniejsza od liczby moli gazowego produktu – zgodnie z regułą przekory im niższe ciśnienie, tym więcej moli gazowych produktów powstaje.
Ponieważ objętość produktów jest większa od objętości substratu.
Zadanie 213. (NR17)
Oznaczanie zawartości fenolu w ściekach przemysłowych możne przebiegać w kilku etapach opisanych poniżej.
Etap I: Otrzymywanie bromu.
Etap II: Bromowanie fenolu.
Etap III: Wydzielanie jodu.
Etap IV: Miareczkowanie jodu.
Podczas etapu I (oznaczania zawartości fenolu) zachodzi reakcja jonów bromkowych z jonami bromianowymi(V) – BrO3– w roztworze o odczynie kwasowym. Produktami tej przemiany są brom i woda. Napisz w formie jonowej, z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy), równanie reakcji redukcji i równanie reakcji utleniania zachodzących podczas opisanego procesu (etapu I). Uwzględnij środowisko reakcji.
Uzupełnij poniższe zdania. Wybierz i zaznacz jedno określenie spośród podanych w każdym nawiasie. Fenol, który jest pochodną benzenu zawierającą grupę hydroksylową związaną z pierścieniem, ulega podczas etapu II oznaczania reakcji substytucji (elektrofilowej / nukleofilowej / rodnikowej). Bromowanie benzenu wymaga użycia katalizatora, natomiast reakcja fenolu z bromem przebiega łatwo już w temperaturze pokojowej. Można więc wnioskować, że grupa hydroksylowa związana z pierścieniem benzenowym (ułatwia / utrudnia) podstawienie atomów (bromu / wodoru) atomami (bromu / wodoru).
Zadanie 214. (NR17)
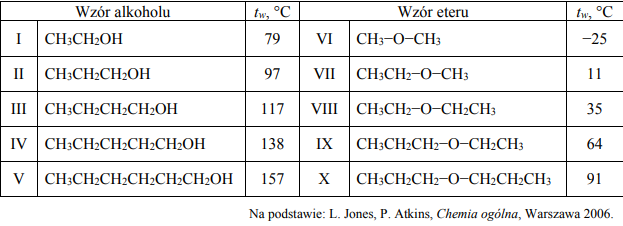
Etery są związkami o wzorze R−O−R’, przy czym R i R’ mogą być zarówno grupami alkilowymi, jak i arylowymi. W poniższej tabeli zestawiono wartości temperatury wrzenia tw (pod ciśnieniem 1013 hPa) wybranych alkoholi oraz wybranych eterów o nierozgałęzionych cząsteczkach.
Czy alkohole i etery o tej samej liczbie atomów węgla w cząsteczce są izomerami? Uzasadnij swoją odpowiedź. Odnieś się do związków, których wzory wymieniono w tabeli.
Spośród związków o wzorach podanych w tabeli wybierz substancję najmniej lotną i substancję najbardziej lotną. Napisz numery, którymi oznaczono wzory wybranych związków. Następnie wyjaśnij, dlaczego etery są bardziej lotne niż alkohole o tej samej masie cząsteczkowej. Odnieś się do budowy cząsteczek związków, których wzory wymieniono w tabeli.
Alkohole i etery o tej samej liczbie atomów węgla w cząsteczce są izomerami, ponieważ związki te mają ten sam wzór sumaryczny.
Numer związku najmniej lotnego: V
Numer związku najbardziej lotnego: VI
Ponieważ między cząsteczkami alkoholi tworzą się wiązania wodorowe (O−H···O). Pomiędzy cząsteczkami eterów nie tworzą się takie wiązania, ponieważ etery nie zawierają atomu wodoru związanego z atomem tlenu.
Zadanie 215. (NR17)
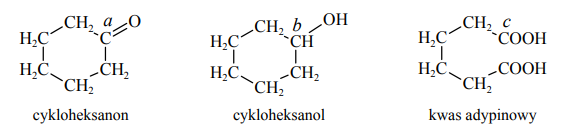
Poniżej przedstawiono wzory: cykloheksanonu, cykloheksanolu i kwasu adypinowego. Literami a, b i c oznaczono wybrane atomy węgla.
Określ formalne stopnie utlenienia oraz typ hybrydyzacji (sp, sp2 , sp3) atomów węgla oznaczonych w podanych wzorach literami a, b i c.
a II sp2
b 0 sp3
c III sp2
Zadanie 216. (NR17)
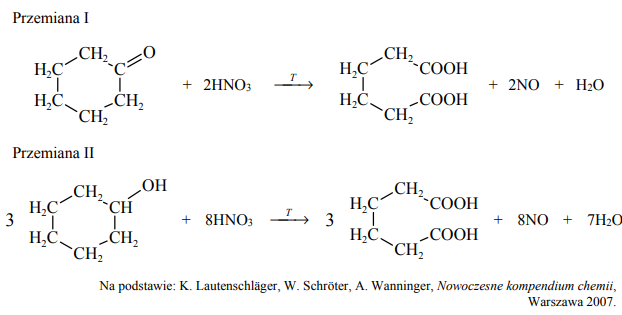
Kwas adypinowy jest ważnym surowcem w produkcji tworzyw sztucznych. Na skalę techniczną otrzymuje się go przez utlenianie mieszaniny cykloheksanonu oraz cykloheksanolu. Poniżej przedstawiono równania tych przemian.
Podaj liczbę moli elektronów oddawanych przez 1 mol cykloheksanonu i 1 mol cykloheksanolu podczas opisanych przemian.
Przemiana I: 6 (moli elektronów) Przemiana II: 8 (moli elektronów)
Zadanie 217. (NR17)
Przeprowadzono doświadczenie, którego przebieg przedstawiono na poniższym schemacie.
Po delikatnym ogrzaniu kolby z mieszaniną reakcyjną zaobserwowano odbarwianie roztworu w kolbie oraz powstanie białego osadu w probówce. Uzupełnij poniższy zapis, tak aby przedstawiał on w formie jonowej skróconej równanie reakcji, która zaszła w kolbie podczas przeprowadzonego doświadczenia. Oceń, czy gdyby do opisanego doświadczenia użyto kwasu etanowego zamiast kwasu metanowego, również zaobserwowano by odbarwienie roztworu w kolbie oraz powstanie osadu w probówce. Uzasadnij swoje stanowisko.
Zadanie 219. (NR17)
Wykonano doświadczenie, w którym do dwóch probówek z tym samym odczynnikiem wprowadzono wodne roztwory dwóch związków chemicznych. Do probówki I wprowadzono wodny roztwór winianu disodu (NaOOC–CH(OH)–CH(OH)–COONa), a do probówki II – wodny roztwór etanianu (octanu) sodu (CH3COONa). W warunkach doświadczenia obydwa wodne roztwory były bezbarwnymi cieczami. Zaprojektuj doświadczenie, którego przebieg pozwoli na potwierdzenie, że roztwór winianu disodu wprowadzono do probówki I, a roztwór octanu sodu – do probówki II.
Uzupełnij schemat doświadczenia. Podkreśl nazwę odczynnika, który – po dodaniu do niego roztworów opisanych związków i wymieszaniu zawartości probówek – umożliwi zaobserwowanie różnic w przebiegu doświadczenia z udziałem winianu disodu i octanu sodu.
Opisz zmiany możliwe do zaobserwowania w czasie doświadczenia, pozwalające na potwierdzenie, że do probówki I wprowadzono roztwór winianu disodu, a do probówki II – roztwór octanu sodu.
Zawiesina świeżo wytrąconego wodorotlenek miedzi(II).
Probówka I: (Niebieski) osad roztworzył się. lub Powstał (szafirowy) roztwór. lub Pojawiło się szafirowe zabarwienie.
Probówka II: Brak zmian zawartości probówki.
Zadanie 220. (NR17)
W trzech probówkach (I, II i III) znajdowały się wodne roztwory:
mocznika (CO(NH2)2), chlorku amonu (NH4Cl) i acetamidu (CH3CONH2).
W celu ich identyfikacji przeprowadzono dwie serie doświadczeń. W pierwszej serii doświadczeń do każdej probówki zanurzono żółty uniwersalny papierek wskaźnikowy. Zmianę barwy wskaźnika zaobserwowano tylko w probówce III. W drugiej serii doświadczeń do probówek I i II dodano wodny roztwór wodorotlenku sodu i ogrzano zawartości obu naczyń. U wylotu obu probówek wyczuwalny był ten sam charakterystyczny zapach. Następnie do probówek I i II dodano wodny roztwór azotanu(V) baru. Pojawienie się białego osadu zaobserwowano tylko w probówce I.
Podaj nazwy związków, które zidentyfikowano podczas przeprowadzonych doświadczeń.
Określ odczyn roztworu znajdującego się w probówce III i napisz w formie jonowej skróconej równanie reakcji, które potwierdzi wskazany odczyn.
Napisz wzór substancji, której charakterystyczny zapach był wyczuwalny u wylotu probówek I i II, oraz napisz w formie jonowej skróconej równanie reakcji, w wyniku której w probówce I powstał biały osad.
Zadanie 221. (NR17)
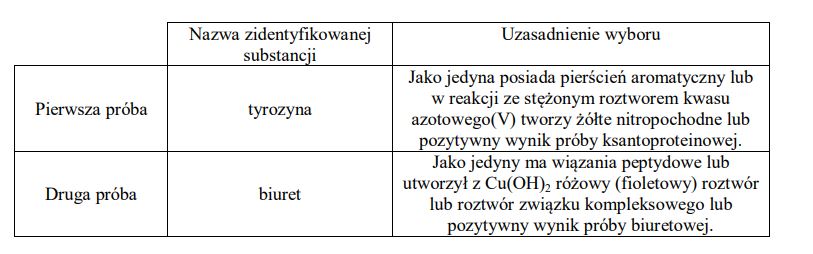
W czterech nieopisanych naczyniach znajdują się oddzielnie: tyrozyna (Tyr), glicyna (Gly), biuret (H2N-CO-NH-CO-NH2) i alanina (Ala). Przeprowadzono doświadczenie, podczas którego wykonano dwie próby. Podczas pierwszej próby na czterech szkiełkach zegarkowych umieszczono niewielkie ilości wymienionych substancji i na każdą naniesiono kilka kropli stężonego wodnego roztworu kwasu azotowego(V). Wynik próby pozwolił na identyfikację jednej substancji. Podczas drugiej próby sporządzono wodne roztwory trzech pozostałych substancji i do każdego roztworu dodano świeżo wytrącony wodorotlenek miedzi(II). Wynik próby pozwolił na identyfikację drugiej substancji. Uzupełnij poniższą tabelę. Podaj nazwę substancji, która została zidentyfikowana po przeprowadzeniu pierwszej próby, oraz nazwę substancji, która została zidentyfikowana po przeprowadzeniu drugiej próby. W każdym przypadku uzasadnij wybór substancji.
Zadanie 222. (NR17)
Do zakwaszonego roztworu alaniny dodawano kroplami wodny roztwór wodorotlenku sodu i mierzono pH mieszaniny reakcyjnej. Na poniższym wykresie zilustrowano zależność pH mieszaniny od objętości dodanego roztworu wodorotlenku sodu (w jednostkach umownych).
Aminokwasy istnieją głównie w formie jonów. W roztworach o niskim pH cząsteczka aminokwasu jest protonowana. W roztworach o wysokim pH aminokwas traci proton. Istnieje także pH, przy którym aminokwas występuje jako jon obojnaczy.
Podczas opisanego miareczkowania przebiegły reakcje chemiczne zilustrowane schematem:
Napisz równania reakcji oznaczonych na schemacie numerami 1 i 2. Zastosuj wzory półstrukturalne (grupowe) form alaniny.
Zadanie 223. (NR17)
Wodny roztwór pewnego cukru zmieszany w środowisku wodorowęglanu sodu (NaHCO3) z wodą bromową nie powoduje jej odbarwienia. Ponadto ten cukier daje pozytywny wynik próby Trommera i próby Tollensa. Wybierz i podkreśl wzór cukru, którego może dotyczyć powyższy opis.
Zadanie 224. (NR18)
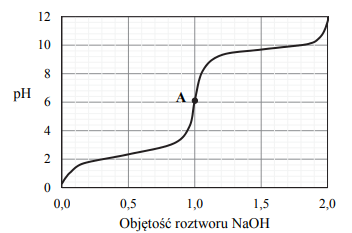
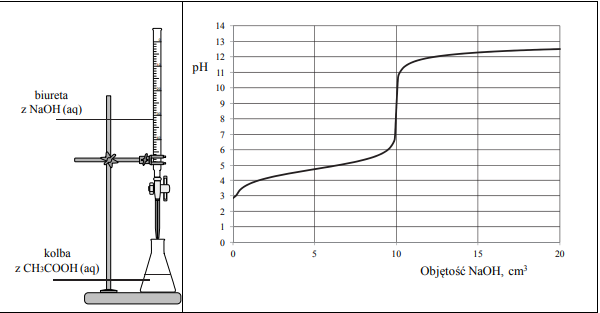
Do wodnego roztworu kwasu etanowego (octowego) o określonej objętości, ale o nieznanym stężeniu, dodawano kroplami wodny roztwór wodorotlenku sodu o znanym stężeniu i za pomocą pehametru mierzono pH mieszaniny reakcyjnej. W ten sposób przeprowadzono tzw. miareczkowanie pehametryczne, które jest jedną z metod analizy ilościowej. W czasie doświadczenia zachodziła reakcja opisana równaniem:
Zestaw użyty w tym doświadczeniu przedstawiono na poniższym schemacie, a otrzymane wyniki miareczkowania umieszczono na wykresie.
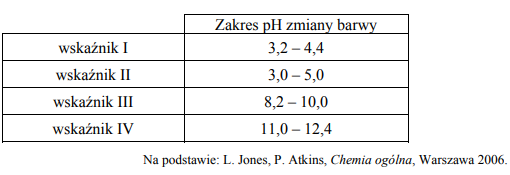
Po dodaniu takiej objętości roztworu wodorotlenku sodu, w jakiej znajdowała się liczba moli NaOH równa liczbie moli CH3COOH w roztworze wziętym do analizy, w układzie został osiągnięty punkt równoważnikowy. Ustalono, że w opisanym doświadczeniu pH w punkcie równoważnikowym było równe 9.
Podczas miareczkowania kwas–zasada zamiast pehametru można stosować wskaźniki pH. Muszą one być tak dobrane, aby zakres zmiany barwy wskaźnika przypadał w pobliżu punktu równoważnikowego miareczkowania. Właściwości wybranych wskaźników oznaczonych numerami I, II, III i IV przedstawiono w poniższej tabeli.
Spośród wskaźników podanych w tabeli i oznaczonych numerami I, II, III i IV wybierz i podaj numer tego wskaźnika, który powinien zostać użyty podczas opisanego miareczkowania roztworu kwasu etanowego.
Uzupełnij poniższe zdanie – wybierz i podkreśl jedno określenie spośród podanych w nawiasie. Odpowiedź uzasadnij, odwołując się do procesu zachodzącego w roztworze. W opisanym doświadczeniu odczyn roztworu w punkcie równoważnikowym jest (kwasowy / obojętny / zasadowy).
Podaj wzór jonu, którego stężenie jest największe w roztworze otrzymanym po dodaniu 18 cm3 wodnego roztworu wodorotlenku sodu do analizowanego roztworu kwasu etanowego.
Zadanie 225. (NR18)
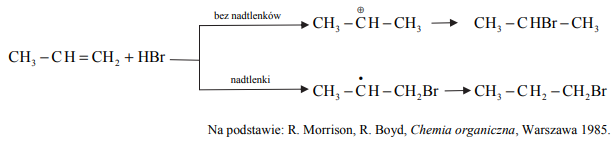
Na przebieg reakcji propenu z bromowodorem ma wpływ obecność nadtlenków w mieszaninie reakcyjnej, co zilustrowano na poniższym schemacie.
Uzupełnij poniższe zdania – wybierz i podkreśl jedno określenie spośród podanych w nawiasie. Gdy w środowisku reakcji nie ma nadtlenków, bromowodór przyłącza się do propenu (niezgodnie / zgodnie) z regułą Markownikowa. Ta addycja przebiega poprzez tworzenie drobin z ładunkiem dodatnim zlokalizowanym na atomie węgla. Jest to addycja (rodnikowa / nukleofilowa / elektrofilowa) do podwójnego wiązania węgiel – węgiel.
Gdy w środowisku reakcji są obecne nadtlenki, addycja jest (niezgodna / zgodna) z regułą Markownikowa. W tej reakcji przejściowo tworzy się (karbokation pierwszorzędowy / karbokation drugorzędowy / rodnik pierwszorzędowy / rodnik drugorzędowy).
Gdy w środowisku reakcji nie ma nadtlenków, bromowodór przyłącza się do propenu (niezgodnie / zgodnie) z regułą Markownikowa. Ta addycja przebiega poprzez tworzenie drobin z ładunkiem dodatnim zlokalizowanym na atomie węgla. Jest to addycja (rodnikowa / nukleofilowa / elektrofilowa) do podwójnego wiązania węgiel – węgiel.
Gdy w środowisku reakcji są obecne nadtlenki, addycja jest (niezgodna / zgodna) z regułą Markownikowa. W tej reakcji przejściowo tworzy się (karbokation pierwszorzędowy / karbokation drugorzędowy / rodnik pierwszorzędowy / rodnik drugorzędowy).
Zadanie 226. (NR18)
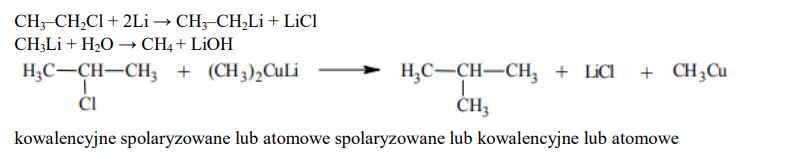
Chlorowcopochodne alkanów reagują z metalicznym litem, w wyniku czego tworzą związki litoorganiczne (których wzór w uproszczeniu można zapisać jako RLi). Reakcja przebiega zgodnie ze schematem:
RX +2Li → RLi + LiX
Związki litoorganiczne gwałtownie reagują z wodą z wydzieleniem wolnego węglowodoru. Roztwór po takiej reakcji ma odczyn zasadowy. W reakcjach związków litoorganicznych z jodkiem miedzi(I) powstaje związek miedziolitoorganiczny R2CuLi zgodnie z poniższym schematem:
2RLi + CuI → R2CuLi + LiI
Związek R2CuLi jest zwany odczynnikiem Gilmana. Ten odczynnik może reagować z inną chlorowcopochodną, w wyniku czego tworzy odpowiedni węglowodór (R–R’), co zilustrowano schematem:
R2CuLi + R’X → R–R’ + LiX + RCu
Napisz: • w formie cząsteczkowej równanie reakcji chloroetanu z litem. Związki organiczne przedstaw za pomocą wzorów półstrukturalnych (grupowych). . • w formie cząsteczkowej równanie reakcji metylolitu (CH3Li) z wodą.
Przeprowadzono reakcję, podczas której na drugorzędową chloropochodną alkanu podziałano odczynnikiem Gilmana. Wśród produktów reakcji obecny był 2-metylopropan. Napisz w formie cząsteczkowej równanie opisanej reakcji. Chloropochodną alkanu oraz 2-metylopropan przedstaw za pomocą wzorów półstrukturalnych (grupowych).
Temperatura topnienia butylolitu (C4H9Li) jest znacznie niższa od 0 °C. Na podstawie różnicy elektroujemności między litem a węglem oraz informacji wprowadzającej dotyczącej temperatury topnienia butylolitu określ rodzaj wiązania węgiel – lit.
Zadanie 227. (NR18)
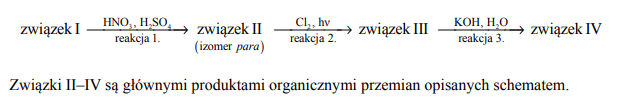
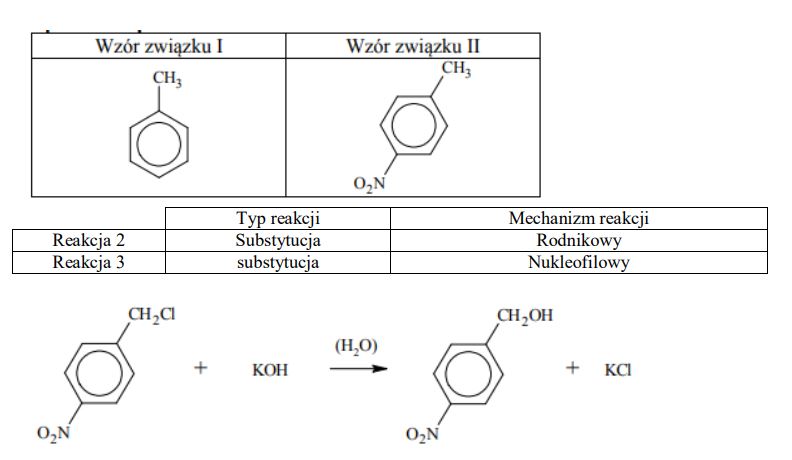
Poniżej przedstawiono ciąg przemian chemicznych, w wyniku których ze związku I otrzymano związek IV. Związek I to homolog benzenu. Jego cząsteczka zbudowana jest z siedmiu atomów węgla.
Napisz wzory półstrukturalne (grupowe) lub uproszczone związków I i II.
Określ typ reakcji (addycja, eliminacja, substytucja) oraz mechanizm (elektrofilowy, nukleofilowy, rodnikowy) reakcji 2. i 3.
Napisz w formie cząsteczkowej równanie reakcji 3. Związki organiczne przedstaw za pomocą wzorów półstrukturalnych (grupowych) lub uproszczonych.
Zadanie 228. (NR18)
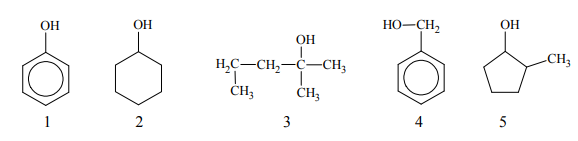
Poniżej przedstawiono wzory związków oznaczonych numerami 1–5.
Spośród związków oznaczonych numerami 1–5 wybierz te, które są względem siebie izomerami. Napisz numery, którymi oznaczono te związki.
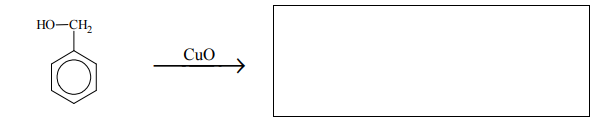
Uzupełnij poniższe schematy. Napisz wzór półstrukturalny (grupowy) lub uproszczony organicznego produktu reakcji tlenku miedzi(II):
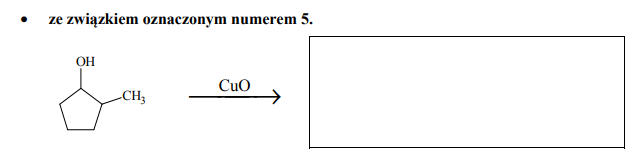
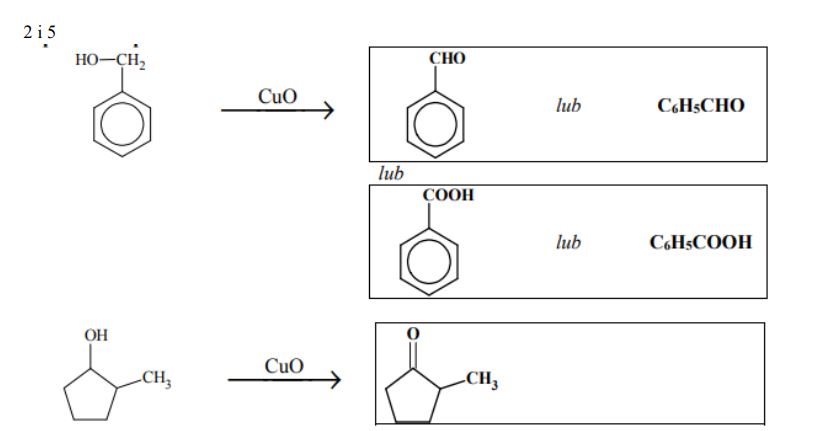
• ze związkiem oznaczonym numerem 4.
Zadanie 229. (NR18)
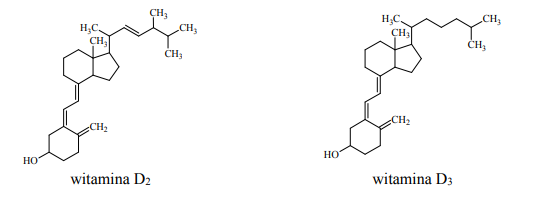
Witamina D jest ogólną nazwą dla dwóch związków: witaminy D2 oraz witaminy D3 o podanych poniżej wzorach.
Uzupełnij poniższe zdania – wybierz i podkreśl jedno określenie spośród podanych w nawiasie. 1. Witamina D2 oraz witamina D3 są związkami organicznymi o podobnej strukturze, ale różnią się rodzajem łańcucha węglowodorowego przyłączonego do pierścienia (sześcioczłonowego / pięcioczłonowego). 2. Witamina D2 oraz witamina D3 (są / nie są) względem siebie izomerami. 3. W cząsteczce witaminy D2 oraz witaminy D3 (znajdują się / nie znajdują się) asymetryczne atomy węgla. 4. Po porównaniu budowy witaminy D2 oraz budowy witaminy D3 można stwierdzić, że liczba wiązań π w cząsteczce witaminy D2 jest (większa / mniejsza) niż liczba wiązań π w cząsteczce witaminy D3.
- Witamina D2oraz witamina D3 są związkami organicznymi o podobnej strukturze, ale różnią się rodzajem łańcucha węglowodorowego przyłączonego do pierścienia (sześcioczłonowego / pięcioczłonowego). 2. Witamina D2 oraz witamina D3 (są / nie są) względem siebie izomerami. 3. W cząsteczce witaminy D2 oraz witaminy D3 (znajdują się / nie znajdują się) asymetryczne atomy węgla. 4. Po porównaniu budowy witaminy D2 oraz budowy witaminy D3 można stwierdzić, że liczba wiązań π w cząsteczce witaminy D2 jest (większa / mniejsza) niż liczba wiązań π w cząsteczce witaminy D3.
Zadanie 230. (NR18)
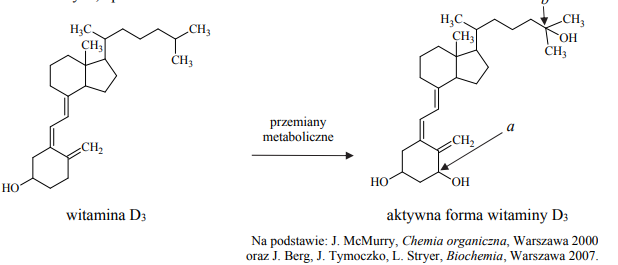
Zadanie 34. (0–1) Aktywne formy witaminy D, odgrywające ważną rolę w kontrolowaniu metabolizmu wapnia i fosforu, nie występują w pokarmie. Pod wpływem światła słonecznego obie aktywne formy są wytwarzane pod powierzchnią skóry w wyniku różnych przemian, np. reakcji fotochemicznej, reakcji polegającej na otwarciu pierścienia, izomeryzacji, a także przemian metabolicznych, np.:
Podaj nazwę grup funkcyjnych, których wprowadzenie do szkieletu cząsteczki witaminy D3 skutkuje przekształceniem witaminy w jej aktywną formę. Określ formalne stopnie utlenienia atomów węgla oznaczonych w powyższym wzorze literami a i b oraz określ hybrydyzację orbitali walencyjnych atomów węgla oznaczonych tymi samymi literami.
Grupy hydroksylowe lub wodorotlenowe
a 0 sp3
b I sp3
Zadanie 231. (NR18)
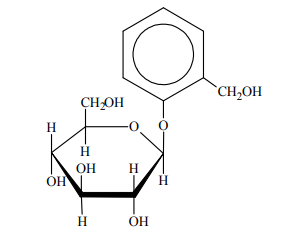
Glikozydy to grupa związków organicznych stanowiących połączenie cukrów z innymi substancjami. Cząsteczka glikozydu jest złożona z części cukrowej oraz części niecukrowej. Ważną grupę glikozydów stanowią O-glikozydy, których cząsteczki powstają w wyniku reakcji kondensacji z udziałem grupy hydroksylowej cząsteczki cukru. Jednostki cukrowe występują zwykle w formie cyklicznej i łączą się z częścią niecukrową za pośrednictwem anomerycznego atomu węgla. Jednym z glikozydów jest salicyna o wzorze:
Salicyna tworzy bezbarwne kryształy.
W środowisku kwasowym O-glikozydy ulegają hydrolizie. Jej produktami są cukier i związek, od którego pochodziła niecukrowa część glikozydu. Napisz wzór łańcuchowy (w projekcji Fischera) cukru powstającego w wyniku hydrolizy salicyny. Uzupełnij poniższy schemat – wpisz w odpowiednie pola wzory grupy –OH lub symbole atomów wodoru. Narysuj wzór półstrukturalny (grupowy) związku, od którego pochodziła niecukrowa część glikozydu.
W celu zbadania właściwości salicyny przeprowadzono dwuetapowe doświadczenie, którego przebieg ilustruje schemat. W pierwszym etapie salicynę wprowadzono do probówek I–III, w których znajdowały się następujące odczynniki:
Zawartość probówki III ogrzano. W każdej probówce otrzymano roztwór. W drugim etapie mieszaninę poreakcyjną otrzymaną w probówce III ostudzono i rozdzielono na dwie probówki: IV i V, w których znajdowały się następujące odczynniki:
Uzupełnij poniższą tabelę – opisz barwę zawartości każdej probówki po zakończeniu danego etapu doświadczenia
Zadanie 232. (NR18)
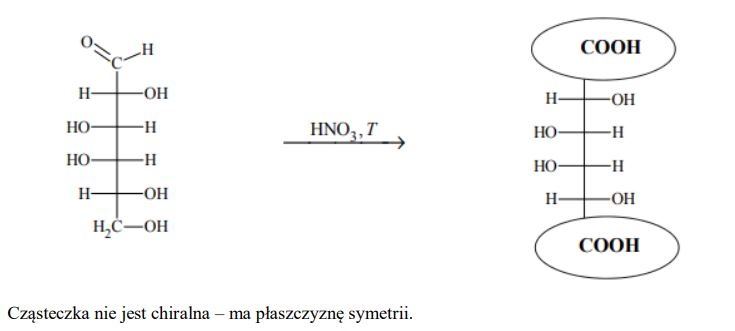
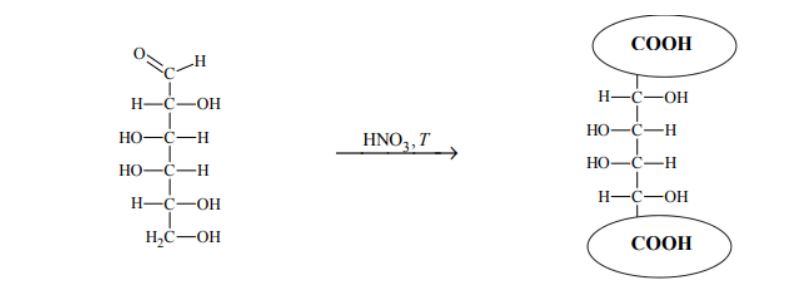
Aldozy utleniają się tak samo łatwo, jak inne aldehydy, dlatego redukują np. odczynnik Tollensa. Działanie na aldozę kwasem azotowym(V), który jest silnym utleniaczem, skutkuje utlenieniem nie tylko grupy –CHO, lecz także grupy –CH2OH. Produktami utlenienia aldoz kwasem azotowym(V) są kwasy dikarboksylowe.
Przeprowadzono reakcję chemiczną, w której na D-galaktozę podziałano kwasem azotowym(V). Uzupełnij poniższy schemat – wpisz w zaznaczone pola wzory odpowiednich fragmentów cząsteczki związku organicznego. Oceń, czy cząsteczka powstałego związku organicznego jest chiralna. Uzasadnij odpowiedź.
Zadanie 233. (NR18)
W czterech naczyniach (I–IV) znajdowały się cztery różne wodne roztwory: fruktozy, glukozy, skrobi i albuminy (białka występującego m.in. w jajach kurzych). W celu ich identyfikacji przeprowadzono trzy serie doświadczeń. W pierwszej serii doświadczeń, po dodaniu wodno-alkoholowego roztworu jodu do próbek pobranych z czterech naczyń, próbka z naczynia I przyjęła granatowe zabarwienie. W drugiej serii doświadczeń, po dodaniu etanolu do próbek pobranych z trzech naczyń (II, III i IV), w próbce z naczynia II pojawił się biały, kłaczkowaty osad. W trzeciej serii doświadczeń, po dodaniu wodnego roztworu bromu z dodatkiem wodorowęglanu sodu do próbek pobranych z dwóch naczyń (III i IV), próbka z naczynia III przyjęła trwałe pomarańczowe zabarwienie. Próbka z naczynia IV po pewnym czasie stała się bezbarwna.
Podaj nazwy związków, które zidentyfikowano podczas przeprowadzonych trzech serii doświadczeń.
Podaj nazwę procesu, który w drugiej serii doświadczeń, po dodaniu etanolu do próbek pobranych z trzech naczyń (II, III i IV), był przyczyną pojawienia się białego, kłaczkowatego osadu w próbce z naczynia II.
Naczynie I: skrobia Naczynie II: albumina Naczynie III: fruktoza Naczynie IV: glukoza
denaturacja lub ścięcie białka lub nieodwracalna koagulacja
Zadanie 234. (NR18)
W roztworze o odczynie zasadowym ketony, których cząsteczki zawierają grupę –OH przy atomie węgla połączonym z atomem węgla grupy karbonylowej, ulegają izomeryzacji. Tę przemianę ilustruje poniższy schemat.
Przeprowadzono doświadczenie, w którym do dwóch probówek – w jednej probówce znajdował się wodny roztwór glukozy, a w drugiej wodny roztwór fruktozy – dodano zalkalizowaną zawiesinę wodorotlenku miedzi(II). Następnie zawartość każdej probówki wymieszano i ogrzano. Odpowiedz na poniższe pytanie. Wpisz TAK albo NIE do tabeli i podaj uzasadnienie. W uzasadnieniu odwołaj się do konsekwencji procesu opisanego w informacji oraz nazwij właściwości cukrów, które potwierdzono opisanym doświadczeniem.
NIE
W warunkach doświadczenie fruktoza ulega izomeryzacji, w wyniku której tworzą się związki (m.in. glukoza), których cząsteczki mają grupę aldehydową i wykazują właściwości redukujące.
Zadanie 235. (NR18)
Hydrolizę sacharozy można opisać równaniem:
Uzupełnij poniższe zdania – wybierz i podkreśl jedno określenie spośród podanych w nawiasie oraz wpisz wartość stężenia molowego glukozy.
Reakcja hydrolizy sacharozy biegła szybciej w ciągu (pierwszych / ostatnich) 30 minut trwania eksperymentu, ponieważ szybkość reakcji zależy od stężenia substratów, które (maleje / rośnie) w miarę biegu reakcji. Stężenie molowe glukozy w badanym roztworze w czasie równym połowie całkowitego czasu wykonywania pomiarów było równe ………………………………………. mol · dm−3 .
Reakcja hydrolizy sacharozy biegła szybciej w ciągu (pierwszych / ostatnich) 30 minut trwania eksperymentu, ponieważ szybkość reakcji zależy od stężenia substratów, które (maleje / rośnie) w miarę biegu reakcji. Stężenie molowe glukozy w badanym roztworze w czasie równym połowie całkowitego czasu wykonywania pomiarów było równe (1 – 0,726) = 0,274 mol · dm−3 .