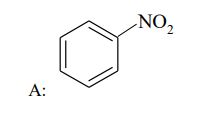
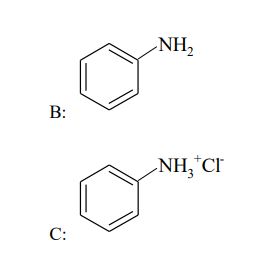
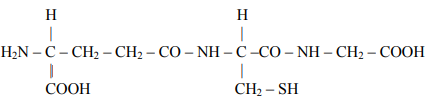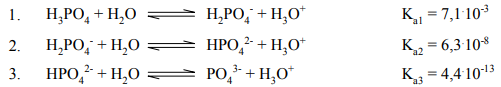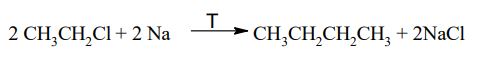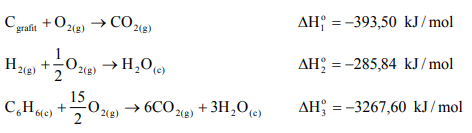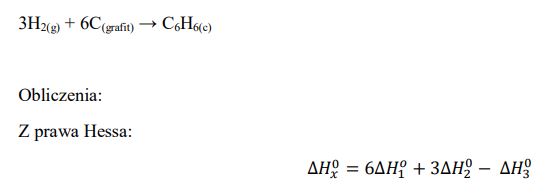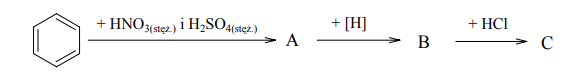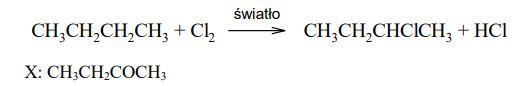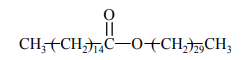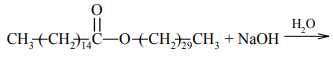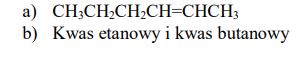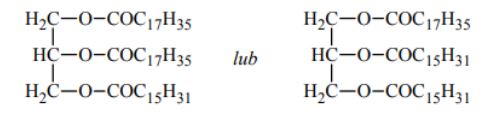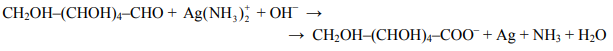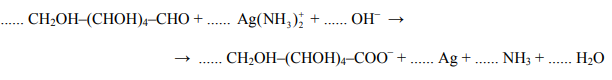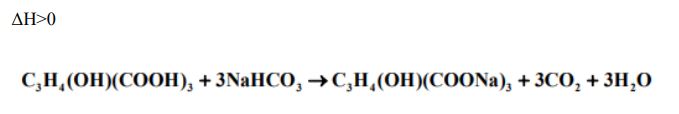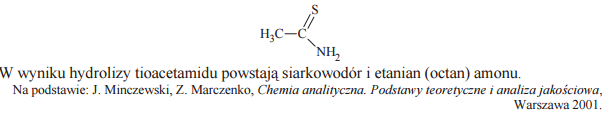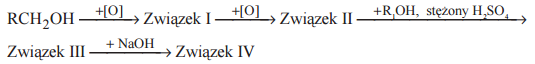Zadania maturalne z Chemii
Tematyka: tłuszcze, aminokwasy, peptydy, białka, cukry, izomeria optyczna.
Zadania pochodzą z oficjalnych arkuszy maturalnych CKE, które służyły przeprowadzaniu majowych egzaminów. Czteroznakowy kod zapisany przy każdym zadaniu wskazuje na jego pochodzenie: S/N – „stara”/”nowa” formuła; P/R – poziom podstawowy/rozszerzony; np. 08 – rok 2008.
Zbiór zadań maturalnych w formie arkuszy, możesz pobrać >> TUTAJ <<.
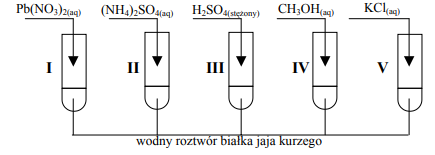
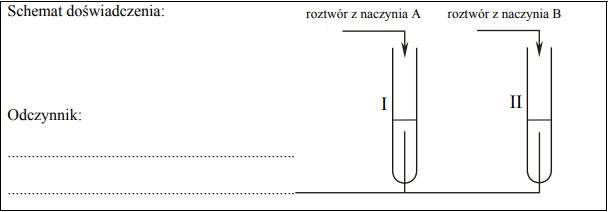
Zadanie 63. (SR05)
W celu zbadania wpływu różnych substancji na białko przeprowadzono doświadczenie pokazane na poniższym rysunku:
Podaj, w których probówkach zachodzą następujące procesy: wysalanie i denaturacja. Wyjaśnij, na czym polegają te procesy.
wysalanie: probówki II i V denaturacja: probówki I, III, IV
Wysalanie – zachodzi odwracalna koagulacja;
Denaturacja – zachodzi nieodwracalna koagulacja;
Zadanie 64. (SR05)
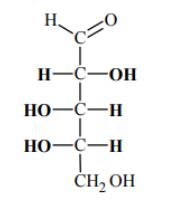
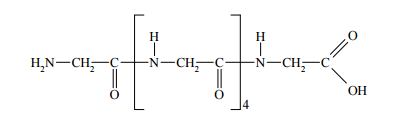
Glutation o wzorze:
jest tripeptydem występującym w żywych komórkach. Napisz wzory aminokwasów, które powstaną w wyniku całkowitej hydrolizy tego związku.
H2N – CH – CH2 – CH2 – COOH
I
COOH
H2N – CH – COOH
I
CH2 – SH
H2N – CH2 – COOH
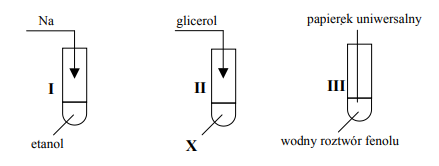
Zadanie 65. (SR05)
Dokonaj analizy schematycznych rysunków przedstawiających trzy doświadczenia i uzupełnij brakujące
Substancja X: Cu(OH)2
probówka I: wydziela się gaz (wodór)/ metal się roztwarza (rozpuszcza)
probówka III: papierek uniwersalny (wskaźnikowy) zabarwia się na bladoróżowo
Zadanie 66. (SR05)
But-2-en można otrzymać w wyniku reakcji dysproporcjonowania propenu na odpowiednich katalizatorach. Reakcja polega na tym, że z alkenu o n atomach węgla powstają dwa nowe alkeny: jeden o (n+1) atomach węgla i drugi, o (n-1) atomach węgla. Podaj nazwę drugiego alkenu, który powstał w wyniku tej reakcji i napisz jej równanie, posługując się wzorami półstrukturalnymi (grupowymi).
Eten
2CH3 – CH = CH2 → CH2 = CH2 + CH3 – CH = CH – CH3
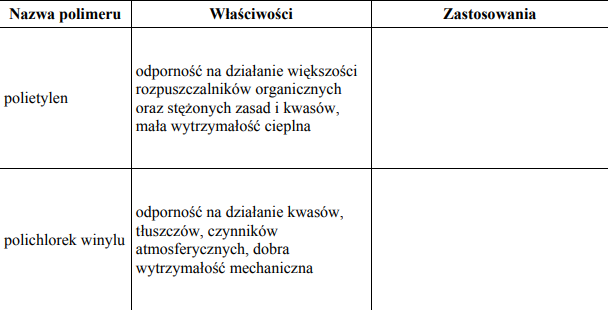
Zadanie 67. (SR05)
W poniższej tabeli przedstawiono najważniejsze właściwości polietylenu (PE) i polichlorku winylu (PCV). Uzupełnij tabelę wpisując w puste miejsca po dwa przykłady zastosowań tych polimerów, które wynikają z ich właściwości.
Zastosowanie
Polietylen –opakowania, torby, butelki, folie, pojemniki na wodę i chemikalia, wyroby galanteryjne, przewody kanalizacyjne, rury;
Polichlorek winylu – rury do przemysłu chemicznego, płytki i wykładziny podłogowe, izolacja przewodów elektrycznych, opakowania, uszczelki, ramy do okien, meble ogrodowe;
Zadanie 68. (SR05)
Zaprojektuj doświadczenie, w którym wykażesz, że produkt termicznego rozkładu polietylenu ma charakter nienasycony. W tym celu: a) przedstaw słowny opis doświadczenia, b) opisz obserwacje, jakich można dokonać podczas badania nienasyconego charakteru produktu tego rozkładu.
- a) gaz powstały w wyniku termicznego rozkładu polietylenu wprowadzamy do wody bromowej lub do roztworu manganianu(VII) potasu lub do probówki z zebranym gazem dodajemy wodę bromową lub roztwór manganianu(VII) potasu;
- b) woda bromowa odbarwiła się; lub roztwór manganianu(VII) potasu odbarwił się lub roztwór odbarwia się i/lub wytrąca się brunatny osad;
Zadanie 69. (SR06)
Dysocjacja kwasu ortofosforowego(V) przebiega w roztworach wodnych trójstopniowo:
Ka1,Ka2,Ka3 oznaczają stałe kolejnych etapów dysocjacji. Podane wartości stałych odnoszą się do temperatury 25ºC.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 1997
Napisz wzór jonu, którego stężenie w wodnym roztworze H3PO4 jest: a) największe b) najmniejsze. Określ jaką rolę
według teorii Brőnsteda pełni jon H2PO4– w reakcji opisanej równaniem 2.
- a) Największe H3O+
- b) Najmniejsze PO43-
Jon H2PO4– pełni rolę kwasu.
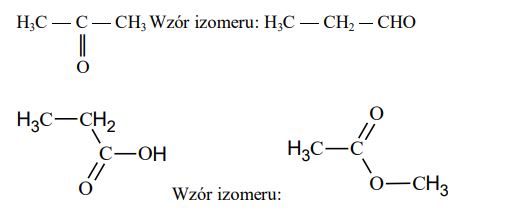
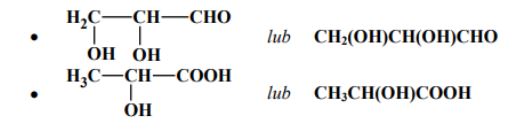
Zadanie 70. (SR06)
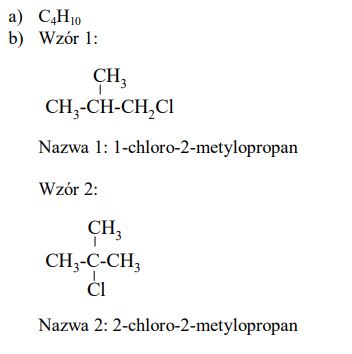
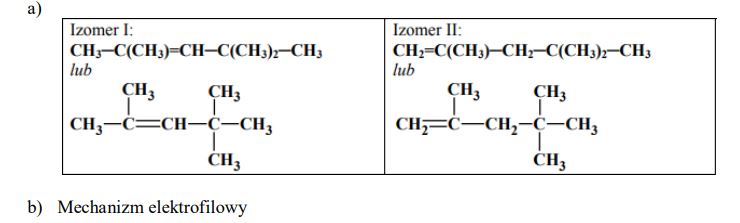
Poniżej przedstawiono wzory półstrukturalne (grupowe) dwóch pochodnych propanu. Podaj wzór półstrukturalny (grupowy) jednego izomeru każdego z tych związków.
Zadanie 71. (SR06)
W chemii żywności ważnymi reakcjami są reakcje fermentacji. Poniżej przedstawiono schematyczny zapis przebiegu fermentacji alkoholowej i fermentacji mlekowej.
fermentacja alkoholowa: C6H12O6 → 2C2H5OH + 2CO2
(glukoza)
fermentacja mlekowa: C6H12O6 → 2CH3CH(OH)COOH (glukoza) (kwas mlekowy)
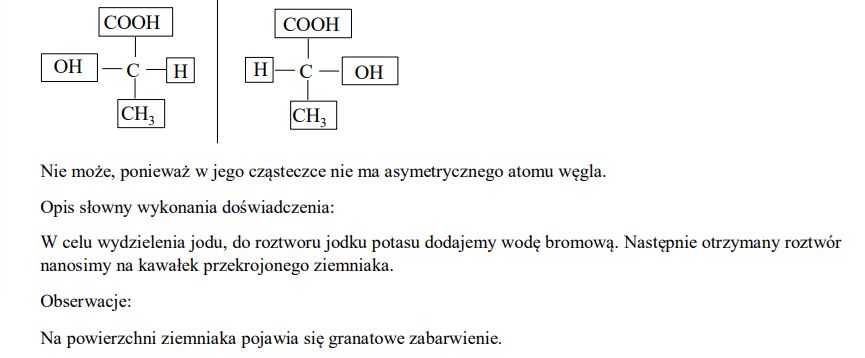
Uzupełnij poniższy schemat, tak aby przedstawiał on wzory pary enancjomerów kwasu mlekowego. Określ, czy etanol może występować w formach enancjomerów. Odpowiedź uzasadnij.
Opisz, w jaki sposób można doświadczalnie sprawdzić obecność skrobi w bulwach ziemniaków, mając do dyspozycji wodę bromową i wodny roztwór jodku potasu. Podaj opis słowny wykonania doświadczenia oraz obserwacje, dotyczące wykrywania skrobi w bulwach ziemniaków.
Zadanie 72. (SR06)
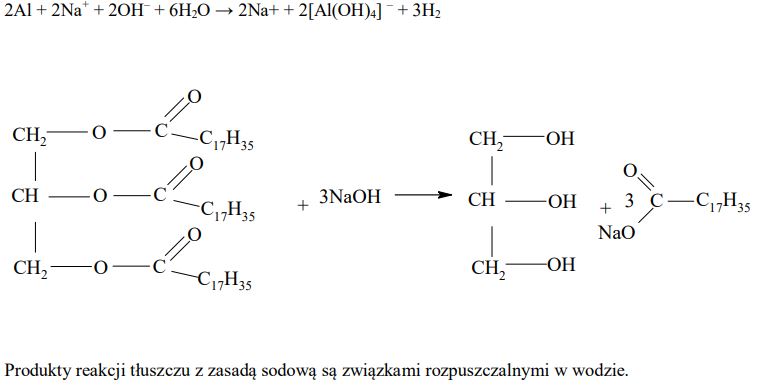
Wodorotlenek sodu jest głównym składnikiem preparatów do czyszczenia niedrożnych rur i syfonów. Na etykiecie jednego z takich preparatów znajduje się następujące ostrzeżenie: Nie stosować do czyszczenia instalacji aluminiowych.
Uzasadnij powyższe ostrzeżenie, zapisując w formie jonowej równanie reakcji chemicznej, która zaszłaby po zastosowaniu takiego preparatu do czyszczenia instalacji aluminiowej. Pamiętaj, że jednym z produktów reakcji glinu z zasadą sodową jest wodór. Napisz równanie tej reakcji przyjmując, że cząsteczki tłuszczu zbudowane są wyłącznie z tristearynianu glicerolu. W zapisie zastosuj półstrukturalne (grupowe) wzory tristearynianu glicerolu i glicerolu oraz sumaryczne wzory reszt węglowodorowych kwasu organicznego. Określ, jaka właściwość fizyczna produktów reakcji tłuszczu z zasadą sodową jest podstawą opisanej metody udrażniania rur.
Zadanie 73. (SR07)
W laboratorium etan otrzymuje się ogrzewając chlorometan z sodem. Reakcja zachodzi zgodnie z równaniem:
Napisz równanie reakcji otrzymywania n-butanu opisaną metodą. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
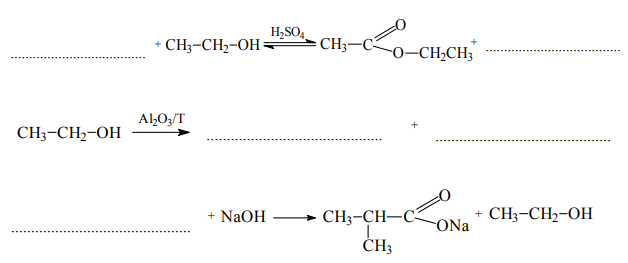
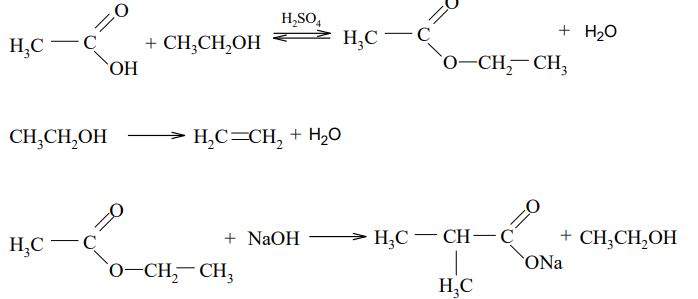
Zadanie 74. (SR07)
Posługując się wzorami półstrukturalnymi (grupowymi), uzupełnij poniższe równania ilustrujące procesy, w których etanol jest substratem lub produktem reakcji.
Zadanie 75. (SR07)
Podczas produkcji serów dojrzewających kwas mlekowy (kwas 2-hydroksypropanowy) pod wpływem bakterii propionowych ulega tzw. fermentacji propionowej. W tej reakcji z kwasu mlekowego powstaje kwas propanowy i kwas etanowy (octowy) w stosunku molowym 2 : 1 oraz tlenek węgla(IV) i woda. Napisz równanie opisanej reakcji, stosując wzory półstrukturalne (grupowe) związków organicznych.
3CH3–CH(OH)–COOH → 2CH3CH2COOH + CH3COOH + CO2 + H2O
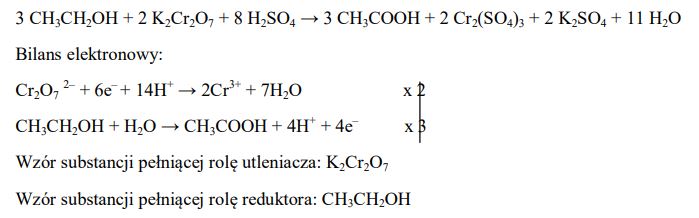
Zadanie 76. (SR07)
Kwas octowy (etanowy) można otrzymać w reakcji etanolu (alkoholu etylowego) z dichromianem(VI) potasu. Stosując zasadę bilansu elektronowego, dobierz współczynniki w poniższym równaniu reakcji. Podaj wzór substancji pełniącej rolę utleniacza oraz wzór substancji pełniącej rolę reduktora.
Zadanie 77. (SR07)
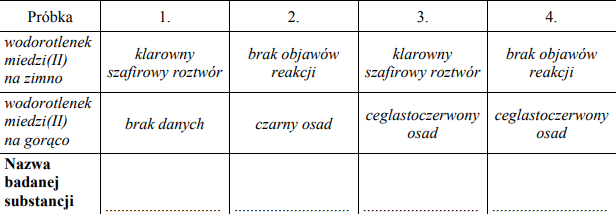
Badano działanie świeżo sporządzonego wodorotlenku miedzi(II) na próbki roztworów wodnych etanolu, etanalu, glicerolu i glukozy. Obserwacje zestawiono w tabeli. Przeanalizuj zestawione poniżej obserwacje i wpisz do tabeli nazwy substancji, które były w próbkach oznaczonych numerami 1, 2, 3 i 4.
Zadanie 78. (SR07)
Napisz równanie reakcji otrzymywania benzenu z pierwiastków, a następnie oblicz standardową entalpię tworzenia benzenu (w postaci cieczy), znając standardowe entalpie spalania grafitu, wodoru i benzenu.
Zadanie 79. (SR08)
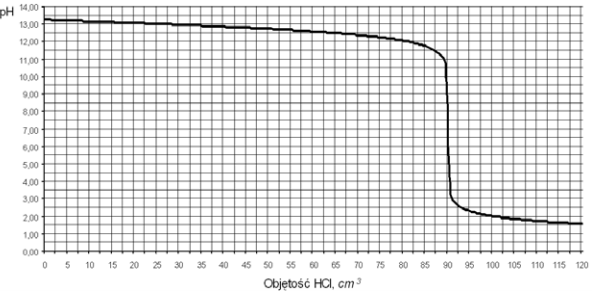
Do 100 cm3 wodnego roztworu wodorotlenku sodu dodawano kroplami kwas solny o stężeniu 0,20 mol/dm3 i za pomocą pehametru mierzono pH mieszaniny reakcyjnej. Otrzymane wyniki umieszczono na wykresie ilustrującym zależność pH od objętości dodanego HCl.
Podaj symbole lub wzory trzech rodzajów jonów, których stężenie jest największe w roztworze otrzymanym po dodaniu 120 cm3 kwasu solnego do badanego roztworu wodorotlenku sodu. Z powyższego wykresu odczytaj objętość kwasu solnego potrzebną do zobojętnienia wodorotlenku sodu znajdującego się w badanym roztworze.
Cl– Na+ H3O+
90 cm3
Zadanie 80. (SR08)
Standardowa entalpia uwodornienia etenu przy użyciu gazowego wodoru i w obecności palladu jako katalizatora wynosi –137 kJ/mol. Na podstawie tej informacji określ, czy reakcja uwodornienia etenu jest egzotermiczna czy endotermiczna.
Reakcja jest egzotermiczna.
Zadanie 81. (SR08)
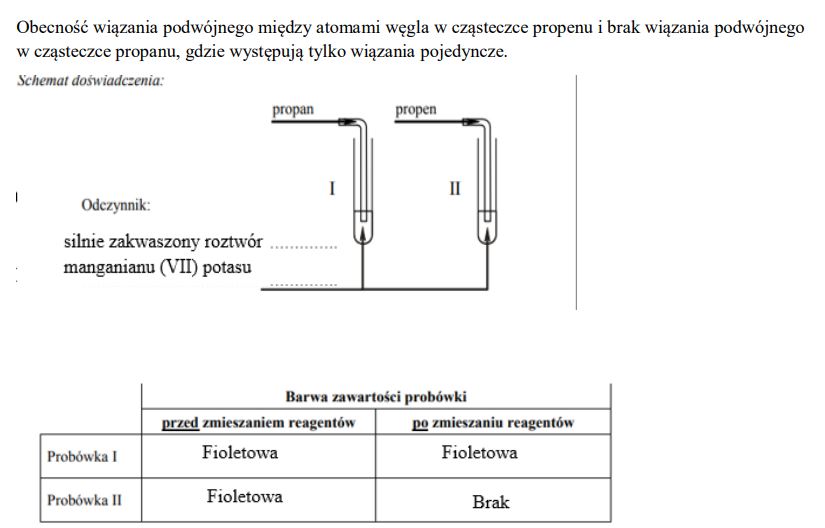
Zaprojektuj doświadczenie, którego przebieg pozwoli odróżnić propan od propenu. W tym celu: napisz, jaką różnicę w budowie cząsteczek tych związków weźmiesz pod uwagę, planując eksperyment; uzupełnij schemat doświadczenia, wpisując nazwę użytego odczynnika wybranego z podanej poniżej listy:
• zawiesina świeżo strąconego wodorotlenku miedzi(II),
• silnie zakwaszony wodny roztwór manganianu(VII) potasu,
• wodny roztwór chlorku żelaza(III);
Napisz, jakie obserwacje potwierdzą obecność propanu w probówce I i propenu w probówce II po wprowadzeniu tych gazów do wybranego odczynnika (wypełnij poniższą tabelę):
Zadanie 82. (SR08)
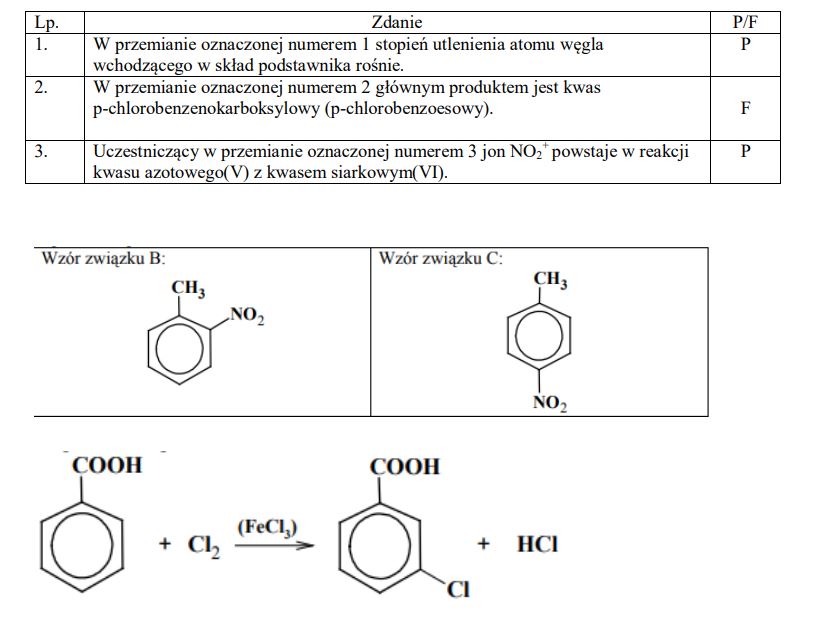
Napisz wzory półstrukturalne (grupowe) jednopodstawionych pochodnych benzenu oznaczonych literami A, B i C, które powstają w wyniku przemian zilustrowanych schematem.
Zadanie 83. (SR08)
Przeprowadzono ciąg reakcji zilustrowanych następującym schematem:
Napisz, stosując wzory półstrukturalne (grupowe) równanie reakcji numer I. W równaniu nad strzałką napisz warunki, w jakich zachodzi ta reakcja. Napisz wzór półstrukturalny (grupowy) związku X.
Zadanie 84. (SR08)
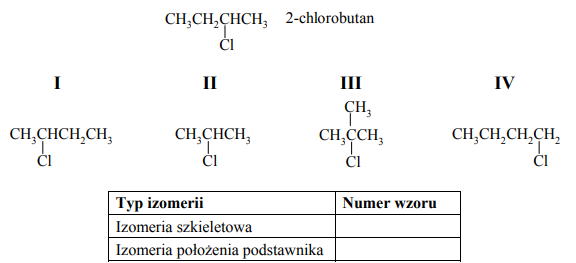
Spośród poniższych wzorów wybierz te, które przedstawiają izomery 2-chlorobutanu i odpowiadają typom izomerii wymienionym w tabeli. Każdemu typowi izomerii przyporządkuj numer wzoru, wpisując go do tabeli.
Oceń prawdziwość poniższych zdań i uzupełnij tabelę, wpisując literę P, jeżeli uznasz zdanie za prawdziwe, lub literę F, jeżeli uznasz je za fałszywe.
Zadanie 85. (SR08)
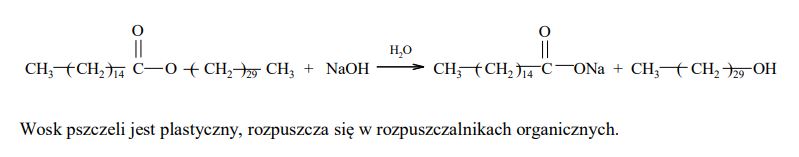
Woski to mieszaniny estrów długołańcuchowych kwasów tłuszczowych i długołańcuchowych alkoholi monohydroksylowych. Na przykład jednym z głównych składników wosku pszczelego jest związek o wzorze:
Posługując się wzorami półstrukturalnymi (grupowymi) związków organicznych, uzupełnij poniższe równanie reakcji hydrolizy tego estru w środowisku zasadowym.
Znajomość budowy cząsteczek wosku pozwala przewidzieć jego niektóre cechy. Uzupełnij poniższe zdanie, wybierając spośród podanych w nawiasie wszystkie właściwości wosku pszczelego. Wybrane właściwości podkreśl. Wosk pszczeli (ma budowę krystaliczną, jest plastyczny, jest hydrofilowy, rozpuszcza się w rozpuszczalnikach organicznych).
Zadanie 86. (SR08)
Błony komórkowe składają się głównie z fosfolipidów – związków zbudowanych z małej, polarnej „głowy” i dwóch długich, węglowodorowych „ogonów” (rys. 1.). W środowisku wodnym cząsteczki fosfolipidów samorzutnie układają się w podwójną warstwę lipidową (rys. 2.).
Na podstawie: Pr. zb. „Podstawy biologii komórki. Wprowadzenie do biologii molekularnej”, Warszawa 1999
Uzupełnij poniższe zdanie wyjaśniające przyczynę powstawania podwójnej warstwy o przedstawionej strukturze. W każdym nawiasie wybierz i podkreśl właściwe określenie. „Głowa” jest (hydrofilowa hydrofobowa), to znaczy ma (duże małe) powinowactwo do wody. „Ogony” – w przeciwieństwie do „głowy” – są (hydrofilowe hydrofobowe) i (silnie słabo) oddziałują z wodą.
„Głowa” jest hydrofilowa, to znaczy ma duże powinowactwo do wody. „Ogony” – w przeciwieństwie do „głowy” – są hydrofobowe i słabo oddziałują z wodą.
Zadanie 87. (SR09)
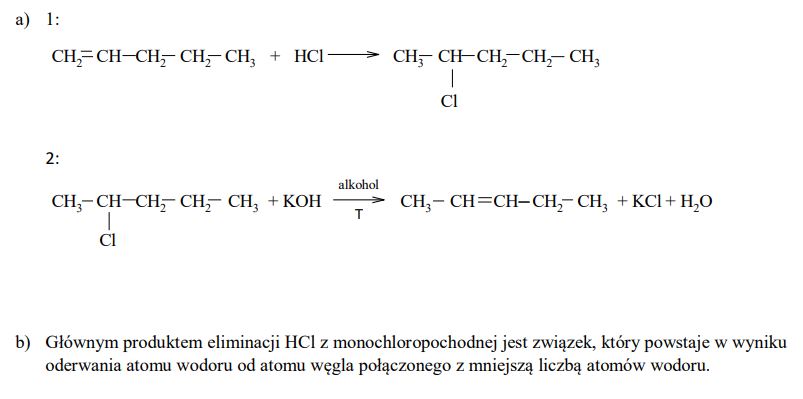
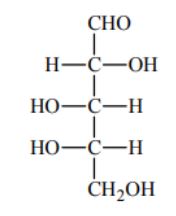
Pent-2-en otrzymano z pent-1-enu w wyniku dwuetapowego procesu. W etapie 1 dokonano addycji chlorowodoru do pent-1-enu i otrzymano monochloropochodną pentanu (produkt główny). W etapie 2, w podwyższonej temperaturze i w alkoholowym roztworze wodorotlenku potasu, przeprowadzono reakcję eliminacji chlorowodoru z tej monochloropochodnej. Głównym produktem tej reakcji był pent-2-en. a) Napisz, stosując wzory półstrukturalne (grupowe) związków organicznych, równania reakcji tego procesu. W równaniu reakcji etapu 2 uwzględnij warunki procesu. b) Dokonaj analizy równania reakcji etapu 2 i sformułuj regułę dotyczącą przebiegu reakcji eliminacji (podobną do reguły Markownikowa dla reakcji addycji). Uzupełnij poniższe zdanie, wpisując w wolne miejsce słowo mniejszą albo większą. Głównym produktem eliminacji HCl z monochloropochodnej jest związek, który powstaje w wyniku oderwania atomu wodoru od atomu węgla połączonego z ……………………………… liczbą atomów wodoru.
Zadanie 88. (SR09)
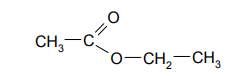
Poniżej przedstawiono wzór półstrukturalny (grupowy) etanianu (octanu) etylu.
Zapisz wzory półstrukturalne (grupowe) jednego estru i jednego kwasu będących izomerami octanu etylu.
Zadanie 89. (SR09)
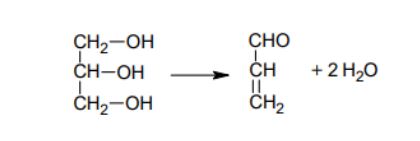
Glicerol (propan-1,2,3-triol) ulega termicznej dehydratacji. W wyniku odwodnienia glicerolu powstaje nienasycony aldehyd – propenal (akroleina). Napisz, stosując wzory półstrukturalne (grupowe) związków organicznych, równanie reakcji otrzymywania propenalu opisaną metodą.
Zadanie 90. (SR09)
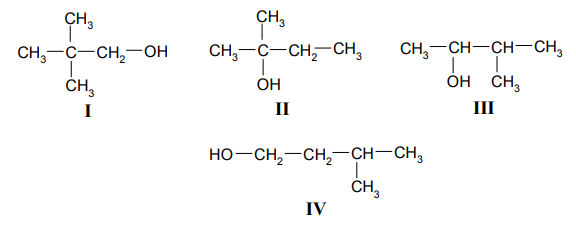
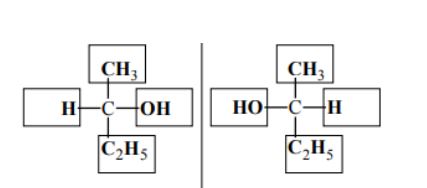
Poniżej przedstawiono wzory grupowe czterech wybranych izomerów pentanolu.
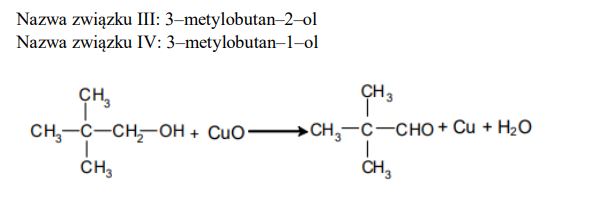
Podaj nazwy systematyczne związków, których wzory oznaczono numerami III i IV. Określ rzędowość alkoholi I, II i III. Zapisz numer oznaczający wzór tego związku, który może występować w postaci enancjomerów. Napisz, posługując się wzorami półstrukturalnymi (grupowymi) związków organicznych, równanie reakcji utleniania alkoholu I za pomocą tlenku miedzi(II) w podwyższonej temperaturze.
Zadanie 91. (SR09)
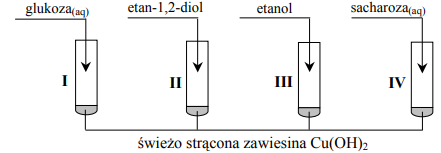
W celu porównania właściwości glukozy, etan-1,2-diolu, etanolu oraz sacharozy wykonano następujące doświadczenie. Etap 1. Tę część doświadczenia przeprowadzono w temperaturze pokojowej zgodnie z poniższym schematem.
Objawy reakcji zaobserwowano w probówkach I, II i IV. Etap 2. Zawartość każdej probówki dodatkowo zalkalizowano i ogrzano. Stwierdzono, że w jednej probówce powstał ceglastoczerwony osad.
Przeanalizuj przebieg pierwszego etapu doświadczenia. a) Wyjaśnij, porównując budowę cząsteczek związków, które znajdowały się w probówkach I – IV, dlaczego w probówce III nie zaszła reakcja chemiczna. b) Opisz zmiany, jakie zaobserwowano w probówkach I, II i IV. Podaj numer probówki, w której w drugim etapie doświadczenia powstał ceglastoczerwony osad Cu2O.
- Zawiesina Cu(OH)2 rozpuszcza się w roztworze związku, w którego cząsteczce jest kilka grup hydroksylowych, a w cząsteczce etanolu jest tylko jedna grupa hydroksylowa.
- Etanol jest alkoholem monohydroksylowym, a w cząsteczkach pozostałych związków jest więcej grup hydroksylowych położonych przy sąsiednich atomach węgla.
b)
- Zawiesina Cu(OH)2 rozpuściła się.
- Powstał roztwór o barwie szafirowej.
Osad powstał w probówce I.
Zadanie 92. (SR10)
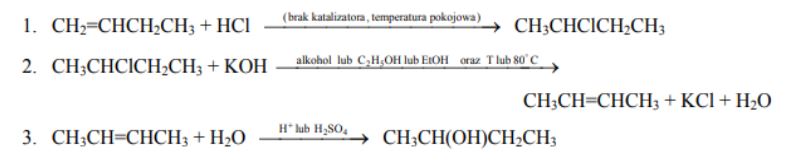
Alkeny bardzo łatwo przyłączają bromowodór lub chlorowodór. Reakcje te nie wymagają użycia katalizatorów ani podwyższenia temperatury. Powstałe w wyniku tej przemiany halogenki alkilowe mogą ulegać reakcji podstawienia lub reakcji eliminacji. Temperatura pokojowa i użycie wody jako rozpuszczalnika sprzyja reakcji podstawienia, natomiast użycie alkoholowego roztworu wodorotlenku potasu w podwyższonej temperaturze (około 80 ºC) prowadzi do reakcji eliminacji. W obecności kwasu siarkowego(VI) alkeny mogą reagować także z wodą, dając alkohole. Poniżej przedstawiono ciąg przemian:
Skorzystaj z powyższej informacji i napisz równania reakcji 1, 2 oraz 3, stosując wzory półstrukturalne (grupowe) związków organicznych. Jeżeli reakcja wymaga użycia katalizatora, odpowiedniego środowiska lub podwyższenia temperatury, napisz to nad strzałką równania reakcji.
Zadanie 93. (SR10)
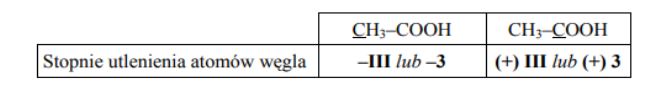
Określ stopnie utlenienia atomów węgla w cząsteczce kwasu etanowego (octowego). Wypełnij tabelę, wpisując stopień utlenienia atomu węgla, którego symbol został podkreślony.
Zadanie 94. (SR10)
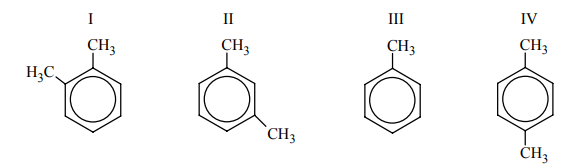
Spośród poniższych wzorów wybierz wszystkie, które są wzorami izomerów 1,2-dimetylobenzenu (napisz numery, którymi je oznaczono).
II i IV
Zadanie 95. (SR10)
Oceń prawdziwość poniższych zdań i uzupełnij tabelę. Wpisz literę P, jeżeli uznasz zdanie za prawdziwe, lub literę F, jeżeli uznasz je za fałszywe.
Zadanie 96. (SR10)
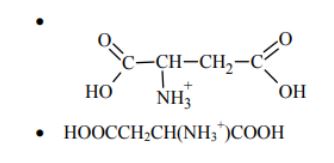
Punkt izoelektryczny (pI) aminokwasu to pH roztworu, w którym cząsteczki tego aminokwasu występują głównie w formie jonów obojnaczych. Kwas 2-aminobutanodiowy (asparaginowy) jest dikarboksylowym aminokwasem o wzorze sumarycznym C4H7O4N. Jego punkt izoelektryczny pI = 2,87. Narysuj wzór półstrukturalny (grupowy) jonu, który jest dominującą formą tego aminokwasu w roztworze o pH = 1.
Zadanie 97. (SR10)
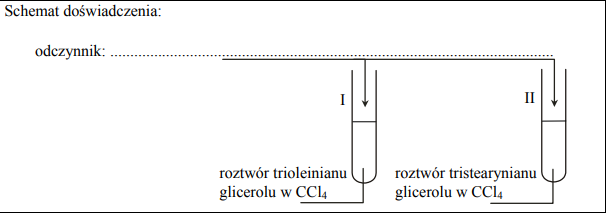
Zaprojektuj doświadczenie, którego przebieg pozwoli na rozróżnienie roztworów dwóch triglicerydów: trioleinianu glicerolu i tristearynianiu glicerolu. a) Uzupełnij schemat doświadczenia, wpisując nazwę odczynnika wybranego spośród następujących: – stężony wodny roztwór wodorotlenku sodu NaOH (aq) – woda bromowa Br2 (aq) – rozcieńczony wodny roztwór kwasu etanowego (octowego) CH3COOH (aq)
Zgodnie z powyższym schematem do probówki I wprowadzono roztwór trioleinianu glicerolu w CCl4, a do probówki II roztwór tristearynianu glicerolu w tym samym rozpuszczalniku. Następnie do obu probówek dodano wybrany odczynnik i ich zawartość energicznie wymieszano. b) Napisz, co potwierdzi obecność roztworu trioleinianu glicerolu w probówce I i roztworu tristearynianu glicerolu w probówce II (porównaj przebieg doświadczenia w obu probówkach).
- Odczynnik: woda bromowa, Br2 (aq)
- Probówka I: woda bromowa uległa odbarwieniu lub zaczęła się odbarwiać
Probówka II: woda bromowa nie uległa odbarwieniu lub nie zaczęła się odbarwiać lub brak zmian lub brak objawów reakcji lub warstwa wodna (woda bromowa) odbarwia się, a warstwa CCl4 zabarwia się na pomarańczowo lub żółto lub brązowo
Zadanie 98. (SR10)
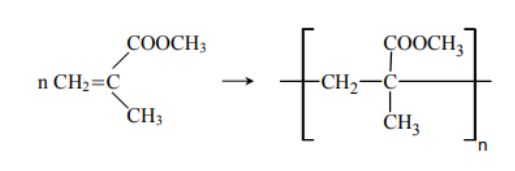
Ester metylowy kwasu 2-metylopropenowego (metakrylan metylu) jest monomerem poli(metakrylanu metylu). Dokończ, stosując wzory półstrukturalne (grupowe), równanie reakcji polimeryzacji tego estru.
Zadanie 99. (SR10)
Poniżej przedstawiono wzór D-arabinozy (w projekcji Fischera).
Uzupełnij poniższy schemat, tak aby otrzymać wzór enancjomeru D-arabinozy.
Zadanie 100. (SR11)
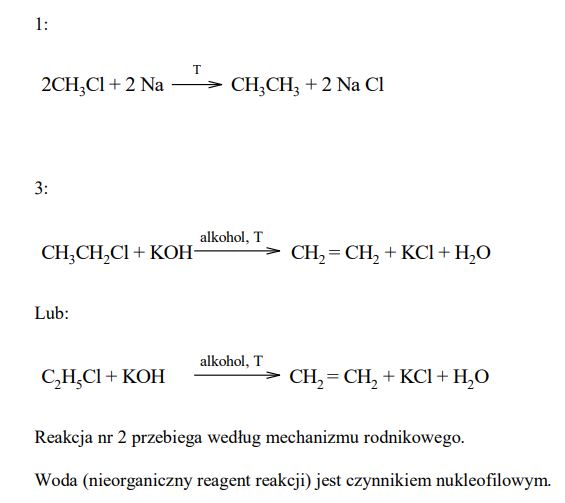
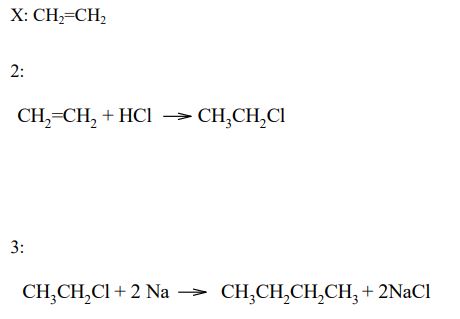
W laboratorium chemicznym alkany można otrzymać kilkoma sposobami, między innymi w reakcji halogenków alkilów z sodem przeprowadzonej w podwyższonej temperaturze. Przemiana ta prowadzi do wydłużenia łańcucha węglowego. Charakterystycznymi dla alkanów są przemiany z substancjami niepolarnymi. Taką reakcją jest podstawienie, np. atomu chloru w miejsce atomu wodoru, przebiegające pod wpływem światła lub ogrzania. Powstająca w tej przemianie monochloropochodna może – w podwyższonej temperaturze i w alkoholowym roztworze wodorotlenku potasu – ulegać reakcji eliminacji, tworząc związek nienasycony. Powstały alken przyłącza wodę w obecności kwasu siarkowego(VI), dając alkohol. Opisane przemiany można przedstawić poniższym schematem.
Napisz, stosując wzory półstrukturalne (grupowe) związków organicznych, równania reakcji oznaczonych na podanym schemacie numerami 1, 3. Skorzystaj z informacji i w równaniach reakcji (nad strzałkami) napisz warunki, w jakich zachodzą te przemiany. Określ, według jakiego mechanizmu: elektrofilowego, nukleofilowego czy rodnikowego przebiega reakcja oznaczona na schemacie numerem 2. Określ, czy nieorganiczny reagent reakcji oznaczonej na schemacie numerem 4 jest czynnikiem elektrofilowym, czy nukleofilowym.
Zadanie 101. (SR11)
Jedną z ogólnych metod określania struktury związku jest degradacja – rozpad cząsteczki związku o nieznanej strukturze na kilka mniejszych cząsteczek, łatwiejszych do zidentyfikowania. Metoda ta jest wykorzystywana do określania położenia podwójnego wiązania w cząsteczkach alkenów. Stosowane jest wówczas ich utlenianie, np. za pomocą roztworu KMnO4, prowadzone w środowisku kwasowym. Podczas tej reakcji, w zależności od budowy cząsteczki alkenu, mogą powstać kwasy karboksylowe, ketony lub tlenek węgla(IV).
Pewien alken utleniany nadmiarem KMnO4 w środowisku kwasowym daje dwa różne kwasy karboksylowe, zaś w reakcji 1 mola tego alkenu z 1 molem wodoru powstaje n-heksan. a) Napisz wzór półstrukturalny (grupowy) tego alkenu b) Podaj nazwy systematyczne dwóch kwasów karboksylowych powstałych podczas utleniania tego alkenu.
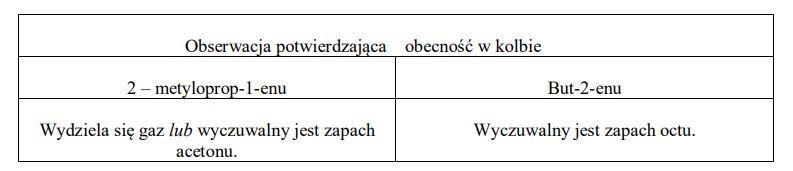
W dwóch nieoznakowanych kolbach znajdowały się dwa alkeny (każdy w innym naczyniu). Wiadomo, że jednym związkiem był 2-metyloprop-1-en, a drugim but-2-en. W celu odróżnienia 2-metyloprop-1-enu od but-2-enu przeprowadzono doświadczenie, podczas którego do obu naczyń dodano zakwaszony, wodny roztwór KMnO4. Korzystając z powyższych informacji, wymień po jednej obserwacji, która pozwoli na odróżnienie obu związków. Uzupełnij poniższą tabelę.
Zadanie 102. (SR11)
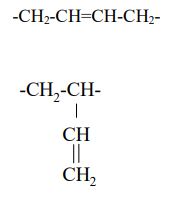
Buta-1,3-dien to związek o wzorze CH2=CH–CH=CH2. Jest on produktem wyjściowym do otrzymywania kauczuku syntetycznego. Polimeryzacja buta-1,3-dienu może przebiegać w położeniach 1, 4 lub 1, 2. W pierwszym przypadku powstają makrocząsteczki o nienasyconych łańcuchach liniowych, w drugim przypadku łańcuch główny polimeru nie zawiera podwójnych wiązań, natomiast występują one w łańcuchach bocznych. Napisz wzory merów obu polimerów, powstających w reakcji polimeryzacji buta-1,3-dienu, wiedząc, że mer to najmniejszy, powtarzający się fragment budowy łańcucha polimeru.
Zadanie 103. (SR11)
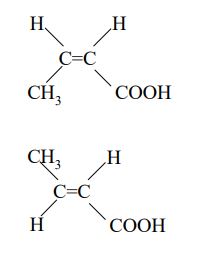
Dwa związki organiczne A i B są względem siebie izomerami. W wyniku bromowania zarówno związku A jak i związku B powstaje kwas 2,3-dibromobutanowy. Narysuj wzory strukturalne związków A i B, tak aby jednoznacznie wskazywały na występujący w nich rodzaj izomerii.
Zadanie 104. (SR11)
Cząsteczki glicerolu, kwasu palmitynowego C15H31COOH i kwasu stearynowego C17H35COOH są achiralne, ale cząsteczki związku powstającego w reakcji glicerolu z tymi kwasami mogą być chiralne. Narysuj wzór triglicerydu, zawierającego reszty kwasów palmitynowego i stearynowego, którego cząsteczki są chiralne.
Zadanie 105. (SR11)
L-arabinoza jest aldopentozą, w cząsteczce której grupa -OH przy atomie węgla połączonym z grupą aldehydową znajduje się po przeciwnej stronie niż grupy -OH przy pozostałych asymetrycznych atomach węgla. Na podstawie podanej informacji uzupełnij rysunek, tak aby był on wzorem L-arabinozy w projekcji Fischera.
Zadanie 106. (SR11)
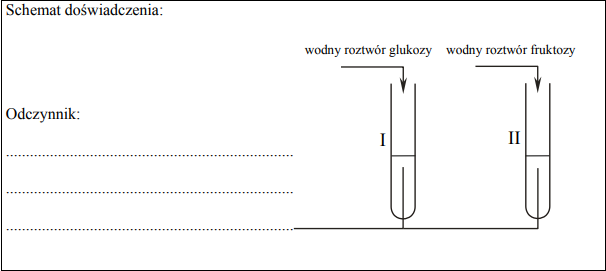
Zaprojektuj doświadczenie, które pozwoli na rozróżnienie wodnych roztworów dwóch cukrów: glukozy i fruktozy. a) Uzupełnij schemat doświadczenia, wpisując nazwę użytego odczynnika wybranego z podanej poniżej listy:
- świeżo wytrącony wodorotlenek miedzi(II)
• woda bromowa z dodatkiem wodnego roztworu wodorowęglanu sodu
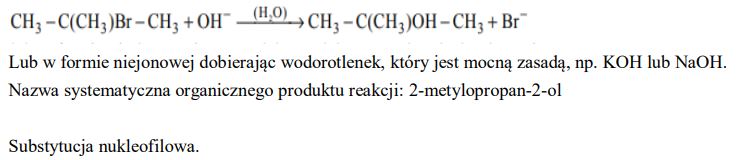
• wodny roztwór azotanu(V) srebra z dodatkiem wodnego roztworu amoniaku.
b) Napisz, jakie obserwacje potwierdzą obecność glukozy w probówce I i fruktozy w probówce II po wprowadzeniu tych substancji do wybranego odczynnika (wypełnij poniższą tabelę).
Zadanie 107. (SR11)
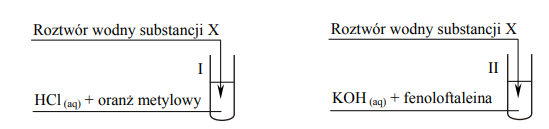
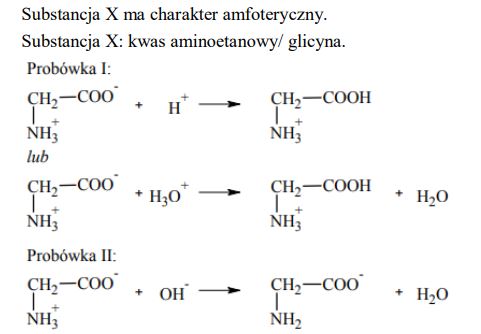
Przeprowadzono doświadczenie zilustrowane poniższym rysunkiem.
W obu probówkach nastąpiła zmiana barwy wskaźników. Korzystając z przeprowadzonego doświadczenia, określ charakter chemiczny substancji X.
Spośród wymienionych związków: benzen, etanol, propanal, kwas aminoetanowy (glicyna) wybierz ten, którego użyto w doświadczeniu jako substancję X, i napisz jego nazwę. Napisz w formie jonowej skróconej równania reakcji przebiegających w probówkach I i II. Zastosuj wzory półstrukturalne (grupowe).
Zadanie 108. (SR11)
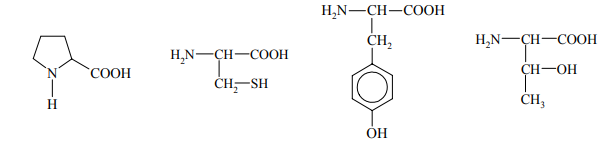
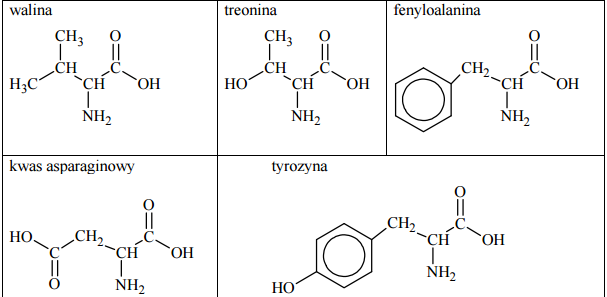
Pewne reakcje chemiczne, którym ulegają niektóre aminokwasy wchodzące w skład białek, stosuje się jako próby rozpoznawcze na obecność białka. Jedną z takich prób jest reakcja ksantoproteinowa. Przeprowadzono doświadczenie, w którym do znajdującego się w probówce białka jaja kurzego dodano stężony kwas azotowy(V) i zaobserwowano pojawienie się osadu o żółtej barwie. Spośród podanych poniżej wzorów aminokwasów podkreśl wzór tego, którego obecność w białku spowodowała powstanie żółtego osadu.
Zadanie 109. (SR11)
Uzupełnij poniższe zdania dotyczące właściwości białek, wpisując w odpowiedniej formie gramatycznej określenia wybrane z poniższego zestawu.
denaturacja, wysolenie, roztwór właściwy, roztwór koloidalny, zawiesina, polarne, niepolarne, hydratacja, dysocjacja, odwracalny, nieodwracalny
Białko jaja kurzego rozpuszcza się w wodzie, tworząc ………………………………………………… . Każda cząsteczka białka w roztworze posiada tzw. otoczkę solwatacyjną. Solwatacja cząsteczek białka jest możliwa ze względu na obecność …………………………………. grup hydroksylowych, karboksylowych i aminowych w łańcuchach bocznych aminokwasów. 2. Otoczkę solwatacyjną białek można zniszczyć przez dodanie do roztworu soli, np. NaCl, której jony są silniej solwatowane. Widoczne jest wtedy wytrącenie białka z roztworu, zwane ……………………………………. . Proces ten jest ………………………………………… . Pod wpływem wysokiej temperatury, soli metali ciężkich czy też stężonych kwasów lub zasad białka wytrącają się z roztworów w sposób ………………………………………….. . Zjawisko to nosi nazwę ………………………………………………… .
Białko jaja kurzego rozpuszcza się w wodzie, tworząc roztwór koloidalny. Każda cząsteczka białka w roztworze posiada tzw. otoczką solwatacyjną. Solwatacja cząsteczek białka jest możliwa ze względu na obecność polarnych grup hydroksylowych, karboksylowych i aminowych w łańcuchach bocznych aminokwasów. 2. Otoczkę solwatacyjną białek można zniszczyć przez dodanie do roztworu soli, np. NaCl, której jony są silniej solwatowane. Widoczne jest wtedy wytrącenie białka z roztworu, zwane wysoleniem. Proces ten jest odwracalny. Pod wpływem wysokiej temperatury, soli metali ciężkich czy też stężonych kwasów lub zasad białka wytrącają się z roztworów w sposób nieodwracalny. Zjawisko to nosi nazwę denaturacji.
Zadanie 110. (SR12)
W reakcji z wodnym roztworem manganianu(VII) potasu eten utlenia się do etano-1,2-diolu (glikolu etylenowego). Wyznacz stopnie utlenienia atomów węgla w cząsteczce etenu i cząsteczce etano-1,2-diolu oraz określ liczbę moli elektronów oddawanych przez 1 mol etenu w opisanej reakcji.
Stopnie utlenienia atomów węgla w cząsteczce etenu: -II
Stopnie utlenienia atomów węgla w cząsteczce etano – 1,2 – diolu: -I
Liczba moli elektronów: 2 mole
Zadanie 111. (SR12)
Na przykładzie reakcji chloru z etanem i chloru z benzenem porównaj mechanizm reakcji substytucji, którym ulegają węglowodory nasycone i aromatyczne. Uzupełnij poniższe zdania, wybierając nazwy spośród podanych w nawiasach (wybrane nazwy podkreśl). 1. Etan ulega reakcji substytucji ( elektrofilowej / nukleofilowej / wolnorodnikowej ). Drobiny, które reagują bezpośrednio z cząsteczkami etanu, to ( atomy chloru Cl / cząsteczki chloru Cl2 / aniony chlorkowe Cl– ). Są one ( rodnikami / elektrofilami / nukleofilami ), które powstają z cząsteczek chloru pod wpływem ( światła / FeCl3 jako katalizatora / rozpuszczalnika ). 2. Benzen ulega reakcji substytucji ( elektrofilowej / nukleofilowej / wolnorodnikowej ). Drobiny, które reagują bezpośrednio z cząsteczkami benzenu, są ( rodnikami / elektrofilami / nukleofilami ). Powstają one z cząsteczek chloru pod wpływem ( światła / FeCl3 jako katalizatora / rozpuszczalnika ).
- Etan ulega reakcji substytucji wolnorodnikowej. Drobiny, które reagują bezpośrednio z cząsteczkami etanu, to atomy chloru Cl*. Są one rodnikami, które powstają z cząsteczek chloru pod wpływem światła.
- Benzen ulega reakcji substytucji elektrofilowej. Drobiny, które reagują bezpośrednio z cząsteczkami benzenu, są elektrofilami. Powstają one z cząsteczek chloru pod wpływem FeCl3 jako katalizatora.
Zadanie 112. (SR12)
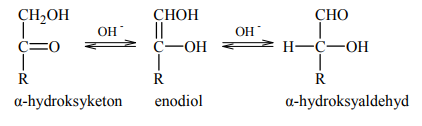
W roztworze o odczynie zasadowym ketony, których cząsteczki zawierają grupę hydroksylową –OH przy atomie węgla połączonym z atomem węgla grupy karbonylowej (α-hydroksyketony), ulegają izomeryzacji. Przemianę tę ilustruje poniższy schemat.
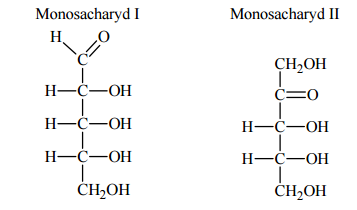
Oceń, czy za pomocą próby Tollensa można odróżnić glukozę od fruktozy. Odpowiedź uzasadnij.
Nie, ponieważ (w środowisku o odczynie zasadowym, jaki ma odczynnik Tollensa), fruktoza przekształca się w aldozę (glukozę lub mannozę).
Zadanie 113. (SR12)
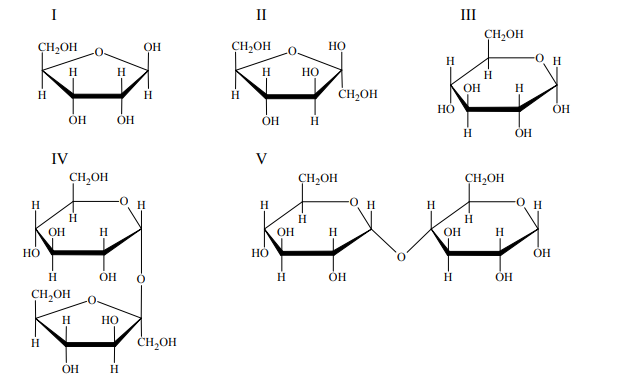
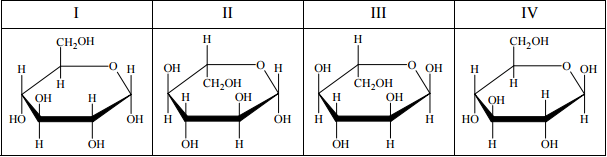
Poniżej przedstawiono wzory (w projekcji Hawortha) ilustrujące budowę wybranych monoi disacharydów. Wskaż wszystkie sacharydy, które dają pozytywny wynik próby Tollensa.
I, II, III, V
Zadanie 114. (SR12)
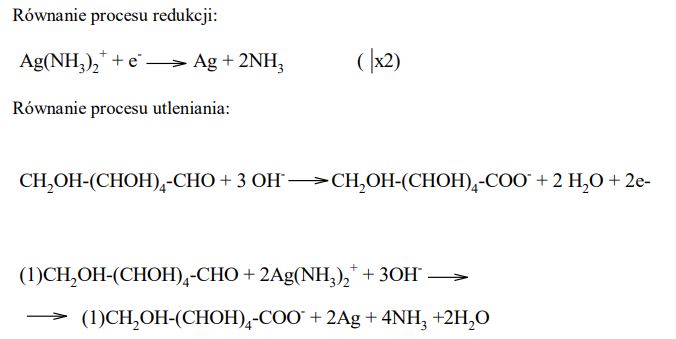
Reakcja glukozy z odczynnikiem Tollensa przebiega zgodnie z poniższym schematem:
Napisz w formie jonowej z uwzględnieniem pobranych lub oddanych elektronów (zapis jonowo-elektronowy) równania procesów redukcji i utleniania. Dobierz i uzupełnij współczynniki stechiometryczne w poniższym schemacie.
Zadanie 115. (SR12)
Pewien alkan o rozgałęzionym łańcuchu węglowym poddano chlorowaniu, otrzymując dwie izomeryczne monochloropochodne o masie molowej M = 92,5 g·mol–1. a) Napisz wzór sumaryczny alkanu poddanego chlorowaniu b) Napisz wzory półstrukturalne (grupowe) obu otrzymanych monochloropochodnych tego alkanu oraz podaj ich nazwy systematyczne.
Zadanie 116. (SR12)
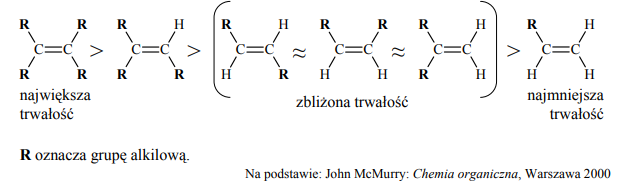
Porównanie efektu cieplnego reakcji katalitycznego uwodornienia alkenów pozwala na porównanie trwałości tych związków. Im mniej ciepła wydziela się w reakcji uwodornienia jednego mola danego alkenu, tym jest on trwalszy. Tak określona trwałość alkenów układa się w następujący szereg:
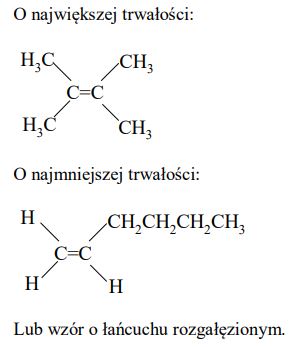
Spośród alkenów o wzorze sumarycznym C6H12 wskaż alken o największej trwałości oraz alken o najmniejszej trwałości. Narysuj wzory półstrukturalne (grupowe) tych alkenów.
Zadanie 117. (SR12)
Uzupełnij poniższą charakterystykę glicerolu (propano-1,2,3-triolu), wybierając jedno określenie spośród podanych w każdym nawiasie. Wybrane określenia podkreśl. 1. W warunkach panujących w laboratorium glicerol jest cieczą, która ( miesza się / nie miesza się ) z wodą i z innymi rozpuszczalnikami polarnymi, a z rozpuszczalnikami niepolarnymi, np. z benzenem, może tworzyć ( emulsje / zawiesiny ). 2. Ponieważ atomom węgla i tlenu w cząsteczkach glicerolu można przypisać hybrydyzację sp3 , cząsteczki glicerolu ( są / nie są ) płaskie.
1.W warunkach panujących w laboratorium glicerol jest cieczą, która ( miesza się / nie miesza się ) z wodą i z innymi rozpuszczalnikami polarnymi, a z rozpuszczalnikami niepolarnymi, np. z benzenem, może tworzyć ( emulsje / zawiesiny ). 2. Ponieważ atomom węgla i tlenu w cząsteczkach glicerolumożna przypisać hybrydyzację sp3 , cząsteczki glicerolu ( są / nie są ) płaskie.
Zadanie 118. (SR12)
W wyniku hydrolizy peptydu o wzorze sumarycznym C8H15O4N3 otrzymano mieszaninę alaniny o wzorze CH3CH(NH2)COOH i glicyny o wzorze CH2(NH2)COOH. Ustal, z ilu reszt alaniny i z ilu reszt glicyny składał się badany peptyd. Posługując się trzyliterowymi symbolami aminokwasów (Ala i Gly), napisz wszystkie możliwe sekwencje badanego peptydu.
Liczba reszt alaniny: 2
Liczba reszt glicyny: 1
Możliwe sekwencje peptydu:
Ala-Ala-Gly
Ala-Gly-Ala
Gly-Ala-Ala
Zadanie 119. (SR12)
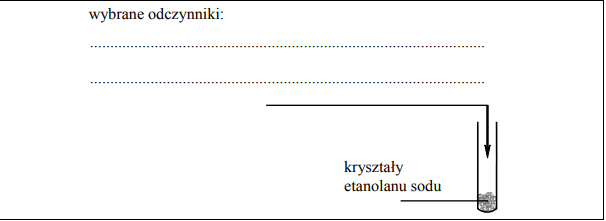
Mając do dyspozycji etanolan sodu, zaplanuj doświadczenie, w którym, wykonując jedną próbę, wykażesz, że etanol ma bardzo słabe właściwości kwasowe. a) Uzupełnij poniższy schemat doświadczenia, wpisując nazwy potrzebnych odczynników wybranych spośród następujących: etanol, woda destylowana, wodny roztwór wodorotlenku sodu , wodny roztwór oranżu metylowego, etanolowy roztwór fenoloftaleiny
Opisz możliwe do zaobserwowania w czasie doświadczenia zmiany potwierdzające fakt, że właściwości kwasowe etanolu są bardzo słabe.
Wybrane odczynniki: woda (destylowana), (etanolowy roztwór) fenoloftaleiny
Zawartość probówki zabarwi się na malinowo lub różowy.
Zadanie 120. (SR12)
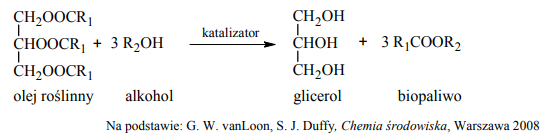
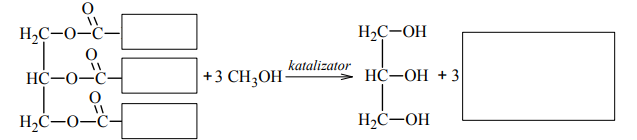
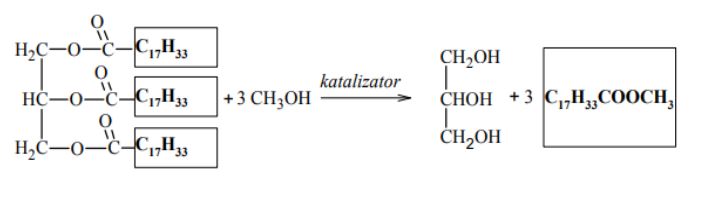
Paliwa do silników wysokoprężnych wytwarzane z ropy naftowej można zastąpić biopaliwami, które otrzymuje się, ogrzewając w obecności katalizatora oleje roślinne z dużą ilością alkoholu. Produktami tej reakcji są glicerol oraz ester kwasu tłuszczowego i użytego alkoholu. Proces ten można zilustrować ogólnym równaniem, w którym R1 i R2 oznaczają grupy węglowodorowe:
Uzupełnij luki w poniższym schemacie, tak aby stanowił on równanie reakcji ilustrujące otrzymywanie biopaliwa z trioleinianu glicerolu.
Zadanie 121. (SR12)
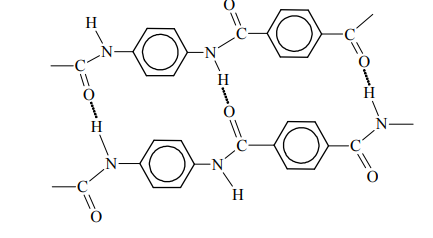
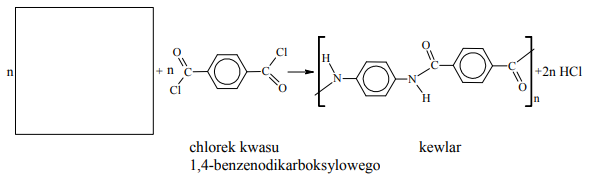
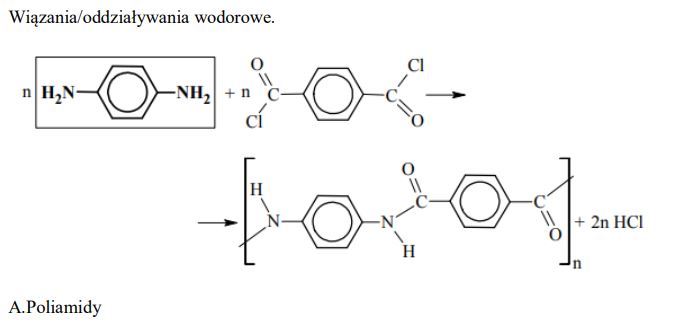
Kewlar to handlowa nazwa poli(tereftalano-1,4-fenyloamidu). Tworzywo to jest około pięciu razy wytrzymalsze od stali, a zarazem około pięciu razy od niej lżejsze. Swoje właściwości kewlar zawdzięcza wysokiemu stopniowi uporządkowania cząsteczek. Ułożenie łańcuchów polimerowych kewlaru przedstawiono na poniższym schemacie.
Podaj nazwę zaznaczonych na schemacie kropkami oddziaływań między atomami dwóch sąsiednich łańcuchów poli(tereftalano-1,4-fenyloamidu).
Kewlar otrzymuje się w reakcji polikondensacji dwóch rodzajów monomerów, z których jednym jest chlorek kwasu 1,4-benzenodikarboksylowego (tereftalowego). Uzupełnij poniższy schemat syntezy kewlaru, wpisując wzór brakującego monomeru.
Zakwalifikuj kewlar do odpowiedniej grupy tworzyw. Podkreśl odpowiedź A, B, C lubD.
A. poliamidy
B. poliestry
C. tworzywa fenolowe
D. żywice epoksydowe
Zadanie 122. (SR13)
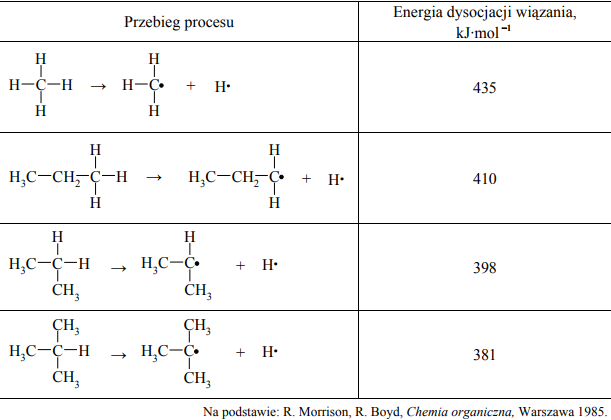
Energia dysocjacji wiązania C–H w alkanach (wyrażona w kJ·mol –1 ) to energia, jaką trzeba dostarczyć, aby przekształcić 1 mol alkanu w 1 mol atomów wodoru i 1 mol odpowiedniego rodnika organicznego. Przykłady takich procesów oraz odpowiadające im energie dysocjacji zestawiono w poniższej tabeli.
Można zauważyć, że łatwość odrywania atomu wodoru od cząsteczki alkanu zależy od rzędowości atomu węgla, z którym jest on połączony.
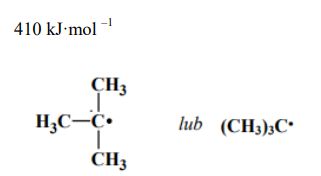
Korzystając z informacji, podkreśl przybliżoną wartość energii dysocjacji wiązania C–H w etanie.
435 kJ·mol –1 410 kJ·mol –1 398 kJ·mol –1 381 kJ·mol –1
Spośród rodników, których wzory podano w informacji, wybierz i napisz wzór tego, który tworzy się najłatwiej.
Zadanie 123. (SR13)
W temperaturze około 80 °C i w obecności kwasu siarkowego(VI) cząsteczki 2-metylopropenu ulegają dimeryzacji zachodzącej według schematu:
W mieszaninie poreakcyjnej stwierdza się obecność dwóch alkenów o podanym wzorze sumarycznym, różniących się położeniem wiązania podwójnego w cząsteczce. W wyniku całkowitego uwodornienia mieszaniny powstaje jeden związek 2,2,4-trimetylopentan. a) Napisz wzory półstrukturalne (grupowe) obu izomerów, powstających w reakcji addycji dwóch cząsteczek 2-metylopropenu b) Określ, według jakiego mechanizmu, nukleofilowego czy elektrofilowego, przebiega reakcja uwodornienia każdego z opisanych izomerów, w wyniku której powstaje 2,2,4-trimetylopentan.
Zadanie 124. (SR13)
Poniżej przedstawiony jest schemat przemian, które w laboratorium chemicznym prowadzą do otrzymania związku Z.
Podaj wzór półstrukturalny (grupowy) związku organicznego X.
Napisz, stosując wzory półstrukturalne (grupowe) związków organicznych, równanie reakcji oznaczonej na schemacie numerem 2 oraz równanie reakcji oznaczonej na schemacie numerem 3.
Zadanie 125. (SR13)
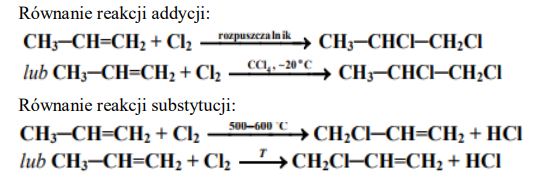
W zależności od warunków przeprowadzania eksperymentu reakcja propenu z chlorem może przebiegać w różny sposób. W temperaturze pokojowej, w obojętnym rozpuszczalniku (np. CCl4) reakcją preferowaną jest addycja. W temperaturze 500–600 °C (w fazie gazowej) reakcją uprzywilejowaną jest substytucja, podczas której podstawieniu ulega atom wodoru w grupie alkilowej. Napisz, stosując wzory półstrukturalne (grupowe) związków organicznych, równania reakcji opisanych w informacji. Zaznacz warunki prowadzenia obu procesów.
Zadanie 126. (SR13)
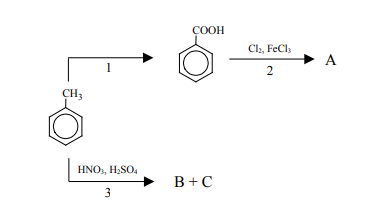
Podstawnik już wprowadzony do pierścienia aromatycznego wywiera wpływ na miejsce wprowadzenia do pierścienia kolejnego podstawnika. Grupy alkilowe, –Cl, –Br, –NH2, –OH kierują kolejny wprowadzany podstawnik w pozycje orto- i para- w stosunku do własnego położenia. Obecność w pierścieniu aromatycznym grupy –NO2, –COOH czy –CHO powoduje, że kolejny podstawnik jest wprowadzany głównie w pozycję meta-. Poniższy schemat ilustruje ciąg przemian chemicznych, w wyniku których powstają związki organiczne A, B i C
Oceń prawdziwość poniższych zdań i uzupełnij tabelę. Wpisz literę P, jeżeli zdanie jest prawdziwe, lub literę F, jeśli jest fałszywe.
Napisz wzory półstrukturalne (grupowe) lub uproszczone związków organicznych B i C, które są głównymi produktami przemiany oznaczonej na schemacie numerem 3. Stosując wzory pólstrukturalne (grupowe) lub uproszczone związków organicznych, napisz równanie reakcji, oznaczonej na schemacie numerem 2, prowadzącej do otrzymania głównego produktu organicznego.
Zadanie 127. (SR13)
W poniższej tabeli podane są wartości stałej dysocjacji wybranych kwasów organicznych w temperaturze 25 °C.
Trzy kwasy HX, HY i HZ różnią się mocą. W temperaturze 25 °C stosunek stałych dysocjacji KHZ : KHY jest równy 0,1. Kwas HX reaguje z solą NaY zgodnie ze schematem:
HX + NaY ® NaX + HY
a) Skorzystaj z powyższej informacji i przyporządkuj wzorom HX, HY, HZ nazwy odpowiednich kwasów.
b) Napisz, jaki wpływ na moc kwasu ma wprowadzenie do pierścienia kwasu benzenokarboksylowego w pozycję orto- kolejnego podstawnika takiego jak –Cl.
- HX: kwas o-chlorobenzoesowy lub kwas o-chlorobenzenokarboksylowy
HY: metanowy lub mrówkowy
HZ: etanowy lub octowy
- Wzrasta moc kwasu.
- Kwas o-chlorobenzenokarboksylowy jest kwasem mocniejszym od kwasu benzenokarboksylowego.
Zadanie 128. (SR13)
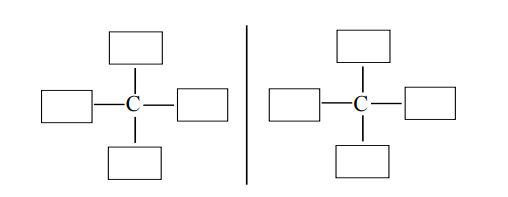
Uzupełnij poniższy schemat, tak aby przedstawiał budowę obu enancjomerów związku organicznego o wzorze sumarycznym C4H10O.
Zadanie 129. (SR13)
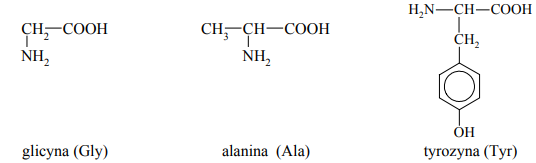
Dane są wzory półstrukturalne (grupowe) trzech aminokwasów
Aminokwasy, których wzory podano powyżej, należą do aminokwasów białkowych. Narysuj wzór tego fragmentu struktury ich cząsteczek, który wskazuje na tę przynależność.
Stosując wzór jonu obojnaczego alaniny (kwasu 2-aminopropanowego), napisz w formie jonowej skróconej równania reakcji zachodzących po wprowadzeniu tego aminokwasu do:
- wodnego roztworu wodorotlenku sodu (reakcja 1.)
- kwasu solnego (reakcja 2.).
-CH(NH2)COOH
Zadanie 130. (SR13)
W trzech naczyniach A, B i C znajdują się oddzielnie: glicyna (Gly), tyrozyna (Tyr) i glicyloalanyloalanina (Gly-Ala-Ala). Po analizie budowy cząsteczek tych związków stwierdzono, że przeprowadzenie reakcji kolejno z dwoma odczynnikami umożliwi ich identyfikację. Jako pierwszy odczynnik wybrano kwas azotowy(V). Na szkiełkach zegarkowych umieszczono próbki identyfikowanych substancji i na każdą naniesiono kroplę stężonego HNO3. Zaobserwowano, że tylko na próbce z naczynia C pojawiło się żółte zabarwienie.
Podaj nazwę substancji znajdującej się w naczyniu C.
W celu zidentyfikowania substancji znajdujących się w naczyniach A i B przygotowano ich wodne roztwory i przeprowadzono drugie doświadczenie, do którego użyto odczynnika wybranego z podanej poniżej listy:
- woda chlorowa
• świeżo strącony wodorotlenek miedzi(II)
• wodny roztwór chlorku żelaza(III). Zaobserwowano powstanie ciemnoniebieskiego roztworu w probówce I oraz roztworu o barwie różowofioletowej w probówce II. Uzupełnij schemat drugiego doświadczenia, wpisując nazwę lub wzór użytego odczynnika wybranego z podanej powyżej listy.
Podaj nazwę substancji znajdującej się w naczyniu A oraz nazwę substancji znajdującej się w naczyniu B. Podaj nazwę reakcji zachodzącej w probówce II.
C: tyrozyna (Tyr)
Odczynnik: świeżo strącony wodorotlenek miedzi (II) / Cu(OH)2
A: Glicyna (Gly)
B: glicynoalanyloalanina (Gly-Ala-Ala)
Reakcja w probówce II to rekacja biuretowa.
Zadanie 131. (SR13)
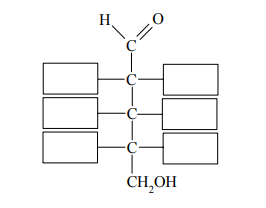
Wzór półstrukturalny (grupowy) ketotriozy można zapisać:
Narysuj wzór półstrukturalny (grupowy) izomeru tego związku, który wykazuje zdolność do występowania w postaci izomerów optycznych.
Zadanie 132. (SR13)
Oceń prawdziwość poniższych zdań i uzupełnij tabelę. Wpisz literę P, jeżeli zdanie jest prawdziwe, lub literę F, jeśli jest fałszywe.
Zadanie 133. (SR14)
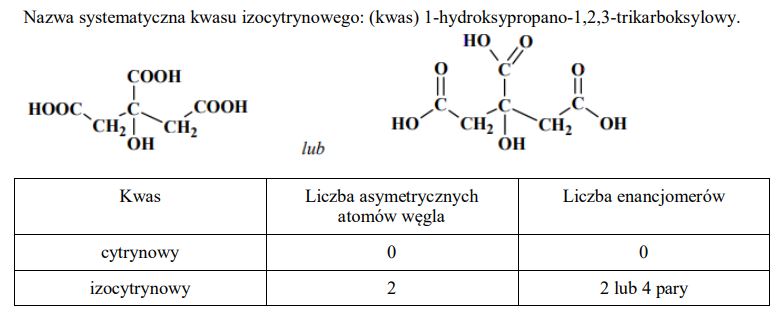
Kwas cytrynowy (kwas 2-hydroksypropano-1,2,3-trikarboksylowy) o składzie C6H8O7 spełnia ważną funkcję w metabolizmie organizmów jako produkt przejściowy cyklu Krebsa, w którym ulega izomeryzacji do kwasu izocytrynowego o następującym wzorze:
Podaj nazwę systematyczną kwasu izocytrynowego.
Napisz wzór półstrukturalny (grupowy) kwasu cytrynowego.
Przeanalizuj budowę cząsteczek kwasu cytrynowego i izocytrynowego ze względu na możliwość wystąpienia enancjomerii (izomerii optycznej). Wpisz w tabeli liczbę asymetrycznych atomów węgla w cząsteczkach tych kwasów oraz liczbe enancjomerów (izomerów optycznych) lub zaznacz ich brak.
Zadanie 134. (SR14)
Do wodnego roztworu kwasu cytrynowego dodano nadmiar wodnego roztworu wodorowęglanu sodu NaHCO3. Stwierdzono, że temperatura mieszaniny poreakcyjnej jest znacznie niższa niż temperatura roztworów przed ich zmieszaniem. Zaobserwowano także wydzielanie bezbarwnego gazu. a) Spośród podanych zależności wybierz i podkreśl tę, która jest prawdziwa dla entalpii procesu dokonującego się w opisanym doświadczeniu.
Napisz w formie cząsteczkowej równanie reakcji, która zaszła w czasie doświadczenia. Przyjmij, że kwas cytrynowy przereagować z wodorowęglanem sodu w stosunku molowym 1 : 3. Zastosuj następujący wzór kwasu cytrynowego: C3H4(OH)(COOH)3.
Zadanie 135. (SR14)
Wytrącanie trudno rozpuszczalnych siarczków metali jest ważną metodą analityczną. W tych reakcjach jako odczynnik stosowany jest siarkowodór, który uzyskuje się w wyniku hydrolizy amidu kwasu tiooctowego (tioacetamidu) o wzorze
Napisz w formie cząsteczkowej równanie reakcji hydrolizy tioacetamidu, posługując się wzorami półstrukturalnymi (grupowymi) reagentów organicznych.
Zadanie 136. (SR14)
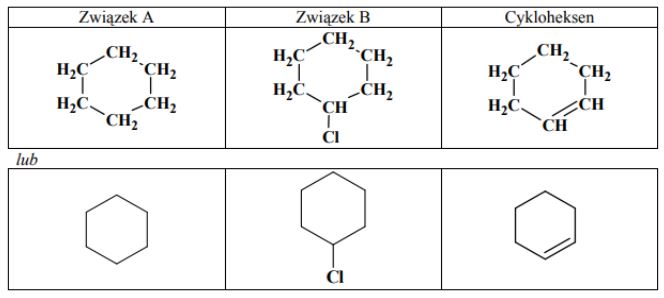
Poniżej przedstawiono ciąg przemian prowadzących do powstania cykloheksenu.
Uzupełnij tabelę, wpisując wzory półstrukturalne (grupowe) lub uproszczone związków organicznych oznaczonych na schemacie literami A i B oraz wzór cykloheksenu.
Zadanie 137. (SR14)
Benzen wrze pod ciśnieniem 1000 hPa (1 bar) w temperaturze 352,2 K. Standardowa molowa entalpia parowania benzenu w temperaturze przemiany wynosi 30,8 kJ · mol–1.
P.W. Atkins, Chemia fizyczna, Warszawa 2001.
Na podstawie powyższej informacji oceń, czy skraplanie benzenu w temperaturze 352,2 K jest przemianą egzo- czy endotermiczną.
Reakcja egzotermiczna.
Zadanie 138. (SR14)
Reakcja kwasu etanowego (octowego) z etanolem prowadzona w obecności mocnego kwasu jest reakcją odwracalną, która przebiega według równania:
Stężeniowa stała równowagi tej reakcji w temperaturze 25 °C wynosi Kc = 4,0. Badając kinetykę reakcji kwasu etanowego z etanolem w środowisku wodnym, stwierdzono, że względny rząd reakcji dla etanolu i kwasu etanowego wynosi 1, a całkowity rząd reakcji jest równy 2. Rząd reakcji ze względu na wybrany substrat to wykładnik potęgi, w której stężenie molowe danego substratu występuje w równaniu kinetycznym tej reakcji.
Na podstawie: P. Mastalerz, Chemia organiczna, Wrocław 2000.
Napisz równanie kinetyczne opisanej reakcji estryfikacji.
Podkreśl wszystkie wymienione poniżej działania, które spowodują zwiększenie wydajności opisanej reakcji estryfikacji w temperaturze 25 °C.
dodanie etanolu dodanie wody dodanie katalizatora dodanie obojętnej wobec reagentów substancji higroskopijnej.
Zadanie 139. (SR14)
Poniżej przedstawiono schemat przemian, jakim ulegają pochodne węglowodorów. Symbolami R i R1 oznaczono grupy alkilowe.
Wypełnij tabelę, wpisując ogólne wzory pochodnych związku RCH2OH, które na schemacie oznaczono numerami I–IV.
Zadanie 140. (SR14)
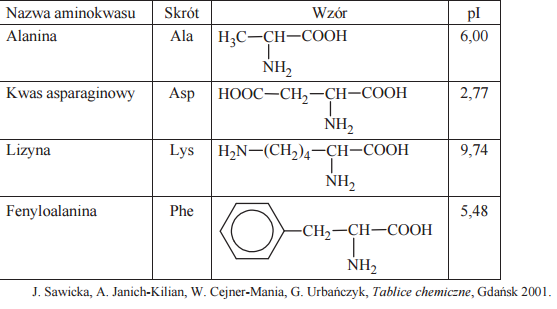
W poniższej tabeli przedstawiono wybrane dane na temat czterech aminokwasów białkowych. Symbol pI oznacza punkt izoelektryczny, który jest taką wartością pH roztworu, w którym stężenie jonu obojnaczego osiąga maksymalną wartość, natomiast stężenia formy anionowej i kationowej mają jednakową, najmniejszą wartość.
Określ liczbę wszystkich możliwych organicznych niecyklicznych produktów kondensacji jednej cząsteczki alaniny z jedną cząsteczką kwasu asparaginowego.
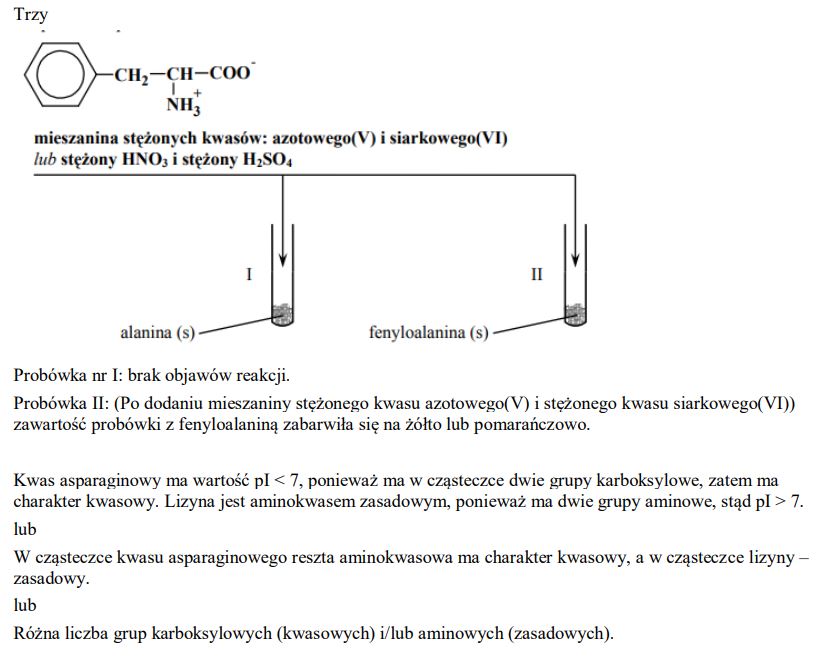
Napisz wzór tej formy fenyloalaniny, której stężenie jest największe w roztworze o pH równym 5,48.
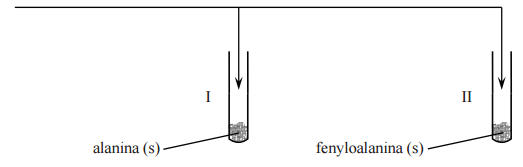
Zaplanuj doświadczenie, którego przebieg pozwoli na odróżnienie alaniny od fenyloalaniny. a) Uzupełnij poniższy schemat doświadczenia, wpisując nazwę odczynnika, po którego dodaniu do obu probówek i ogrzaniu ich zawartości możliwe będzie zaobserwowanie różnic w przebiegu doświadczenia z udziałem alaniny i fenyloalaniny. Odczynnik wybierz spośród następujących:
− wodny roztwór chlorku żelaza(III)
− świeżo strącony wodorotlenek miedzi(II)
− wodny roztwór wodorotlenku sodu z fenoloftaleiną
− rozcieńczony kwas solny z oranżem metylowym
− mieszanina stężonych kwasów: azotowego(V) i siarkowego(VI)
a) Opisz zmiany możliwe do zaobserwowania w czasie doświadczenia, pozwalające na odróżnienie alaniny od fenyloalaniny.
b) Wskaż przyczynę różnicy wartości punktu izoelektrycznego kwasu asparaginowego i lizyny.
Zadanie 141. (SR14)
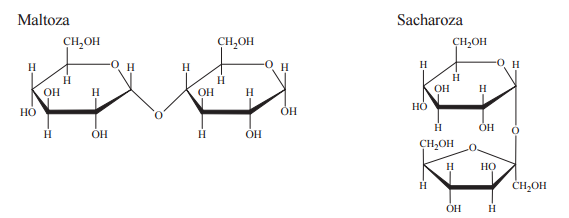
Poniżej przedstawiono wzory (w projekcji Hawortha) dwóch disacharydów: maltozy i sacharozy.
W oddzielnych probówkach przygotowano wodne roztwory maltozy oraz sacharozy i dodano do nich świeżo strącony wodorotlenek miedzi(II). Następnie zawartość obu probówek zalkalizowano i ogrzano. W warunkach doświadczenia w probówce zawierającej roztwór maltozy zaobserwowano powstanie ceglastego osadu, natomiast w probówce z roztworem sacharozy wytrącić się czarny osad. Wypełnij tabelę, wpisując literę P, jeżeli zdanie jest prawdziwe, lub literę F, jeżeli jest fałszywe.
Zadanie 142. (SR15)
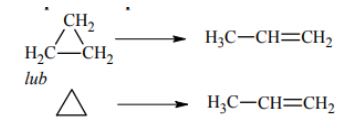
W odpowiednich warunkach cyklopropan przekształca się w propen według schematu cyklopropan (g) → propen (g)
Napisz równanie opisanej reakcji. Zastosuj wzory półstrukturalne (grupowe) lub uproszczone.
Zadanie 143. (SR15)
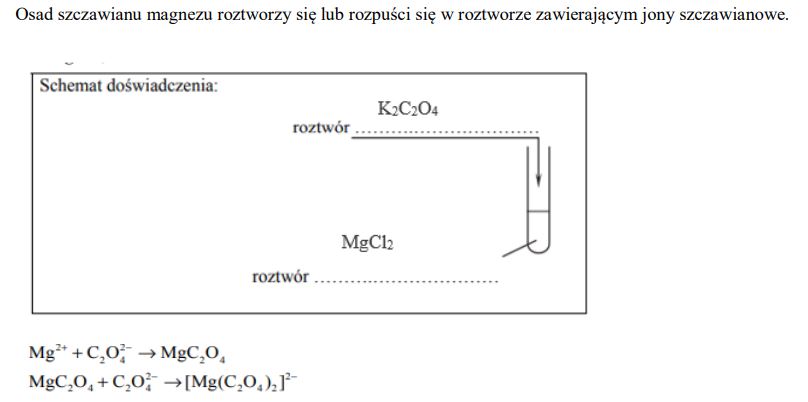
Kwas szczawiowy (etanodiowy) to najprostszy kwas dikarboksylowy o wzorze sumarycznym H2C2O4. Szczawian magnezu MgC2O4 jest bezbarwnym krystalicznym ciałem stałym, które trudno rozpuszcza się w wodzie. Kationy magnezu mają zdolność tworzenia z anionami szczawianowymi jonów kompleksowych o wzorze [Mg(C2O4)2]2–. Sole zawierające ten jon są rozpuszczalne w wodzie. W poniższej tabeli przedstawiono informacje o rozpuszczalności w wodzie szczawianów wybranych metali w temperaturze pokojowej.
Sformułuj hipotezę na temat zachowania szczawianu magnezu w kontakcie z roztworem zawierającym jony szczawianowe. Uwzględnij wytrącanie lub roztwarzanie związków magnezu.
Zaprojektuj doświadczenie, którego przebieg potwierdzi sformułowaną hipotezę. Uzupełnij poniższy schemat − wpisz wzory soli wybranych spośród następujących:
− CaC2O4
− K2C2O4
− MgCl2
− MgCO3
Napisz w formie jonowej skróconej równania reakcji zachodzących w czasie doświadczenia.
Zadanie 144. (SR15)
Podczas rozładowywania (czerpania prądu) akumulatora kwasowo-ołowiowego zachodzą procesy opisane sumarycznym równaniem (PbO2 jest nierozpuszczalny w wodzie):
Ze względu na zmianę stężenia roztworu, która zachodzi w akumulatorze w czasie jego pracy, stopień rozładowania akumulatora można określić przez pomiar gęstości tego roztworu.
Na podstawie: K.-H. Lautenschläger, W. Schröter, A. Wanninger, Nowoczesne kompendium chemii, Warszawa 2007.
Napisz wzór elektrolitu, którego zmiany stężenia są podstawą określania stopnia rozładowania akumulatora. Zaznacz, jak zmienia się (zwiększa się albo zmniejsza się) to stężenie w czasie rozładowywania akumulatora.
Napisz sumaryczne równanie procesów zachodzących podczas ładowania akumulatora kwasowo-ołowiowego.
Zadanie 145. (SR15)
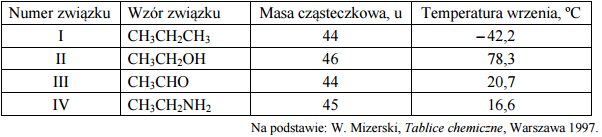
W poniższej tabeli zestawiono wartości temperatury wrzenia (pod ciśnieniem 1013 hPa) alkanu, alkanolu, alkanalu i alkiloaminy o zbliżonych masach cząsteczkowych.
Spośród związków o wzorach podanych w tabeli wybierz substancję najmniej i najbardziej lotną. Napisz wzory wybranych związków.
Uszereguj związki o wzorach podanych w tabeli według wzrastającej siły oddziaływań występujących między cząsteczkami danego związku. Napisz numery, którymi oznaczono wzory tych substancji.
Opisz przyczynę różnicy temperatury wrzenia alkanu i aldehydu oraz przyczynę różnicy temperatury wrzenia aldehydu i alkoholu. Odnieś się do budowy cząsteczek związków, których wzory wymieniono w tabeli.
Najmniej lotna: CH3CH2OH
Najbardziej lotna: CH3CH2CH3
I IV III II
lub
CH3CH2CH3 CH3CH2NH2 CH3CHO CH3CH2OH
Alkan i aldehyd: Między cząsteczkami aldehydu zachodzą silniejsze oddziaływania niż między cząsteczkami alkanu, ponieważ w jego cząsteczkach istnieją fragmenty polarne (grupa =CO).
Aldehyd i alkohol: Między cząsteczkami alkoholu zachodzą silniejsze oddziaływania niż między cząsteczkami aldehydu, ponieważ w cząsteczkach alkoholu istnieją grupy –OH zdolne do tworzenia wiązań wodorowych.
Zadanie 146. (SR15)
Napisz, czy wzór półstrukturalny CH3–CH2–CH=CH2 odpowiada dwóm izomerom geometrycznym cis-trans. Odpowiedź uzasadnij.
Nie, ponieważ pierwszy atom węgla jest połączony z dwoma atomami wodoru.
Lub
Nie, gdyż jeden z atomów węgla o hybrydyzacji sp 2 jest połączony z dwoma atomami wodoru.
Zadanie 147. (SR15)
Napisz, czy związek o wzorze półstrukturalnym CH3–CH2–CHBr–CH3 występuje w postaci pary enancjomerów. Odpowiedź uzasadnij.
Tak, ponieważ drugi atom węgla jest asymetryczny.
Lub
Tak, ponieważ cząsteczka ma centrum stereogeniczne.
Lub
Tak, ponieważ cząsteczka jest chiralna.
Lub
Narysowanie wzorów półstrukturalnych obu enancjomerów.
Zadanie 148. (SR15)
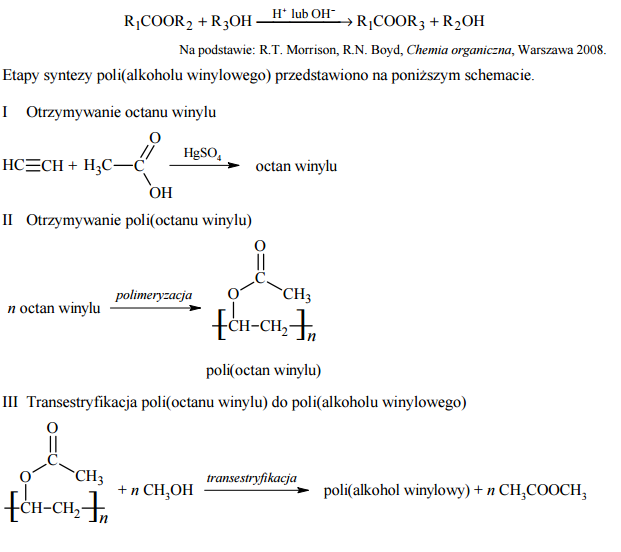
Poli(alkohol winylowy), PVA, jest polimerem łatwo rozpuszczalnym w wodzie. Otrzymuje się go w reakcji transestryfikacji poli(octanu winylu). Reakcja transestryfikacji polega na wyparciu cząsteczki jednego alkoholu z grupy estrowej estru przez cząsteczkę drugiego alkoholu. Reakcja ta zachodzi w środowisku o odczynie kwasowym lub zasadowym zgodnie z następującym równaniem, w którym –R1, –R2 i –R3 oznaczają grupy węglowodorowe:
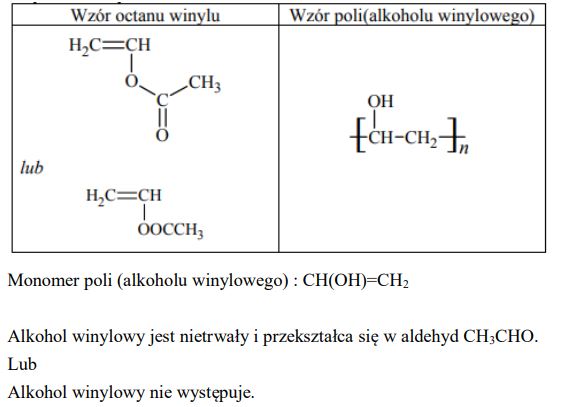
Napisz wzory półstrukturalne (grupowe) octanu winylu i poli(alkoholu winylowego).
Narysuj wzór półstrukturalny (grupowy) monomeru poli(alkoholu winylowego). Wyjaśnij, dlaczego PVA nie może być otrzymany bezpośrednio ze swojego monomeru.
Zadanie 149. (SR15)
Hydrolizę estrów katalizują zarówno zasady, jak i kwasy. W warunkach hydrolizy zasadowej kwas karboksylowy otrzymuje się w postaci soli, z której może on zostać wyparty przez mocny kwas nieorganiczny.
Napisz w formie jonowej skróconej równanie hydrolizy octanu etylu w środowisku zasadowym.
Napisz w formie jonowej skróconej równanie reakcji, w której z soli kwasu octowego rozpuszczonej w wodzie otrzymuje się kwas octowy przez dodanie mocnego kwasu nieorganicznego.
Zadanie 150. (SR15)
Stała dysocjacji etyloaminy Kb w temperaturze 25 ºC ma wartość 4,4 · 10–4, a stała dysocjacji aniliny Kb w tej samej temperaturze jest równa 4,0 · 10–10.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 1997.
Napisz nazwę tej spośród wymienionych amin, która jest mocniejszą zasadą.
Etyloamina
Zadanie 151. (SR15)
Poniżej przedstawiono nazwy oraz wzory pięciu aminokwasów białkowych. Budowę ich cząsteczek można zilustrować ogólnym wzorem R–CH(NH2)–COOH, w którym R oznacza atom wodoru lub łańcuch boczny.
Zaznacz literę P, jeżeli informacja jest prawdziwa, lub literę F, jeżeli jest fałszywa
Poniżej przedstawiono wzory dwóch dipeptydów powstałych w reakcji kondensacji kwasu asparaginowego i waliny. Wskaż dipeptyd (I albo II), który mógł być produktem częściowej hydrolizy łańcucha polipeptydowego naturalnego białka. 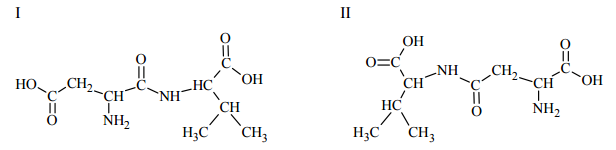
Zadanie 152. (SR16)
W celu potwierdzenia, że pochodna toluenu o wzorze:
Zawiera w swojej cząsteczce chlor, przeprowadzono trzyetapowe doświadczenie, którego przebieg opisano poniżej.
Etap I Do probówki z badaną substancją dodano nadmiar wodnego roztworu wodorotlenku sodu. Mieszaninę łagodnie ogrzano.
Etap II Uzyskaną w etapie I mieszaninę zakwaszono kwasem X.
Etap III Do mieszaniny otrzymanej w etapie II dodano wodny roztwór azotanu(V) srebra.
Opisz obserwacje towarzyszące przebiegowi etapu III doświadczenia i zapisz w formie jonowej skróconej równanie zachodzącej w tym etapie reakcji.
Napisz, dlaczego przed przeprowadzeniem etapu III należało do mieszaniny dodać kwas.
Spośród kwasów, których wzory podano poniżej, wybierz ten, który mógł zostać użyty w etapie II doświadczenia. Podkreśl jego wzór.
HCl HNO3 H3PO4
Obserwacje: Wytrąca się osad.
Równanie reakcji: Ag+ + Cl− → AgCl
W celu usunięcia nadmiaru jonów OH−, które reagują z jonami Ag+ po dodaniu wodnego roztworu AgNO3. lub Zaszłaby reakcja 2Ag+ + 2OH− → Ag2O + H2O.
HNO3
Zadanie 153. (SR16)
Propano-1,2,3-triol (glicerol) można otrzymać z propenu w trzyetapowym procesie. Propen poddaje się reakcji z chlorem w fazie gazowej w temperaturze 500 °C. Ponieważ warunki te sprzyjają rodnikowemu mechanizmowi reakcji, nie następuje przyłączenie chloru do wiązania podwójnego, ale podstawienie jednego atomu chloru w grupie metylowej z utworzeniem 3-chloroprop-1-enu (reakcja numer 1). Powstały związek ulega hydrolizie, w wyniku czego powstaje nienasycony alkohol. Ponieważ większość halogenków reaguje z wodą zbyt wolno, aby reakcja przeprowadzana w ten sposób mogła mieć praktyczne znaczenie, hydrolizę prowadzi się, działając na halogenek wodnym roztworem wodorotlenku sodu lub potasu (reakcja numer 2). Otrzymany alkohol reaguje z nadtlenkiem wodoru w obecności katalizatora, w wyniku czego tworzy się propano-1,2,3-triol (reakcja numer 3). Opisany trzyetapowy proces otrzymywania propano-1,2,3-triolu zilustrowano schematem.
Napisz równania reakcji oznaczonych numerami 1, 2 oraz 3, stosując wzory półstrukturalne (grupowe) związków organicznych. Jeżeli reakcja wymaga użycia katalizatora, odpowiedniego środowiska lub ogrzewania, napisz to nad strzałką równania reakcji.
Zadanie 154. (SR16)
Aldehyd cynamonowy to związek o wzorze:
Aldehyd ten występuje w przyrodzie w konfiguracji trans.
Napisz wzór izomeru trans aldehydu cynamonowego.
Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeżeli jest fałszywa.
Zadanie 155. (SR16)
Poniżej przedstawiono wzory dwóch monosacharydów.
Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeżeli jest fałszywa.
- F
- F
- P
Zadanie 156. (SR16)
Poniżej przedstawiono wzory Hawortha czterech odmian glukozy.
Podaj numery wzorów przedstawiających – odpowiednio – α-D-glukopiranozę, anomer związku opisanego wzorem II, enancjomer związku opisanego wzorem III.
I, III, I
Zadanie 157. (SR16)
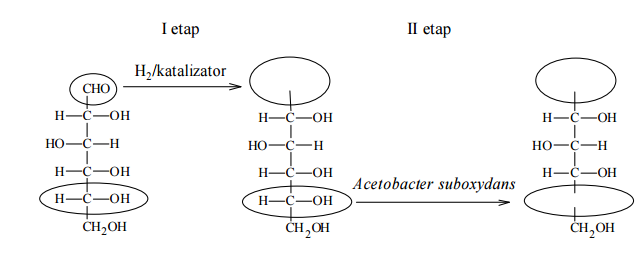
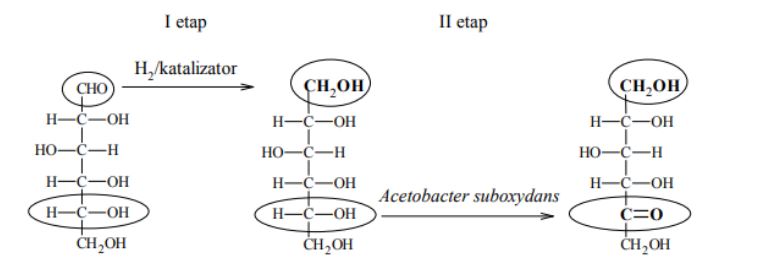
W produkcji witaminy C na skalę przemysłową wykorzystuje się metody chemiczne i biotechnologiczne. W pierwszym etapie pięcioetapowej syntezy glukoza jest redukowana do sorbitu (sorbitolu), który w następnym etapie poddany zostaje utlenieniu. Ponieważ nie ma takiego odczynnika chemicznego, który w sposób wystarczająco selektywny utleniłby tylko jedną z grup hydroksylowych do grupy karbonylowej, proces ten prowadzony jest enzymatycznie przy udziale mikroorganizmów Acetobacter suboxydans. Przebieg dwóch pierwszych etapów syntezy witaminy C zilustrowano na poniższym schemacie.
Na podstawie: John McMurry, Chemia organiczna, Warszawa 2000.
Uzupełnij wzory produktów I i II etapu syntezy witaminy C – wpisz w zaznaczone pola wzory odpowiednich fragmentów ich cząsteczek.
Zadanie 158. (SR16)
Glicyna (kwas aminoetanowy) zaliczana jest do aminokwasów obojętnych, które charakteryzują się punktami izoelektrycznymi w zakresie pH 5,0–6,5. Reaguje z kwasami i zasadami, a w odpowiednich warunkach ulega reakcji kondensacji. Po wprowadzeniu glicyny do świeżo uzyskanej zawiesiny wodorotlenku miedzi(II) tworzy się rozpuszczalny w wodzie związek kompleksowy, a powstający roztwór przyjmuje ciemnoniebieskie zabarwienie.
Na podstawie: J. McMurry, Chemia organiczna, Warszawa 2005.
W wyniku kondensacji glicyny otrzymano peptyd, któremu można przypisać wzór:
Ustal liczbę wiązań peptydowych w cząsteczce tego peptydu
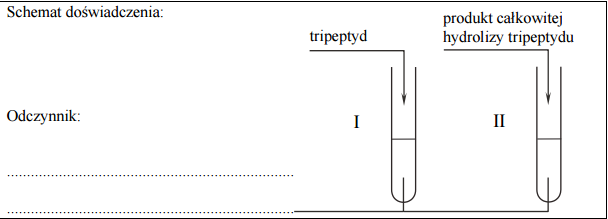
W dwóch probówkach I i II umieszczono pewien odczynnik. Następnie do probówki I wprowadzono tripeptyd o sekwencji Gly-Gly-Gly, a do probówki II dodano produkt całkowitej hydrolizy tego tripeptydu. Objawy reakcji – zaobserwowane w obu probówkach – pozwoliły na potwierdzenie, że do probówki I dodano tripeptyd, a do probówki II – produkt jego całkowitej hydrolizy. Uzupełnij schemat doświadczenia – wybierz i wpisz nazwę lub wzór użytego odczynnika:
– woda bromowa
– świeżo strącony wodorotlenek miedzi(II)
– stężony roztwór kwasu azotowego(V)
– wodny roztwór wodorowęglanu sodu
Wpisz do tabeli barwy roztworów otrzymanych w probówkach I i II po zakończeniu doświadczenia.
Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeżeli jest fałszywa.
Wiązania peptydowe: 5
Odczynnik: świeżo strącony wodorotlenek miedzi (II) lub Cu(OH)2
Probówka I: fioletowa/różowofioletowa/różowa
Probówka II: ciemnoniebieska/niebieska
- P
- F
- F
Zadanie 159. (SR17)
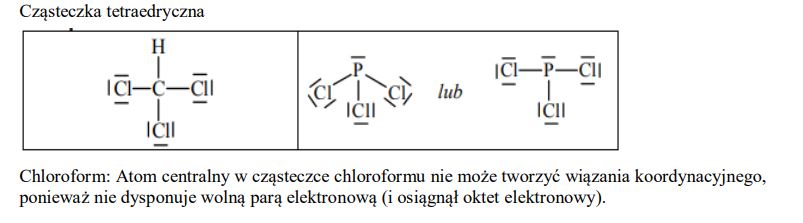
Chloroform (trichlorometan) o wzorze CHCl3 i trichlorek fosforu o wzorze PCl3 są związkami kowalencyjnymi.
Określ kształt cząsteczki chloroformu (cząsteczka tetraedryczna, płaska, liniowa).
Narysuj wzór elektronowy cząsteczki CHCl3 oraz wzór elektronowy cząsteczki PCl3 – zaznacz kreskami wiązania chemiczne oraz wolne pary elektronowe.
Oceń, czy atom centralny w cząsteczce chloroformu i w cząsteczce trichlorku fosforu może tworzyć wiązanie koordynacyjne. Odpowiedź uzasadnij.
Zadanie 160. (SR17)
W procesie parowego reformingu metanu (konwersji metanu z parą wodną) w pierwszym etapie ten gaz reaguje z parą wodną w obecności katalizatora niklowego – w temperaturze około 1070 K i pod ciśnieniem około 3 · 104 hPa – zgodnie z równaniem:
Pomimo że stechiometryczny stosunek molowy substratów reakcji jest równy 1, ten proces prowadzi się przy nadmiarze pary wodnej.
Określ, czy wzrost temperatury wpływa na zwiększenie wydajności opisanej reakcji konwersji, jeżeli zachodzi ona pod stałym ciśnieniem p, oraz czy wzrost ciśnienia skutkuje wzrostem wydajności tej reakcji. Odpowiedź uzasadnij.
Szybkość opisanej reakcji wzrasta ze wzrostem ciśnienia. Poniżej zestawiono warunki, w jakich przeprowadza się opisany proces parowego reformingu metanu:
I temperatura około 1070 K
II ciśnienie około 3 · 104 hPa
III katalizator niklowy IV stosunek molowy nH2O : nCH4 > 1
Dokończ poniższe zdania – wpisz numery wszystkich warunków prowadzenia procesu, które wpływają na szybkość i wydajność konwersji metanu.
- Warunki sprzyjające dużej szybkości reakcji: …………………………………………………………….
- Warunki sprzyjające dużej wydajności reakcji: …………………………………………………………..
Wpływ wzrostu temperatury na wydajność reakcji (p = const) i uzasadnienie:
Tak, wzrost temperatury powoduje zwiększenie wydajności tworzenia CO i H2, ponieważ przemiana ta jest endotermiczna (ΔH > 0). Zgodnie z regułą przekory wydajność reakcji endotermicznej wzrasta ze wzrostem temperatury.
Wpływ wzrostu ciśnienia na wydajność reakcji (T = const) i uzasadnienie:
Nie, wzrost ciśnienia nie skutkuje wzrostem wydajność przemiany metanu, ponieważ łączna liczba moli gazowych substratów jest mniejsza od łącznej liczby moli gazowych produktów. Wzrost ciśnienia powoduje zmniejszenie wydajności tej przemiany.
- Warunki sprzyjające dużej szybkości reakcji: I, II, III.
- Warunki sprzyjające dużej wydajności reakcji: I, IV.
Zadanie 161. (SR17)
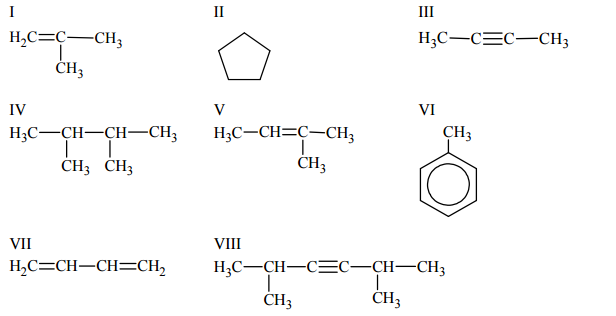
Poniżej przedstawiono wzory ośmiu węglowodorów:
Uzupełnij tabelę – wpisz numery, którymi oznaczono wzory odpowiednich węglowodorów.
Napisz nazwy systematyczne węglowodorów, których wzory oznaczono numerami V i VIII.
Zadanie 162. (SR17)
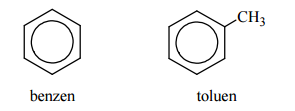
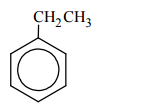
Poniżej przedstawiono wzory dwóch węglowodorów – benzenu i toluenu:
Temperatura topnienia benzenu (pod ciśnieniem atmosferycznym) wynosi 5,53 ºC.
Oceń, czy temperatura topnienia toluenu pod ciśnieniem atmosferycznym jest wyższa, czy – niższa od 5,53 ºC.
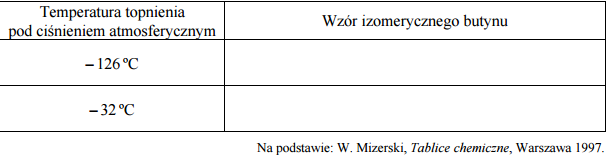
Dwa izomeryczne butyny, których cząsteczki mają budowę łańcuchową, znacznie się różnią temperaturą topnienia. W poniższej tabeli podano wartość temperatury topnienia (pod ciśnieniem atmosferycznym) każdego z tych izomerów. Uzupełnij tabelę – wpisz wzory półstrukturalne (grupowe) obu izomerycznych butynów przy odpowiedniej wartości temperatury topnienia.
Temperatura topnienia toluenu pod ciśnieniem atmosferycznym jest niższa od 5,53 ºC, ponieważ cząsteczka toluenu ma mniej elementów symetrii niż cząsteczka benzenu.
-126oC CH3CH2C≡CH
-32oC CH3C≡CCH3
Zadanie 163. (SR17)
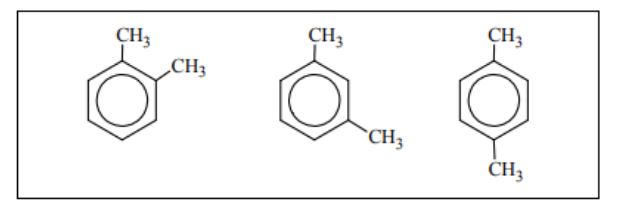
Napisz wzory uproszczone wszystkich pochodnych benzenu, które są izomerami związku o wzorze:
Zadanie 164. (SR17)
W reakcji monochlorowania propanu, która zachodzi w temperaturze 25 ºC pod wpływem światła, powstają dwa izomery: 1-chloropropan z wydajnością 45% i 2-chloropropan z wydajnością 55%. Reakcja monobromowania propanu, przebiegająca w temperaturze 127 ºC pod wpływem światła, prowadzi do powstania analogicznych izomerów, ale w innych proporcjach: 1-bromopropan otrzymuje się z wydajnością równą 3%, a 2-bromopropan – z wydajnością 97%. W reakcji bromowania obserwuje się więc dużą selektywność w stosunku do atomu wodoru ulegającego podstawieniu.
Na podstawie: R.T. Morrison, R.N. Boyd, Chemia organiczna, t. 1, Warszawa 2008.
Wybierz i podkreśl w każdym nawiasie poprawne uzupełnienie poniższych zdań. W opisanej reakcji halogenowania alkanów łatwiej ulega podstawieniu atom wodoru połączony z atomem węgla o (niższej / wyższej) rzędowości. Atom halogenu tym bardziej selektywnie atakuje cząsteczkę alkanu, im jest (bardziej / mniej) reaktywny.
W opisanej reakcji halogenowania alkanów łatwiej ulega podstawieniu atom wodoru połączony z atomem węgla o (niższej / wyższej) rzędowości. Atom halogenu tym bardziej selektywnie atakuje cząsteczkę alkanu, im jest (bardziej / mniej) reaktywny.
Zadanie 165. (SR17)
Spośród izomerycznych alkenów o wzorze sumarycznym C6H12 tylko alkeny A i B utworzyły w reakcji z HCl (jako produkt główny) halogenek alkilowy o wzorze:
O tych alkenach wiadomo także, że alken A występuje w postaci izomerów geometrycznych cis–trans, a alken B – nie.
Napisz wzory półstrukturalne (grupowe) alkenów A i B. Wyjaśnij, dlaczego alken B nie występuje w postaci izomerów geometrycznych cis–trans.
A: CH3CH=C(CH3)CH2CH3
B: CH2=C(CH2CH3)2
Przy każdym z atomów o hybrydyzacji sp2 są dwa identyczne podstawniki.
Lub
Przy jednym z atomów węgla połączonych wiązaniem podwójnym są dwa identyczne podstawniki (dwie identyczne grupy alkilowe).
Lub
Przy jednym z atomów węgla połączonych wiązaniem podwójnym są dwa identyczne podstawniki (dwa atomy wodoru).
Zadanie 166. (SR17)
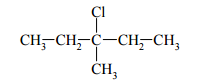
Halogenki alkilów ulegają zasadowej hydrolizie. Napisz w formie jonowej, stosując wzory półstrukturalne (grupowe) związków organicznych, równanie hydrolizy zasadowej 2-bromo-2-metylopropanu. Napisz nazwę systematyczną organicznego produktu tej reakcji. Określ mechanizm (elektrofilowy, nukleofilowy, rodnikowy) opisanej reakcji.
Zadanie 167. (SR17)
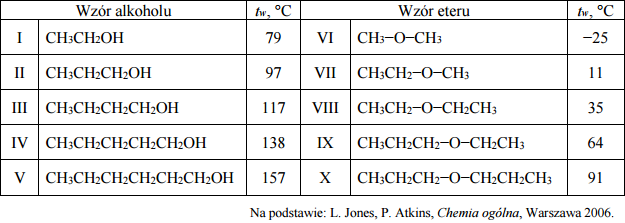
Etery są związkami o wzorze R−O−R’, przy czym R i R’ mogą być zarówno grupami alkilowymi, jak i arylowymi. W poniższej tabeli zestawiono wartości temperatury wrzenia tw (pod ciśnieniem 1013 hPa) wybranych alkoholi oraz wybranych eterów o nierozgałęzionych cząsteczkach.
Czy alkohole i etery o tej samej liczbie atomów węgla w cząsteczce są izomerami? Uzasadnij swoją odpowiedź. Odnieś się do związków, których wzory wymieniono w tabeli.
Spośród związków o wzorach podanych w tabeli wybierz substancję najmniej lotną i substancję najbardziej lotną. Napisz numery, którymi oznaczono wzory wybranych związków. Następnie wyjaśnij, dlaczego etery są bardziej lotne niż alkohole o tej samej masie cząsteczkowej. Odnieś się do budowy cząsteczek związków, których wzory wymieniono w tabeli.
Alkohole i etery o tej samej liczbie atomów węgla w cząsteczce są izomerami, ponieważ związki te mają ten sam wzór sumaryczny.
Numer związku najmniej lotnego: V
Numer związku najbardziej lotnego: VI
Wyjaśnienie: Ponieważ między cząsteczkami alkoholi tworzą się wiązania wodorowe (O−H···O). Pomiędzy cząsteczkami eterów nie tworzą się takie wiązania, ponieważ etery nie zawierają atomu wodoru związanego z atomem tlenu.
Zadanie 168. (SR17)
Poniżej przedstawiono wzór kwasu winowego:
HOOC-CH(OH)-CH(OH)-COOH
Przeanalizuj budowę cząsteczki kwasu winowego ze względu na możliwość wystąpienia stereoizomerii i odpowiedz na poniższe pytanie. Wpisz TAK albo NIE do tabeli i podaj uzasadnienie.
Uzupełnij poniższe schematy – utwórz wzory w projekcji Fischera dwóch stereoizomerów kwasu winowego będących diastereoizomerami.
Napisz wzór półstrukturalny (grupowy) organicznego produktu reakcji kwasu winowego z metanolem użytym w nadmiarze w środowisku stężonego kwasu siarkowego(VI).
Zadanie 169. (SR17)
Wykonano doświadczenie, w którym do dwóch probówek z tym samym odczynnikiem wprowadzono wodne roztwory dwóch związków chemicznych. Do probówki I wprowadzono wodny roztwór winianu disodu (NaOOC–CH(OH)–CH(OH)–COONa), a do probówki II – wodny roztwór etanianu (octanu) sodu (CH3COONa). W warunkach doświadczenia obydwa wodne roztwory były bezbarwnymi cieczami. Zaprojektuj doświadczenie, którego przebieg pozwoli na potwierdzenie, że roztwór winianu disodu wprowadzono do probówki I, a roztwór octanu sodu – do probówki II.
Uzupełnij schemat doświadczenia. Podkreśl nazwę odczynnika, który – po dodaniu do niego roztworów opisanych związków i wymieszaniu zawartości probówek – umożliwi zaobserwowanie różnic w przebiegu doświadczenia z udziałem winianu disodu i octanu sodu.
Odczynnik:
– zawiesina świeżo wytrąconego wodorotlenku miedzi(II)
– odczynnik Tollensa
– wodny roztwór oranżu metylowego

Odczynnik: zawiesina świeżo wytrąconego wodorotlenku miedzi (II)
Probówka I: (Niebieski) osad roztworzył się.
lub
Powstał (szafirowy) roztwór.
lub
Pojawiło się szafirowe zabarwienie.
Probówka II: Brak zmian zawartości probówki.