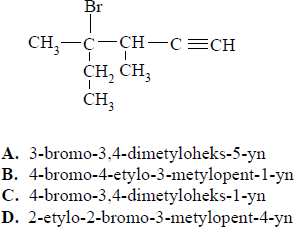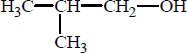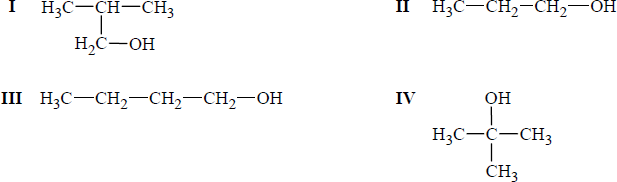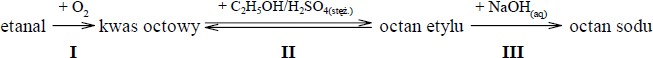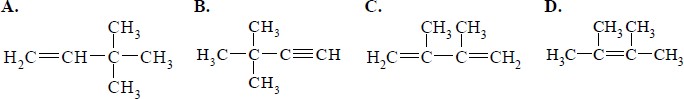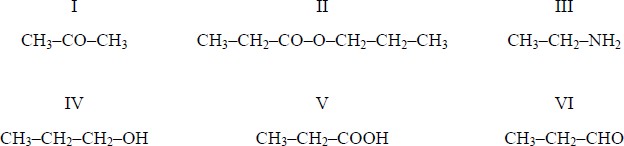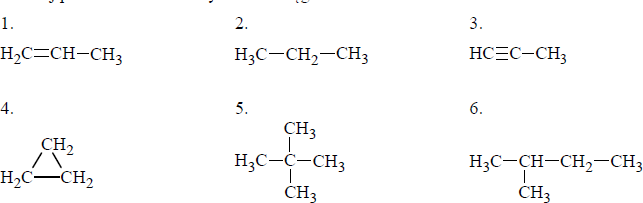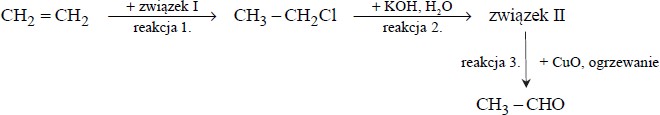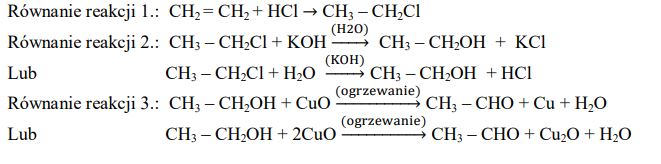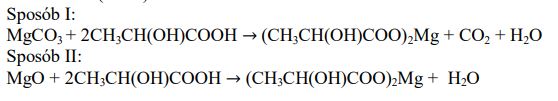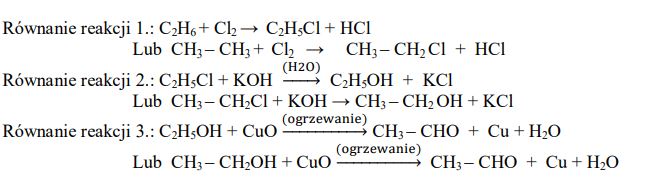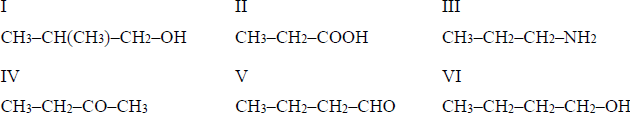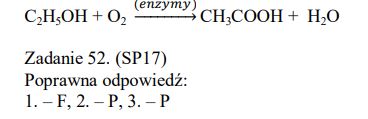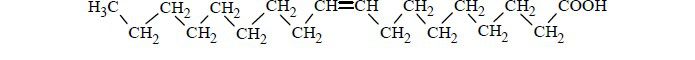Zadania maturalne z Chemii
Tematyka: węglowodory, chloropochodne, alkohole, aldehydy, ketony, kwasy karboksylowe, estry.
Zadania pochodzą z oficjalnych arkuszy maturalnych CKE, które służyły przeprowadzaniu majowych egzaminów. Czteroznakowy kod zapisany przy każdym zadaniu wskazuje na jego pochodzenie: S/N – „stara”/”nowa” formuła; P/R – poziom podstawowy/rozszerzony; np. 08 – rok 2008.
Zbiór zadań maturalnych w formie arkuszy, możesz pobrać >> TUTAJ <<.
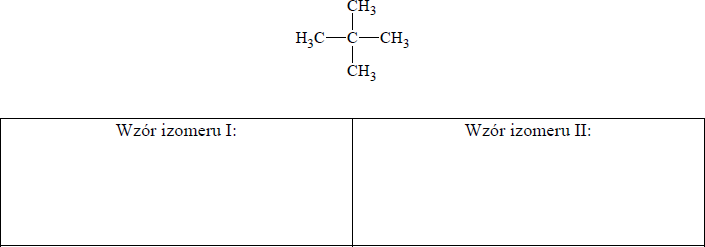
Zadanie 1. (SP05)
Wskaż poprawną nazwę poniższego związku.
Poniżej przedstawiono wzory półstrukturalne (grupowe) dwóch węglowodorów:
Odpowiedź C
Zadanie 2. (SP05)
Napisz równanie reakcji związku A z bromem w stosunku molowym 1:1 i określ, jakiego typu jest to proces. Związki organiczne przedstaw w formie wzorów półstrukturalnych (grupowych).
CH≡C–CH3 + Br2 → CHBr = CBr – CH3
typ reakcji: addycja (elektrofilowa) lub przyłączanie
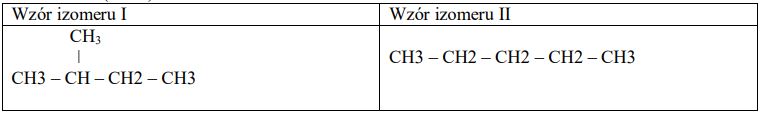
Zadanie 3. (SP05)
Przedstaw schemat ciągu przemian (nie musisz pisać równań reakcji) prowadzących do otrzymania butanonu z węglowodoru B. Związki organiczne przedstaw w formie wzorów półstrukturalnych (grupowych).
CH2=CH-CH2 -CH3→ CH3 -CH(OH)-CH2 -CH3→CH3 -CO-CH2 -CH3
Zadanie 4. (SP06)
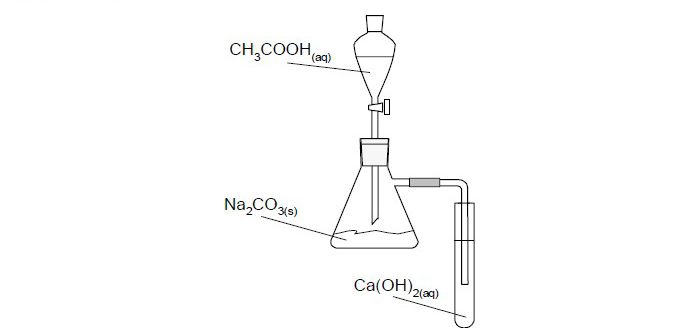
Do umieszczonego w kolbie węglanu sodu dodano z wkraplacza roztwór kwasu octowego. Rurka dołączona do kolby była zanurzona w roztworze wodorotlenku wapnia, znajdującym się w probówce.
a) Sformułuj jedną obserwację, dotyczącą reakcji zachodzącej
w kolbie: …………………………………
w probówce: …………………………..
b) Napisz w formie cząsteczkowej równanie reakcji zachodzącej
w kolbie: ……………………………
w probówce: …………………………..
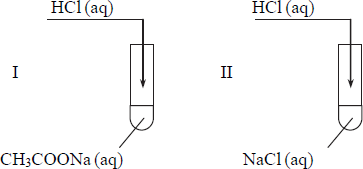
- a) w kolbie: wydziela się gaz
w probówce: wytrąca się osad
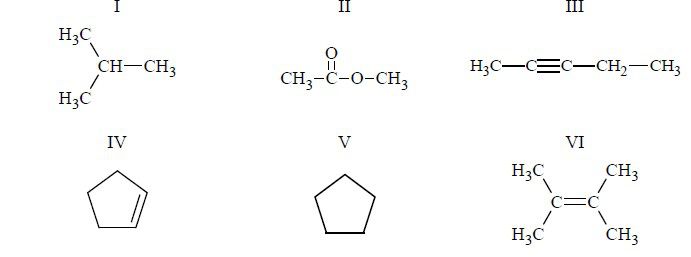
- b) w kolbie: 2CH3 COOH + Na2CO3 → 2CH3COONa + H2O + CO2 ↑
w probówce: Ca(OH)2 + CO2 → CaCO3 ↓ + H2O
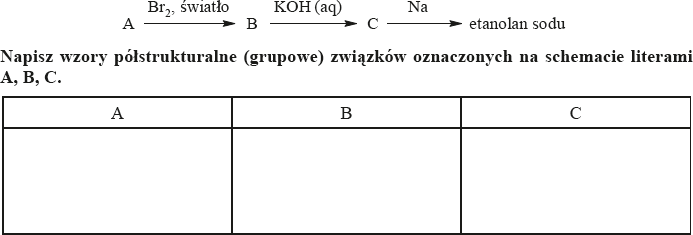
Zadanie 6. (SP06)
Podaj nazwę systematyczną związku o wzorze:
2-metylobutan
Zadanie 7. (SP06)
Podaj wzór półstrukturalny (grupowy) jednego z kwasów karboksylowych (z szeregu homologicznego o wzorze ogólnym CnH2n+1COOH), zawierających tyle samo atomów węgla co walina.
C H3–CH2–CH2–CH2–C=O
ǀ
OH
Zadanie 8. (SP07)
Wpisz znak X w odpowiednie pola obok podanych zdań, wskazując, czy zdania te są prawdziwe, czy fałszywe.
1.Prawda
2.Prawda
3.Fałsz
4.Fałsz
Zadanie 9. (SP07)
W dwóch probówkach znajdują się bezbarwne, ciekłe węglowodory: heks-1-en (1-heksen) i benzen. Wyjaśnij, porównując budowę obu węglowodorów, dlaczego stosując wodny roztwór KMnO4 można rozróżnić te ciecze.
Opisz, jak przeprowadzisz odpowiednie doświadczenie, oraz napisz, jakie będą obserwacje w przypadku każdego węglowodoru.
Wyjaśnienie
Heks-1-en: jest węglowodorem nienasyconym
Benzen: jest węglowodorem aromatycznym
Opis doświadczenia
Do probówek zawierających badane ciecze należy dodać roztwór KMnO4 .
Obserwacje
Heks-1-en: Wytraca się brunatny osad.
Benzen: Brak objawów reakcji.
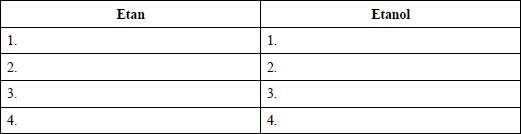
Zadanie 10. (SP08)
Scharakteryzuj etan i etanol (w temperaturze pokojowej i pod ciśnieniem atmosferycznym), wybierając ich właściwości spośród podanych poniżej i wpisując je w odpowiednie kolumny tabeli.
1.gaz, ciecz, ciało stałe
2. bezbarwny, barwny
3.dobrze rozpuszczalny w wodzie, praktycznie nierozpuszczalny w wodzie
4. palny, niepalny
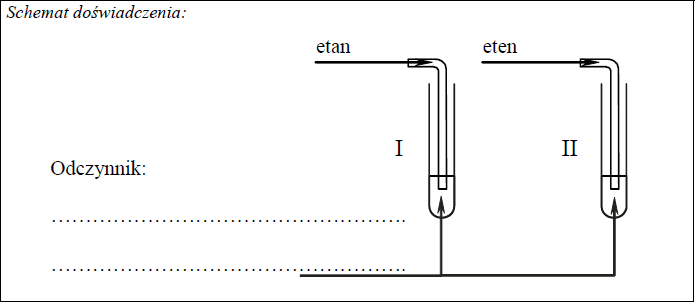
Zadanie 11. (SP08)
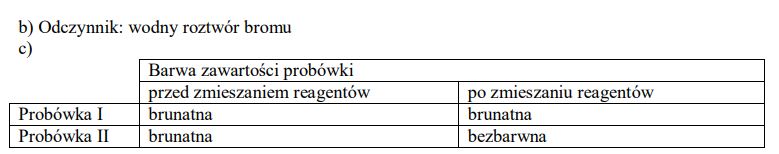
Zaprojektuj doświadczenie, którego przebieg pozwoli odróżnić etan od etenu. W tym celu:
a) napisz, jaką różnicę w budowie cząsteczek tych związków weźmiesz pod uwagę, planując eksperyment;
b) uzupełnij schemat doświadczenia, wpisując nazwę użytego odczynnika wybranego z podanej poniżej listy:
- zawiesina wodorotlenku miedzi(II),
• wodny roztwór bromu,
• wodny roztwór chlorku żelaza(III);
c) napisz, jakie obserwacje potwierdzą obecność etanu w probówce I i etenu w probówce II po wprowadzeniu tych gazów do wybranego odczynnika (wypełnij poniższą tabelę).
Zadanie 12. (SP08)
Jednym z jednowodorotlenowych alkoholi zawierających 4 atomy węgla w cząsteczce jest 2- metylopropan-1-ol o wzorze:
Spośród poniższych wzorów wybierz te, które przedstawiają izomery tego alkoholu, i podaj ich numery.
Numery wzorów izomerów: III, IV
Zadanie 13. (SP08)
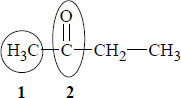
Poniżej przedstawiono wzór półstrukturalny butanonu.
a) Napisz nazwy systematyczne grup oznaczonych we wzorze numerami 1 i 2.
Nazwa grupy numer 1: …………………………………………………………………………………………………..
Nazwa grupy numer 2: …………………………………………………………………………………………………..
b) Napisz wzór półstrukturalny (grupowy) alkoholu powstałego w wyniku redukcji butanonu wodorem w obecności katalizatora.
- a) Nazwa grupy numer 1: metylowa
Nazwa grupy numer 2: karbonylowa
- b) CH3– CH– CH2– CH3
ǀ
OH
Zadanie 14. (SP08)
Przeprowadzono reakcje chemiczne według następującego schematu:
Stosując wzory półstrukturalne (grupowe) związków organicznych, napisz równania reakcji oznaczonych numerami I, II i III.
Równanie reakcji I:
2CH3CHO + O2 → 2CH3COOH
Równanie reakcji II:
CH3COOH + C2H5OH⇌CH3 COOC2H5 + H2O
Równanie reakcji III:
CH3COOC2H5 + NaOH → CH3COONa + C2H5 OH
Zadanie 15. (SP09)
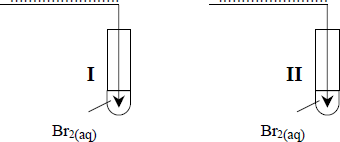
W celu odróżnienia od siebie dwóch gazów: etenu i etanu przepuszczano je przez wodę bromową.
W probówce I woda bromowa nie zmieniła barwy, a w probówce II odbarwiła się.
Uzupełnij poniższy rysunek, wpisując w miejsca kropek nazwy lub wzory badanych gazów.
- I. etan lub C2H6
- II. eten lub C2H4
Zadanie 16. (SP09)
W przemyśle wodór otrzymuje się przede wszystkim w procesie konwersji węglowodorów z parą wodną. Źródłem węglowodorów jest najczęściej gaz ziemny, którego głównym składnikiem jest metan. W mieszaninie gazu ziemnego z parą wodną w temperaturze 1025 K i w obecności katalizatora niklowego zachodzą następujące reakcje:
a) Przedstaw stosunek objętościowy substratów i produktów w reakcji I.
b) Napisz równanie reakcji II oraz sumaryczne równanie obu etapów.
- a) VCH4 : VH2O : VCO : VH2= 1 : 1 : 1 : 3
- b) Równanie reakcji II: CO (g) + H2O (g) → CO2(g) + H2(g)
Równanie sumaryczne: CH4(g) + 2H2O(g) → CO2(g) + 4H2(g)
Zadanie 17. (SP10)
W wyniku całkowitego spalenia 1 mola cząsteczek węglowodoru X powstały 2 mole cząsteczek wody i 3 mole cząsteczek tlenku węgla(IV).
a) Napisz, stosując wzór sumaryczny węglowodoru X, równanie opisanej reakcji
b) Narysuj wzór półstrukturalny (grupowy) węglowodoru, który może być związkiem
Zadanie 18. (SP10)
W wysokiej temperaturze i pod wysokim ciśnieniem węglowodory nasycone (alkany) ulegają tzw. krakingowi termicznemu. Podczas krakingu następuje rozerwanie wiązania węgiel – węgiel, wskutek czego z cząsteczki alkanu powstają dwie cząsteczki: jedna alkanu, a druga alkenu.
Rozerwanie wiązania węgiel – węgiel może zachodzić w różnych miejscach łańcucha węglowego cząsteczki alkanu, stąd produktami krakingu są zwykle mieszaniny węglowodorów.
Napisz nazwy systematyczne wszystkich par węglowodorów, które mogą powstać w procesie krakingu termicznego n-butanu.
Poprawna odpowiedź:metan i propen (prop-1-en)etan i eten
Zadanie 19. (SP10)
Podkreśl właściwe zakończenie zdania.
Dwa węglowodory pent-1-en i but-1-en:
A. zawierają w cząsteczkach różną liczbę grup metylowych –CH3.
B. różnią się (wyrażoną w % masowych) zawartością węgla i wodoru. .
C. są względem siebie izomerami.
D. są homologami etenu.
Poprawna odpowiedźB.
H HHH
ǀ ǀǀǀ
–C– C– C– C–
ǀ ǀǀǀ
H HHH
Zadanie 20. (SP10)
W wysokiej temperaturze w obecności Al2O3 alkohole ulegają reakcji dehydratacji (odwodnienia). Podczas dehydratacji nasyconych alkoholi (alkanoli) o wzorze ogólnym R1–CH(OH)–R2 (gdzie R1 ≠ R2) oprócz wody powstaje mieszanina nierozgałęzionych alkenów, które są względem siebie izomerami konstytucyjnymi.
Narysuj wzory półstrukturalne (grupowe) dwóch alkenów będących izomerami konstytucyjnymi, które mogą powstać w wyniku dehydratacji butan-2-olu.
H2C=CH‒CH2 ‒CH3
H3C‒CH=CH‒CH3
Zadanie 21. (SP10)
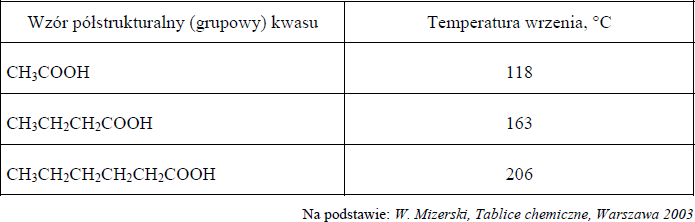
Właściwości substancji są uwarunkowane budową ich cząsteczek i charakterem występujących wiązań. W cząsteczkach kwasów karboksylowych można wyróżnić dwa fragmenty o przeciwstawnych właściwościach: polarną grupę karboksylową –COOH i niepolarny fragment węglowodorowy –R. W kwasach o krótkich łańcuchach węglowych dominuje grupa polarna. W miarę wzrostu długości łańcucha węglowego maleje wpływ grupy karboksylowej na właściwości związków. W poniższej tabeli zestawiono temperatury wrzenia wybranych kwasów karboksylowych (pod ciśnieniem 1013 hPa).
a) Na podstawie analizy danych zawartych w informacji wprowadzającej sformułuj wniosek, który określa związek pomiędzy długością łańcucha węglowego a lotnością kwasów karboksylowych.
b) Ustal, który z kwasów karboksylowych wymienionych w informacji wprowadzającej jest najlepiej rozpuszczalny w wodzie, i napisz jego wzór półstrukturalny (grupowy).
a)Przykłady poprawnej odpowiedzi:
Lotność kwasu maleje ze wzrostem długości łańcucha węglowego.
Im krótszy łańcuch węglowy tym lotność kwasu jest większa.
- b) CH3COOH
Zadanie 22. (SP11)
Poniżej przedstawiono ogólne schematy ilustrujące reakcje całkowitego spalania węglowodorów należących do różnych szeregów homologicznych.
Określ, o ile mniej moli tlenu cząsteczkowego zużywa się do całkowitego spalenia 1 mola alkenu niż do całkowitego spalenia 1 mola alkanu o tej samej liczbie atomów węgla w cząsteczce.
Poprawna odpowiedź: 0,5 mola O 2
Zadanie 23. (SP11)
Alkany pod wpływem promieniowania ultrafioletowego reagują z bromem. Z każdego alkanu zawierającego więcej niż 2 atomy węgla może powstać różna liczba izomerycznych monobromopochodnych, zależnie od tego, który atom wodoru zostaje zastąpiony przez atom bromu. W temperaturze około 100 ºC głównym produktem jest ten, w którym atom bromu został podstawiony do atomu węgla połączonego z mniejszą liczbą atomów wodoru.
a) W reakcji 2-metylopropanu z bromem przebiegającej pod wpływem promieniowania ultrafioletowego powstała mieszanina izomerycznych monobromopochodnych. Ustal, ile izomerów powstanie w wyniku opisanej przemiany.Napisz wzór półstrukturalny (grupowy) jednego izomeru oraz podaj jego nazwę systematyczną. Liczba powstałych izomerów.
b) Stosując wzory sumaryczne związków organicznych, napisz równanie reakcji bromu z n- butanem (zmieszanych w stosunku objętościowym 1 : 1) przebiegającej pod wpływem promieniowania ultrafioletowego w temperaturze około 100 ºC.
c) Podaj wzór półstrukturalny (grupowy) głównego produktu tej
Zadanie 24. (SP11)
Do całkowitego uwodornienia 1 mola cząsteczek węglowodoru X zużyto 2 mole cząsteczek wodoru. Produktem tej reakcji jest 2,2-dimetylobutan.
a) Spośród przedstawionych poniżej wzorów wybierz i podkreśl ten, który przestawia węglowodór X.
b) Napisz, stosując wzory sumaryczne związków organicznych, równanie reakcji całkowitego uwodornienia węglowodoru X.
a)Poprawna odpowiedz: B
- b) C6H10 + 2H2 →C6 H14
Zadanie 25. (SP12)
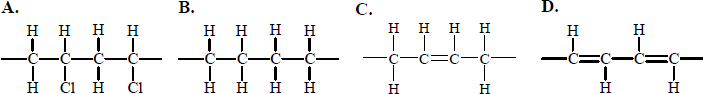
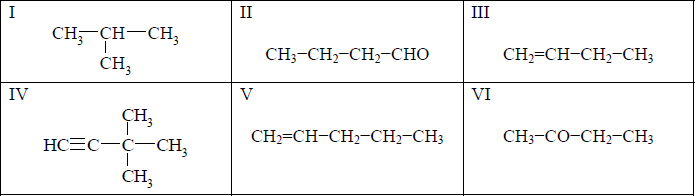
Spośród przedstawionych poniżej wzorów wybierz wszystkie, które ilustrują budowę cząsteczek węglowodorów nienasyconych.
Poprawna odpowiedz:
Budowęcząsteczekwęglowodorów nienasyconych ilustrują wzory III, IV, VI.
Zadanie 26. (SP12)
Napisz wzory półstrukturalne (grupowe) i nazwy systematyczne dwóch izomerycznych węglowodorów, które należą do szeregu homologicznego etynu, a ich cząsteczki zawierają 4 atomy węgla.
Zadanie 27. (SP12)
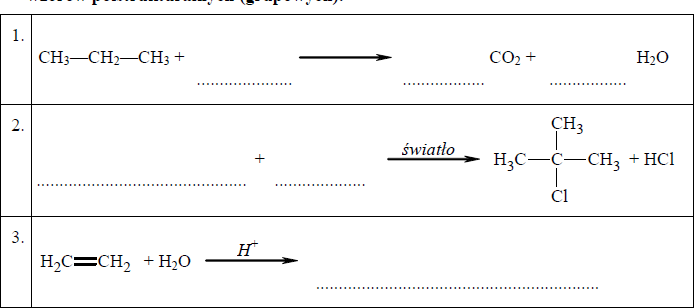
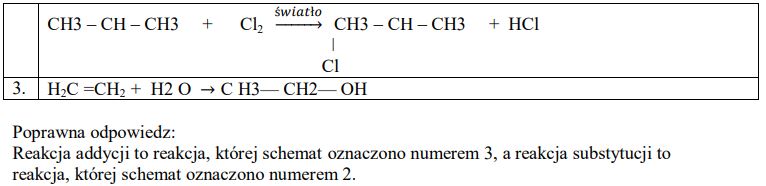
Przeanalizuj poniższe schematy przedstawiające trzy reakcje chemiczne, którym ulegają węglowodory i wpisz wzory brakujących substratów lub produktów oraz uzupełnij współczynniki stechiometryczne. Związki organiczne przedstaw za pomocą wzorów półstrukturalnych (grupowych).
Uzupełnij poniższe zdanie.
Reakcja addycji to reakcja, której schemat oznaczono numerem ……………….., a reakcja substytucji to reakcja, której schemat oznaczono numerem ……………….. .
Zadanie 28. (SP12)
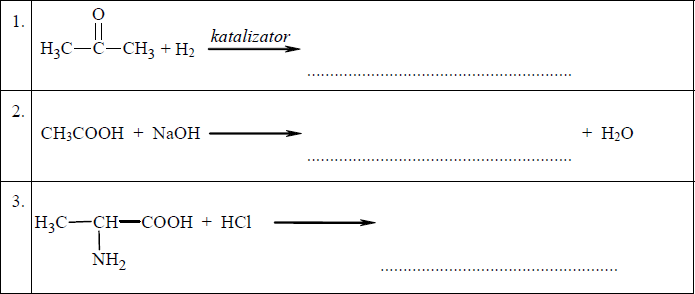
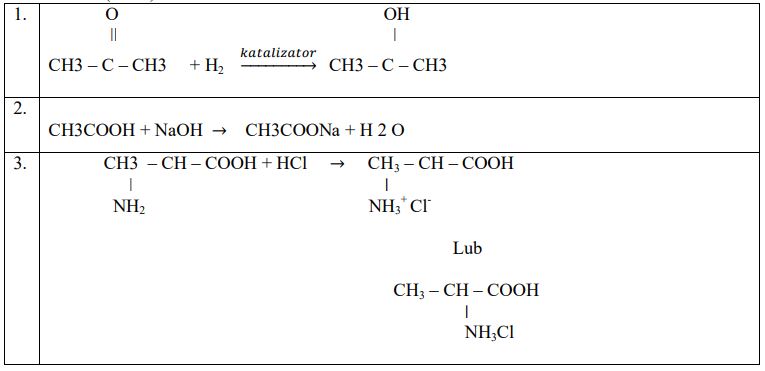
Przeanalizuj poniższe schematy przedstawiające trzy reakcje chemiczne, którym ulegają pochodne węglowodorów, i wpisz wzory półstrukturalne (grupowe) produktów organicznych.
Zadanie 29. (SP12)
Poniżej przedstawiono wzory sześciu jednofunkcyjnych pochodnych węglowodorów.
Uzupełnij zdania, wpisując numery, którymi oznaczono wzory odpowiednich związków.
I. Związek I jest izomerem związku …………… .
II. Związek II powstaje w wyniku reakcji związku …………… ze związkiem …………… .
III. Wodny roztwór związku …………… ma odczyn zasadowy.
IV. Produktem redukcji związku VI jest związek ……………
Poprawna odpowiedz:
- Związek I jest izomerem związku VI.
- Związek II powstaje w wyniku reakcji związku IV ze związkiem V.
- Wodny roztwór związku III ma odczyn zasadowy.
- Produktem redukcji związku VI jest związek IV.
Zadanie 30. (SP13)
Poniżej przedstawiono wzory półstrukturalne (grupowe) różnych związków chemicznych
Podkreśl właściwe zakończenie zdania.
Związek oznaczony numerem I:
A.jest substancją bardzo reaktywną.
B.Trzy dwie monochloropochodne.
C. należy do związków nienasyconych.
D. powoduje odbarwienie wodnego roztworu KMnO4.
b) Podaj nazwę systematyczną związku chemicznego oznaczonego numerem IV.
c) Uzupełnij poniższe zdania, wpisując numery związków I-VI.
1. Homologami są związki oznaczone numerami…………………………… i …………… .
2. Izomerami są związki oznaczone numerami………………………….. i …………… .
3. Butan powstaje w wyniku reakcji uwodornienia związku oznaczonego numerem …………..
4. Utlenienie butan-2-olu prowadzi do otrzymania związku oznaczonego numerem ………….. .
5. Powstanie ceglastej substancji stałej można zaobserwować po ogrzaniu mieszaniny wodorotlenku miedzi(II) ze związkiem oznaczonym numerem ………….. .
a)Poprawna odpowiedz: B.
- b) 3,3-dimetylobut-1-yn lub 3,3-dimetylobut-1-in
- c) Poprawna odpowiedz:
- Homologami są związki oznaczone numerami III i V.
- Izomerami są związki oznaczone numerami II i VI.
- Butan powstaje w wyniku reakcji uwodornienia związku oznaczonego numerem III.
- Utlenianie butan-2-olu prowadzi do otrzymania związku oznaczonego numerem VI.
- Powstanie ceglastej substancji stałej można zaobserwować po ogrzaniu mieszaniny
wodorotlenku miedzi(II) ze związkiem oznaczonym numerem II.
Zadanie 31. (SP13)
Poniżej przedstawiono schemat przemiany, której ulega związek organiczny X.
X + 4O2 → 3CO2 + 3H2O
Korzystając z informacji, wybierz i podkreśl w każdym nawiasie poprawne uzupełnienie poniższych zdań.
Przemiana opisana schematem jest reakcją spalania (całkowitego / niecałkowitego). Związek X ma wzór sumaryczny (C3H8 / C3H6 / C3H6O2 / C3H6O).
Poprawna odpowiedź:
Przemiana opisana schematem jest reakcją spalania ( całkowitego / niecałkowitego ).
Związek X ma wzór sumaryczny ( C3H8 / C3H6 / C3H6O2 / C3H6O ).
Zadanie 32. (SP14)
Poniżej przedstawiono wzór węglowodoru:
Napisz wzory pólstrukturalne (grupowe) trzech wybranych izomerów tego węglowodoru, które są alkenami.
Poprawna odpowiedz (zdający powinien napisać dowolne 3 wzory spośród czterech
poniższych):
CH3 ‒ CH ≡ CH ‒ CH2 ‒ CH3
CH2=C‒ CH2‒CH3
ǀ
CH3
CH2 = CH ‒ CH ‒ CH3
ǀ
CH3
CH3 ‒ CH = C ‒ CH3
ǀ
CH3
Uwaga: W przypadku pent-2-enu za poprawne należy uznać wzory izomerów
geometrycznych cis- i trans-, jeśli będą podane dwa.
Zadanie 33. (SP14)
Poniżej przedstawiono schemat ciągu przemian, którym ulega węglowodór oznaczony literą A i jego pochodne.
Zadanie 34. (SP15)
Napisz w formie cząsteczkowej równanie reakcji otrzymywania soli sodowej kwasu etanowego (octowego) z kwasu i odpowiedniego tlenku metalu.
Poprawna odpowiedz
2CH3COOH+ Na2O → 2CHCOONa + H2O
Zadanie 35. (SP15)
Poniżej przedstawiono wzory sześciu węglowodorów.
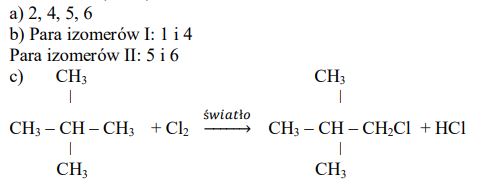
a) Napisz numery, którymi oznaczono wzory wszystkich węglowodorów nasyconych.
b) Wśród wymienionych powyżej wzorów sześciu węglowodorów są wzory dwóch par izomerów.
Napisz numery, którymi oznaczono wzory obu par izomerów.
Para izomerów I: …………………………………..
Para izomerów II: ………………………………………..
c) Dokończ poniższe równanie − zapisz wzór półstrukturalny (grupowy) organicznego produktu reakcji związku 5. z chlorem w stosunku molowym 1 : 1.
Zadanie 36. (SP15)
Poniżej przedstawiono schemat ciągu reakcji z udziałem etenu
Napisz równania reakcji 1.–3. Zastosuj wzory półstrukturalne (grupowe) związków organicznych
Zadanie 37. (SP15)
Kwas mlekowy (kwas 2-hydroksypropanowy) jest organicznym związkiem chemicznym z grupy hydroksykwasów. Wzór kwasu mlekowego jest następujący: CH3–CH(OH)–COOH Mleczan magnezu o wzorze (CH3–CH(OH)–COO)2Mg jest stosowany jako suplement diety uzupełniający niedobory magnezu.
Mleczan magnezu otrzymuje się w wyniku reakcji węglanu magnezu z kwasem mlekowym (sposób I) lub tlenku magnezu z kwasem mlekowym (sposób II).
Napisz w formie cząsteczkowej równania reakcji otrzymywania mleczanu magnezu opisanymi sposobami. Pamiętaj, że w reakcji węglanu magnezu z kwasem mlekowym jednym z produktów jest gaz.
Zadanie 38. (SP15)
Napisz w formie cząsteczkowej równanie reakcji kwasu oleinowego z wodorotlenkiem sodu. Zastosuj następujący wzór kwasu: C17H33COOH.
Wyjaśnij, dlaczego organiczny produkt tej reakcji jest rozpuszczalny w wodzie.
Równanie reakcji:
C17 H33 COOH + NaOH ⎯⎯→ C17H33COONa + H2O
Wyjaśnienie:
Organiczny produkt tej reakcji jest związkiem jonowym. Jony oddziałują z polarnymi
cząsteczkami wody, dzięki czemu związek się rozpuszcza.
lub
Organiczny produkt tej reakcji może dysocjować w roztworze wodnym.
Zadanie 39. (SP16)
Napisz wzory półstrukturalne (grupowe) dwóch węglowodorów będących izomerami związku o wzorze:
Zadanie 40. (SP16)
Reakcja całkowitego spalania etanu przebiega zgodnie z równaniem: 2C2H6 + 7O2 → 4CO2 + 6H2O
Oblicz objętość, jaką zajmie w warunkach normalnych tlen potrzebny do całkowitego spalenia 90,0 gramów etanu.
Zadanie 41. (SP16)
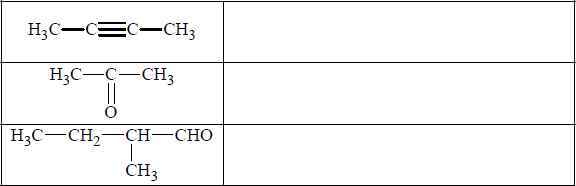
Wpisz do tabeli nazwy systematyczne związków organicznych o podanych wzorach.
Zadanie 42. (SP16)
Przeprowadzono doświadczenie, którego przebieg zilustrowano na rysunku.
Stwierdzono, że reakcja chemiczna zaszła tylko w jednej probówce.
a) Wskaż probówkę, w której zaszła reakcja chemiczna.
b) Napisz w formie jonowej skróconej równanie tej
Zadanie 43. (SP16)
Przeprowadzono doświadczenie zilustrowane poniższym schematem.
Określ odczyn roztworów uzyskanych w probówkach I-III.
Zadanie 44. (SP16)
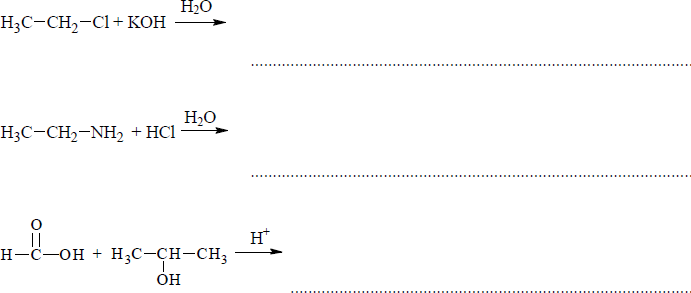
Do podanych substratów dopisz wzory produktów, tak aby otrzymać równania reakcji. Zastosuj wzory półstrukturalne (grupowe) produktów organicznych.
Zadanie 45. (SP17)
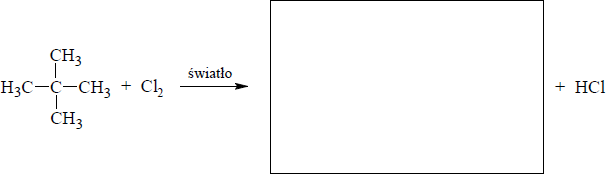
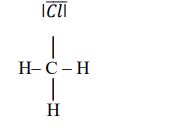
Narysuj wzór elektronowy cząsteczki chlorometanu CH3Cl – zaznacz kreskami wiązania chemiczne i wolne pary elektronowe.
Zadanie 46. (SP17)
W procesie reformingu metan reaguje z parą wodną w obecności katalizatora, w podwyższonej temperaturze i pod ciśnieniem około 3 MPa zgodnie z równaniem:
a) Określ stosunek masowy i objętościowy substratów i produktów opisanej reakcji, jeżeli przebiega ona w warunkach, w których wszystkie te substancje są gazami.
b) Opisana reakcja wymaga ogrzewania i prowadzona jest w obecności katalizatora.
Wybierz i podkreśl w każdym nawiasie poprawne uzupełnienie poniższych zdań.
Ogrzewanie układu (skutkuje zwiększeniem szybkości / skutkuje zmniejszeniem szybkości / nie ma wpływu na szybkości) reakcji.
Obecność katalizatora skutkuje (zwiększeniem / zmniejszeniem) szybkości reakcji.
- a) mCH4 : mH2O : mCO: mH2 = 16: 18 : 28 : 6 lub 8 : 9 : 14 : 3
VCH4 : VH2O : VCO : VH2 = 1 : 1 : 1 : 3 lub 22,4 : 22,4 : 22,4 : 67,2
- b) Poprawna odpowiedz
- Ogrzewanie układu (skutkuje zwiększeniem szybkości / skutkuje zmniejszeniem
szybkości / nie ma wpływu na szybkość) reakcji.
- Obecność katalizatora skutkuje (zwiększeniem / zmniejszeniem) szybkości reakcji.
Zadanie 47. (SP17)
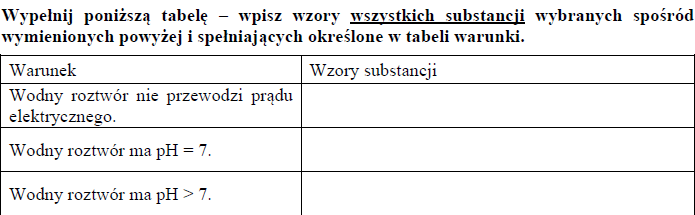
W oddzielnych probówkach przygotowano wodne roztwory substancji o następujących wzorach
Wypełnij poniższą tabelę – wpisz wzory wszystkich substancji wybranych spośród wymienionych powyżej i spełniających określone w tabeli warunki.
Zadanie 48. (SP17)
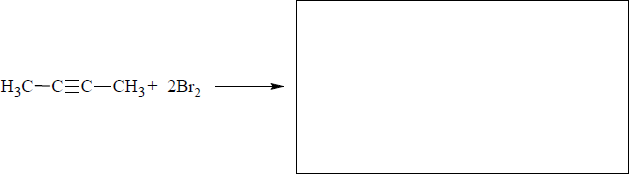
Dokończ poniższe równanie − zapisz wzór półstrukturalny (grupowy) organicznego produktu reakcji but-2-ynu z bromem w stosunku molowym 1 : 2.
Br Br
│ │
CH3 ‒ C ≡ C ‒ CH3 + Br2 → CH3 ‒ C ‒ C ‒ CH3
│ │
Br Br
Lub CH3–CBr2–CBr2–CH3
Zadanie 49. (SP17)
Poniżej przedstawiono schemat ciągu reakcji zachodzących z udziałem etanu i jego pochodnych:
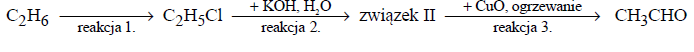
Zadanie 50. (SP17)Poniżej przedstawiono wzory sześciu pochodnych węglowodorów:
Uzupełnij zdania. Wpisz numery, którymi oznaczono wzory odpowiednich związków.
- Związek I jest izomerem związku ………, a związek IV jest izomerem związku ……..… .
- Kwasem karboksylowym jest związek …………… .
- Właściwości zasadowe ma związek …………… .
- Estry powstają w reakcji związku II ze związkami………………………………… i …………… .
Poprawna odpowiedz
- Związek I jest izomerem związku VI, a związek IV jest izomerem związku V.
- Kwasem karboksylowym jest związek II.
- Właściwości zasadowe ma związek III.
- Estry powstają w reakcji związku II ze związkami I i VI.
Zadanie 51. (SP17)
Kwas etanowy (octowy) powstaje w procesie fermentacji octowej etanolu. Produktami reakcji etanolu z tlenem z powietrza – zachodzącej pod wpływem enzymów wytwarzanych przez bakterie octowe – są kwas etanowy i woda. Napisz równanie fermentacji octowej etanolu. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
Zadanie 52. (SP17)
Budowę cząsteczki pewnego związku przedstawia poniższy wzór:
Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.
Poprawna odpowiedź:
- – F, 2. – P, 3. – P
Zadanie 53. (SP18)
W etanolowym roztworze wodorotlenku sodu halogenki alkilowe ulegają reakcji eliminacji halogenowodoru. Podczas tej reakcji z halogenków alkilowych o wzorze ogólnym R1–CH2–CHX– R2 (gdzie R1, R2 – grupy węglowodorowe, X = Cl, Br), oprócz soli nieorganicznej i wody, powstaje mieszanina nierozgałęzionych alkenów, które są względem siebie izomerami.
Na podstawie: R. Morrison, R. Boyd, Chemia organiczna, Warszawa 1997.
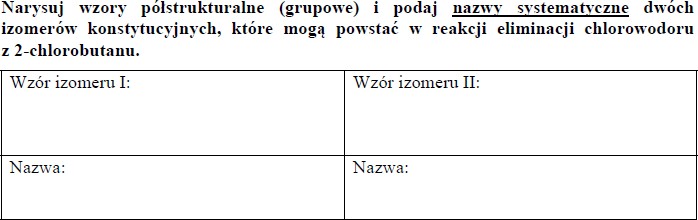
Narysuj wzory półstrukturalne (grupowe) i podaj nazwy systeatyczne dwóch izomerów konstytucyjnych, które mogą powstać w reakcji eliminacji chlorowodoru z 2-chlorobutanu.
Zadanie 54. (SP18)
Poniższy schemat jest ilustracją ciągu przemian, których początkowym substratem jest etyn (acetylen):
etyn (acetylen) → chloroeten polimer → 1 → 2.
a) Napisz stosując wzory półstrukturalne (grupowe) związków organicznych, równanie reakcji oznaczonej na schemacie numerem 1.
b) Spośród wzorów oznaczonych numerami I i II wybierz ten, który przedstawia budowę fragmentu łańcucha polimeru stanowiącego produkt reakcji oznaczonej na schemacie numerem 2.
- a) CH≡CH + HCl → CH2=CHCl
b)Wzór fragmentu opisanego polimeru oznaczony jest numerem: II
Zadanie 55. (SP18)
Ustal liczbę wiązań węgiel–wodór w cząsteczce związku, którego wzór podano poniżej.
Poprawna odpowiedź: 10
Zadanie 56. (SP18)
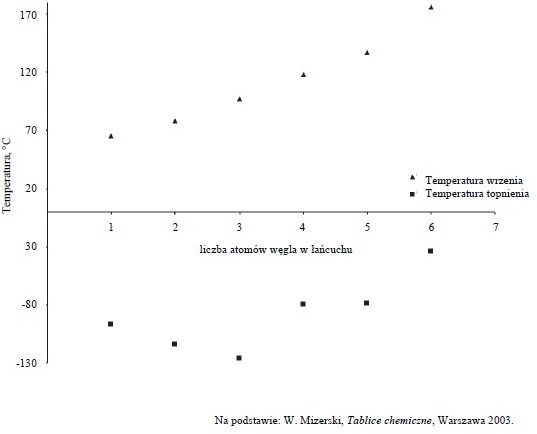
Poniższy wykres przedstawia zależność temperatury topnienia i temperatury wrzenia wybranych alkoholi (metanolu, etanolu, propan-1-olu, butan-1-olu, pentan-1-olu, heksan-1-olu) od liczby atomów węgla w łańcuchu węglowym.
Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.
Poprawna odpowiedź:
- – P, 2. – F, 3. – P
Zadanie 57. (SP18)
Eten ulega reakcjom zilustrowanym poniższymi równaniami:
a) Zaprojektuj doświadczenie, które pozwoli na odróżnienie organicznych produktów obu opisanych reakcji.
Wybierz jeden odczynnik spośród podanych poniżej i podkreśl jego nazwę:
– Br2 (aq)
– świeżo strącony osad Cu(OH)2
– FeCl3 (aq)
b) Opisz zmiany (lub zaznacz brak zmian), które można zaobserwować po dodaniu do naczynia z wybranym odczynnikiem:
– organicznego produktu reakcji I
– produktu reakcji II.
- a) Poprawna odpowiedź: świeżo stracony osad Cu(OH)2
- b) Poprawna odpowiedź:
Po dodaniu do naczynia z wybranym odczynnikiem
-organicznego produktu reakcji I powstanie (szafirowy) roztwór.
-produktu reakcji II nie obserwuje się zmian.
Zadanie 58. (SP18)
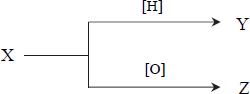
Poniższy schemat ilustruje przemiany chemiczne, w wyniku których otrzymano ze związku X związki organiczne Y i Z.
Związki Y i Z w podwyższonej temperaturze i w obecności kwasu siarkowego(VI) tworzą ester o wzorze CH3COOCH2CH3 i wodę.
a) Zapisz wzór półstrukturalny (grupowy) związku X
b) Podaj nazwę otrzymanego estru.
- a) CH3CHO
- b) etanian etylu lub octan etylu lub ester etylowy kwasu etanowego lub ester etylowy kwasu
octowego
Click edit button to change this text.