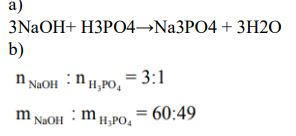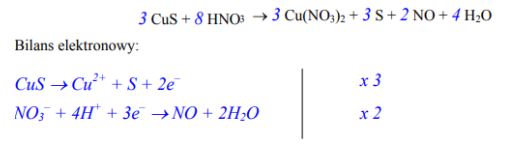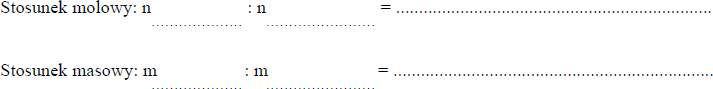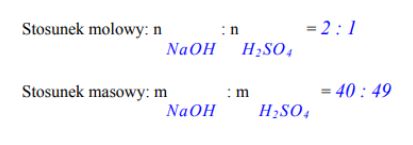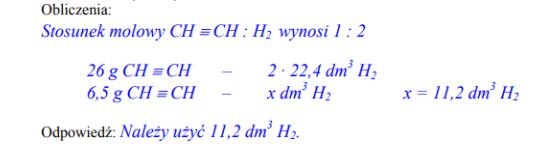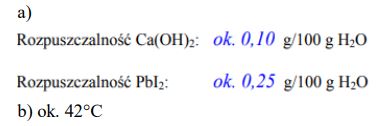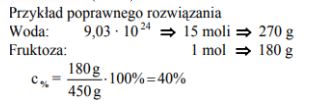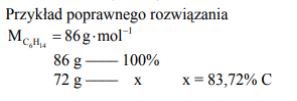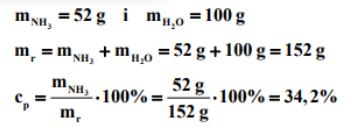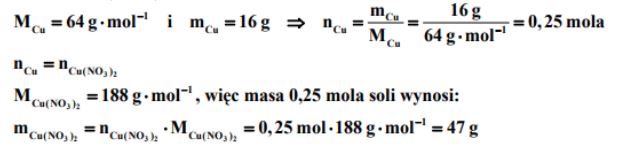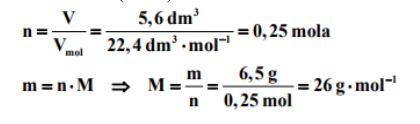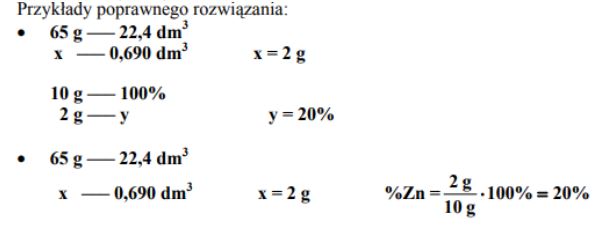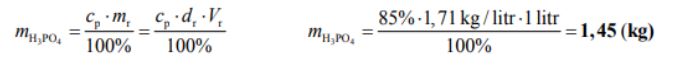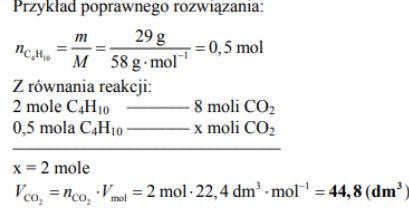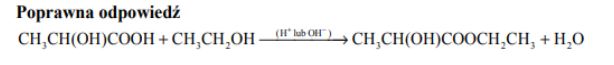Zadania maturalne z Chemii
Tematyka: mol, stężenia roztworów, prawo Avogadra, gazy doskonałe i rzeczywiste, wydajność reakcji, entalpia, szybkość reakcji, odczyn pH, stała reakcji chemicznej, stopień dysocjacji, prawo Ostwalda.
Zadania pochodzą z oficjalnych arkuszy maturalnych CKE, które służyły przeprowadzaniu majowych egzaminów. Czteroznakowy kod zapisany przy każdym zadaniu wskazuje na jego pochodzenie: S/N – „stara”/”nowa” formuła; P/R – poziom podstawowy/rozszerzony; np. 08 – rok 2008.
Zbiór zadań maturalnych w formie arkuszy, możesz pobrać >> TUTAJ <<.
Zadanie 1. (SP05)
Tlenek siarki(IV) można otrzymać na skalę przemysłową w wyniku spalania pirytu (FeS2):
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
Oblicz, jaka objętość tlenku siarki(IV), zmierzona w warunkach normalnych, powstanie w wyniku spalania 30 gramów.
Zadanie 2. (SP05)
Oblicz stężenie procentowe jodu w jodynie, jeżeli otrzymano ją w wyniku rozpuszczenia 8 gramów jodu w 72 gramach etanolu.
Zadanie 3. (SP05)
Czterech uczniów miało za zadanie przygotować 200 gramów 10% wodnego roztworu glukozy, mając do dyspozycji: glukozę, wodę destylowaną, wagę laboratoryjną techniczną z kompletem odważników, cylinder miarowy, szkiełko zegarkowe i zlewkę (gęstość wody d=1g·cm-3). Polecenie wykonali następująco:
odp. D
Zadanie 4. (SP05)
Na podstawie równania reakcji zapisanego w formie cząsteczkowej podaj, w jakim stosunku molowym i masowym reaguje wodorotlenek sodu z kwasem ortofosforowym(V), jeżeli jedynymi produktami są sól obojętna i woda.
Cząsteczkowe równanie reakcji: …………………………………………………………………………..
Stosunek molowy wodorotlenku do kwasu: ……………………………………………………………….
Stosunek masowy wodorotlenku do kwasu: ……………………………………………………………….
Zadanie 5. (SP05)
Dobierz współczynniki stechiometryczne metodą bilansu elektronowego w równaniu pierwszego etapu reakcji utleniania siarczku miedzi(II) kwasem azotowym(V):
….. CuS + ….. HNO3 → ….. CuO + ….. S + …… NO + …… H2O
Zadanie 6. (SP06)
Napisz wzór i oblicz masę molową soli, która krystalizuje z wodnego roztworu chlorku glinu. Pamiętaj, że jest to sól uwodniona.
Zapisz niezbędne obliczenia.
Zadanie 7. (SP06)
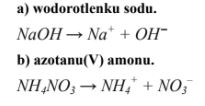
Napisz równanie dysocjacji jonowej zachodzącej podczas rozpuszczania w wodzie:
a) Wodorotlenku sodu: ……………………………………………………………………..
b) Azotanu(V) amonu: ………………………………………………………………………
Zadanie 8. (SP06)
Nasycony wodny roztwór azotanu(V) amonu w temperaturze 20o C można otrzymać przez rozpuszczenie 189,9 gramów azotanu(V) amonu w 100 gramach wody.
Oblicz stężenie procentowe (w procentach masowych) nasyconego roztworu tej soli w temperaturze 20 st. C.
Zadanie 9. (SP06)
Akwaforta jest techniką graficzną, w której wykorzystuje się proces tzw. trawienia (częściowego rozpuszczania) iedzi za pomocą chlorku żelaza (III). Technika ta została zastosowana także do wytwarzania obwodów drukowanych w elektronice. W trakcie trawienia zachodzi reakcja opisana równaniem:
Cu + 2 FeCl3 → CuCl2 + 2 FeCl2
a) Napisz w formie jonowej równanie powyższej reakcji.
b) Podaj stopnie utlenienia miedzi oraz żelaza przed reakcją i po reakcji.
c) Napisz połówkowe równania procesu utleniania i procesu redukcji.
Równanie procesu utleniania: …………………………………………………………………………………………
Równanie procesu redukcji: ……………………………………………………………………………………………
Zadanie 10. (SP07)
Uzupełnij współczynniki stechiometryczne w podanym równaniu reakcji. Zastosuj metodę bilansu elektronowego.
Zadanie 11. (SP07)
Przeprowadzono reakcję zobojętniania zilustrowaną równaniem: Ca(OH)2 + 2HCl → CaCl2 + 2H2O
Oblicz, jaką objętość kwasu solnego o stężeniu 0,5 mol/dm3 należy użyć do całkowitego zobojętnienia 100 cm3 roztworu Ca(OH)2 o stężeniu 0,2 mol/dm
Zadanie 12. (SP07)
Przeprowadzono reakcję zobojętniania, która przebiegła zgodnie z równaniem: 2NaOH + H2SO4 → Na2SO4 + 2H2O
Uzupełnij poniższy zapis, podając, jaki jest stosunek molowy oraz masowy substratów w powyższej reakcji.
Zadanie 13. (SP07)
Oblicz, jaką objętość wodoru, w przeliczeniu na warunki normalne, należy użyć do całkowitego uwodornienia 6,5 g etynu, jeśli reakcja przebiega według równania:
Zadanie 14. (SP08)
W poniższej tabeli przedstawiono wartości rozpuszczalności dwóch wybranych substancji w wodzie.
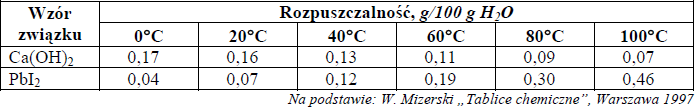
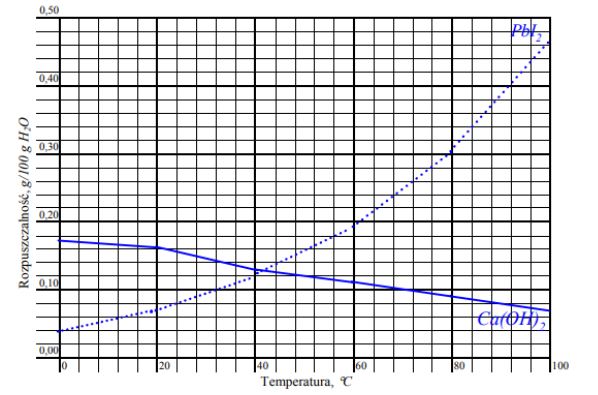
Zadanie 15. (SP08)
W poniższej tabeli przedstawiono wartości rozpuszczalności dwóch wybranych substancji w wodzie.
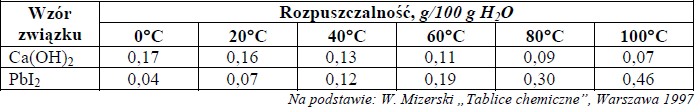
a) Rozpuszczalność Ca(OH)2 i PbI2 w wodzie w temperaturze 70°C.
Rozpuszczalność Ca(OH)2: ……………………………… g/100 g
H2O Rozpuszczalność PbI2: ……………………………… g/100 g H2O
b) Temperaturę, w której rozpuszczalność obu soli jest jednakowa. ……………………… .
Zadanie 16. (SP08)
Dokończ, wpisując słowa rośnie lub maleje, następujące zdania:
Rozpuszczalność Ca(OH)2 w wodzie ………………………………………… ze wzrostem temperatury.
Rozpuszczalność PbI2 w wodzie ………………………………………………. ze wzrostem temperatury.
Rozpuszczalność Ca(OH)2 w wodzie maleje ze wzrostem temperatury.
Rozpuszczalność PbI2 w wodzie rośnie ze wzrostem temperatury.
Zadanie 17. (SP08)
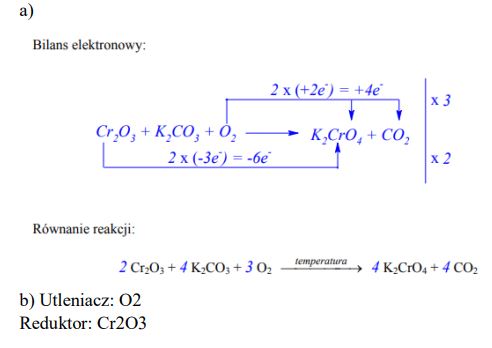
Tlenek chromu(III) stapiany z węglanem potasu w obecności tlenu przekształca się w chromian(VI) potasu. Reakcja ta zachodzi według schematu
a) Dobierz współczynniki stechiometryczne w równaniu tej reakcji, stosując metodę bilansu elektronowego.
b) Napisz wzór substancji, która w tej reakcji pełni rolę utleniacza, i wzór substancji, która pełni rolę reduktora.
Zadanie 18. (SP08)
Oblicz, ile gramów nadtlenku wodoru znajduje się w 100 cm3 perhydrolu. Gęstość perhydrolu wynosi 1,11 g/cm3 .
Zadanie 19. (SP09)
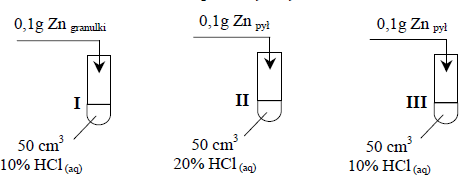
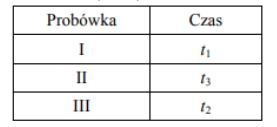
Przeprowadzono doświadczenie zilustrowane poniższym rysunkiem.
Cynk całkowicie przereagował we wszystkich probówkach, ale reakcje przebiegały z różnymi szybkościami (cynk roztworzył się w różnych czasach t).
Przeanalizuj warunki doświadczenia i przyporządkuj czasy przebiegu reakcji (t1, t2 i t3) procesom zachodzącym w probówkach I, II i III, jeżeli wiadomo, że t1 > t2 > t3.
Zadanie 20. (SP09)
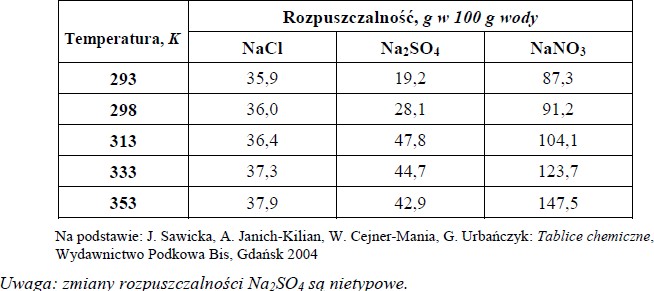
W poniższej tabeli przedstawiono wartości rozpuszczalności trzech soli sodu w różnych temperaturach.
a) Na podstawie danych w tabeli wpisz we właściwe miejsca zdania słowa: nasycony,
Do 100 g wody w temperaturze 333 K dodano 44,7 g Na2SO4 i otrzymano
roztwór …………………………………, po czym roztwór ten został schłodzony do 313 K i powstał
roztwór …………………………………
b) Na podstawie danych w tabeli uzupełnij zdanie, wpisując wzór właściwej
W przedziale temperatur 313 K – 353 K wraz ze wzrostem temperatury najbardziej wzrasta rozpuszczalność ……………………………….
- a) Do 100 g wody w temperaturze 333 K dodano 44,7 g Na2SO4 i otrzymano roztwór nasycony, po czym roztwór ten został schłodzony do 313 K i powstał roztwór nienasycony.
- b) W przedziale temperatur 313 K – 353 K ze wzrostem temperatury najbardziej wzrasta rozpuszczalność NaNO3.
Zadanie 21. (SP09)
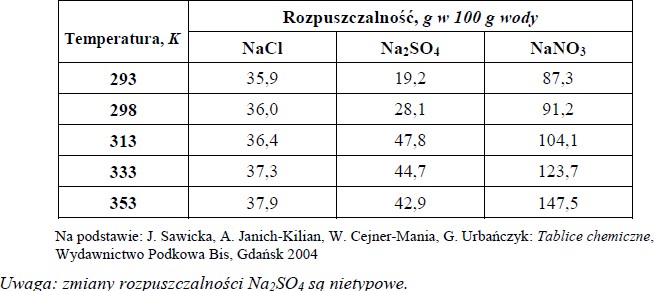
W poniższej tabeli przedstawiono wartości rozpuszczalności trzech soli sodu w różnych temperaturach.
Na podstawie danych w tabeli uzupełnij poniższe zdania, wpisując odpowiednie wartości masy soli.
1. W 50 g wody w temperaturze 353 K można maksymalnie rozpuścić …………. g NaCl.
2.Do zlewki, w której znajdowało się 140 g stałego NaNO3, dodano 100 g wody.
Zlewkę ogrzano do 333 K, a jej zawartość wymieszano. Na dnie naczynia pozostało ………… g soli.
- W 50 g wody w temperaturze 353 K można maksymalnie rozpuścić 18,95 g NaCl.
- Do zlewki, w której znajdowało się 140 g NaNO3 dodano 100 g wody. Zlewkę ogrzano do 333 K, a jej zawartość wymieszano. Na dnie naczynia pozostało 16,3 g soli.
Zadanie 22. (SP09)
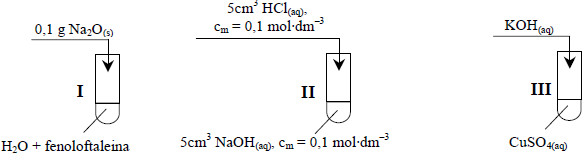
Przeprowadzono doświadczenia zilustrowane poniższym rysunkiem.
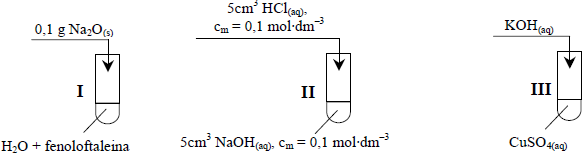
a) Napisz, jaką zmianę zaobserwowano w probówce I, wpisując do tabeli barwę roztworu przed reakcją i po
b) Podaj, co można zaobserwować podczas reakcji zachodzącej w probówce
Zadanie 23. (SP09)
Przeprowadzono doświadczenia zilustrowane poniższym rysunkiem.
Zapisz w formie jonowej skróconej równania reakcji przebiegających w probówkach II i III.
Probówka II: …………………………………………………………………………………………………………………
Probówka III: ……………………………………………………………………………………………………………….
Probówka II: H++ OH − → H2O
Probówka III: Cu2+ + 2OH − → Cu(OH)2↓
Zadanie 24. (SP09)
Określ odczyny roztworów, które powstały w probówkach I i II.
Odczyn roztworu w probówce I: …………………………………………………………………………………….
Odczyn roztworu w probówce II: …………………………………………………………………………………..
Odczyn roztworu w probówce I: zasadowy
Odczyn roztworu w probówce II: obojętny
Zadanie 25. (SP09)
Etyloaminę (etanoaminę) można otrzymać w wyniku katalitycznej redukcji etanalu w obecności amoniaku (aminowanie redukcyjne), zgodnie z poniższym równaniem reakcji.
CH3 – CHO + NH3 + H2 ⎯Ni ⎯→ CH3 – CH2 – NH2 + H2O
Na podstawie: R.T. Morrison i R.N. Boyd: Chemia organiczna, PWN, Warszawa 1998
Oblicz, ile dm3 amoniaku (w przeliczeniu na warunki normalne) przereaguje z 77,0 g etanalu podczas otrzymywania etyloaminy metodą aminowania redukcyjnego. Wynik podaj z dokładnością do jednego miejsca po przecinku.
Zadanie 26. (SP10)
Hemoglobina, złożone białko krwinek czerwonych (erytrocytów) o masie cząsteczkowej 70200 u, zawiera 0,3191% masowych żelaza.
Oblicz liczbę atomów żelaza znajdujących się w jednej cząsteczce tego białka. W obliczeniach przyjmij przybliżoną wartość masy atomowej żelaza MFe = 56 u.
Zadanie 27. (SP10)
Ilość tlenku węgla(IV) emitowanego do atmosfery w wyniku spalania paliw kopalnych, np. w elektrociepłowniach, można ograniczyć, przepuszczając emitowane gazy przez wodną zawiesinę krzemianu wapnia. Zachodzi wtedy reakcja opisana równaniem:
Oblicz, ile gramów krzemianu wapnia (CaSiO3) potrzeba do usunięcia 280,0 dm3 CO2 (w warunkach normalnych) z gazów emitowanych z elektrociepłowni.
Zadanie 28. (SP10)
Przygotowano dwie zlewki zawierające po 300 cm3 wody destylowanej z dodatkiem oranżu metylowego. Do pierwszej zlewki wprowadzono 5 kropli kwasu solnego o stężeniu 1 mol/dm3 . Następnie do drugiej zlewki dodawano kroplami (licząc dodawane krople) roztwór kwasu octowego o stężeniu 1 mol/dm3 do momentu uzyskania zabarwienia roztworu identycznego z zabarwieniem roztworu w pierwszej zlewce.
a) Zakładając, że identyczne barwy wskaźnika oznaczają takie samo pH roztworów w obu zlewkach, porównaj ilości roztworów CH3COOH i HCl użytych do tego doświadczenia i na tej podstawie napisz wzór tego kwasu, którego użyto więcej. Więcej użyto …..
b) Napisz, jaka jest przyczyna użycia różnych ilości tych kwasów. ……
- a) Więcej użyto CH3COOH
- b)
- Jeden kwas jest mocniejszy, a drugi słabszy.
- Kwas octowy (CH3COOH) jest kwasem słabszym.
• Kwas octowy (CH3COOH) dysocjuje niecałkowicie.
Zadanie 29. (SP10)
Gęstość wodnego roztworu wodorotlenku sodu o stężeniu cp = 20% masowych wynosi 1,22 g/cm3 (w temperaturze 20 °C).
a) Oblicz, ile gramów NaOH należy odważyć, aby otrzymać 1 dm3 wodnego roztworu wodorotlenku sodu o stężeniu 20% masowych w temperaturze 20 °C.
b) Podaj kolejne czynności, które należy wykonać (po obliczeniu potrzebnej ilości NaOH), aby otrzymać ten roztwór.
Zadanie 30. (SP11)
Termiczny rozkład azotanu(V) ołowiu(II) przebiega według równania:
2Pb(NO3)2 → 2PbO + 4NO2↑ + O2↑
Oblicz całkowitą objętość gazowych produktów (w przeliczeniu na warunki normalne) wydzielonych podczas reakcji rozkładu 16,55 g azotanu(V) ołowiu(II), zakładając, że przemiana ta przebiegła ze 100% wydajnością. Wynik podaj z dokładnością do jednego miejsca po przecinku.
Zadanie 31. (SP11)
W wodnym roztworze fruktozy (C6H12O6) na jeden mol cząsteczek tego cukru przypada 9,03 · 10 24 cząsteczek wody.
Oblicz stężenie procentowe tego roztworu w procentach masowych. Wynik podaj z dokładnością do liczby całkowitej.
Zadanie 32. (SP11)
Poniższy wykres przedstawia temperaturową zależność rozpuszczalności azotanu(V) potasu w wodzie.
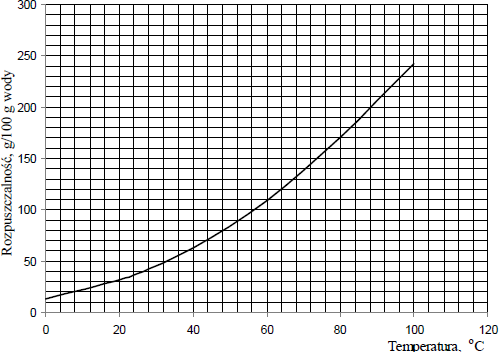
Korzystając z wykresu, określ
a) ile gramów azotanu(V) potasu nie rozpuściło się.
b) do jakiej najniższej temperatury należy ogrzać mieszaninę, aby pozostała sól uległa rozpuszczeniu.
- a) 30 g
- b) 80 °C
Zadanie 33. (SP11)
Oblicz w procentach masowych zawartość węgla w produkcie reakcji całkowitego uwodornienia węglowodoru X. Wynik podaj z dokładnością do dwóch miejsc po przecinku.
Zadanie 34. (SP12)
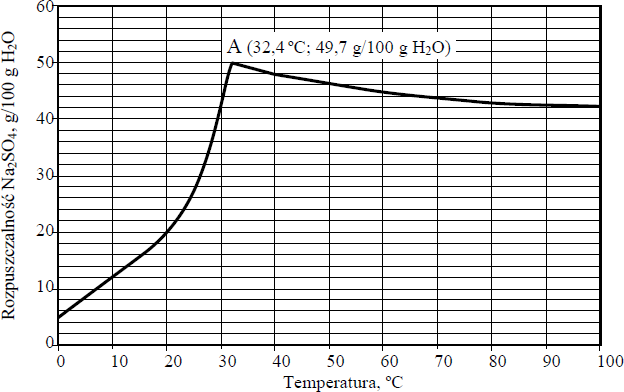
Poniższy wykres przedstawia zależność rozpuszczalności bezwodnego siarczanu(VI) sodu w wodzie od temperatury. Punkt A wykresu odpowiada temperaturze równej 32,4 ºC i rozpuszczalności równej 49,7 g w 100 g wody
a) W 100 g wody rozpuszczono taką ilość bezwodnego siarczanu(VI) sodu, że otrzymano roztwór nasycony o temperaturze 10 ºC. Następnie do naczynia z roztworem dosypano jeszcze porcję 8 g tej soli, która nie uległa rozpuszczeniu. Oszacuj najniższą temperaturę, do której należałoby ogrzać roztwór, aby dodana porcja soli całkowicie się rozpuściła. Roztwór należałoby ogrzać do temperatury około ………………………….. ºC
b) Dokończ poniższe zdania, wpisując odpowiednie wartości temperatury.
1. Rozpuszczalność Na2SO4 w temperaturze 100 ºC jest taka sama, jak w temperaturze ……………………….. ºC.
2. Najmniejszą rozpuszczalność Na2SO4 osiąga w temperaturze ………………………… ºC
3. Największą rozpuszczalność Na2SO4 osiąga w temperaturze ………………………… ºC.
4. Ochładzanie nasyconego w temperaturze 100 ºC roztworu Na2SO4 aż do temperatury ………………………… ºC nie powoduje wykrystalizowania części rozpuszczonej soli.
- a) Roztwór należałoby ogrzać do temperatury około 20 ºC
- b)
- Rozpuszczalność Na2SO4 w temperaturze 100 ºC jest taka sama, jak w temperaturze 30 ºC.
- Najmniejszą rozpuszczalność Na2SO4 osiąga w temperaturze 0 ºC.
- Największą rozpuszczalność Na2SO4 osiąga w temperaturze 32,4 ºC.
- Ochładzanie nasyconego w temperaturze 100 ºC roztworu Na2SO4 do temperatury 30 ºC
nie powoduje wykrystalizowania części rozpuszczonej soli.
Zadanie 36. (SP12)
Rozpuszczalność amoniaku w wodzie w temperaturze 20 ºC i pod ciśnieniem atmosferycznym wynosi 52 g w 100 g wody.
Oblicz stężenie procentowe nasyconego wodnego roztworu amoniaku w temperaturze 20 ºC i pod ciśnieniem atmosferycznym. Wynik podaj z dokładnością do pierwszego miejsca po przecinku.
Zadanie 37. (SP12)
Reakcja miedzi z rozcieńczonym kwasem azotowym(V) przebiega zgodnie z równaniem:
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
W nadmiarze rozcieńczonego kwasu azotowego(V) uległo roztworzeniu 16 g miedzi.
Oblicz masę Cu(NO3)2 otrzymanego w wyniku opisanej reakcji. Wynik podaj z dokładnością do liczb całkowitych.
Zadanie 38. (SP12)
Stwierdzono, że 6,5 g pewnego gazowego węglowodoru zajmuje w warunkach normalnych objętość równą 5,6 dm3 .
Oblicz masę molową tego weglowodoru.
Zadanie 39. (SP13)
Reakcja redukcji tlenku ołowiu(IV) wodorem przebiega według równania: PbO2 + 2H2 → Pb + 2H2O
Oblicz liczbę cząsteczek wody, która powstanie podczas opisanej przemiany (zakładając 100% wydajności procesu), jeżeli wiadomo, że do reakcji użyto 119,5 g tlenku ołowiu(IV).
Zadanie 40. (SP13)
Mosiądze to dwuskładnikowe stopy miedzi i cynku. Do grupy mosiądzów należy tombak, który barwą przypomina złoto i dlatego stosowany jest jako jego imitacja. Próbkę tombaku o masie 10 g wrzucono do kwasu solnego użytego w nadmiarze. Przebiegła wtedy reakcja chemiczna, którą ilustruje poniższe równanie:
Zn + 2HCl → ZnCl2 + H2
Objętość wydzielonego wodoru wyniosła 690 cm3 w przeliczeniu na warunki normalne.
Oblicz zawartość procentową cynku (w procentach masowych) w próbce tombaku. Wynik podaj z dokładnością do liczby całkowitej.
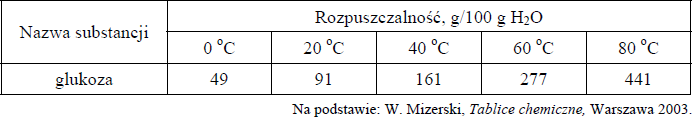
Zadanie 41. (SP13)
W poniższej tabeli przedstawiono dane dotyczące zależności rozpuszczalności glukozy w wodzie od temperatury.
Korzystając z informacji, wybierz i podkreśl w każdym nawiasie poprawne uzupełnienie poniższych zdań.
a) Po dodaniu 90 gramów glukozy do 100 gramów wody o temperaturze 18 o C i ogrzaniu całości do temperatury 25 o C otrzymano roztwór (nasycony / nienasycony).
b) Stężenie procentowe (w procentach masowych) nasyconego wodnego roztworu glukozy jest równe 47,6% w temperaturze około (20 st. C / 40 st. C / 60 st. C).
- Po dodaniu 90 gramów glukozy do 100 gramów wody o temperaturze 18 o C i ogrzaniu całości do temperatury 25 o C otrzymano roztwór ( nasycony / nienasycony ).
- Stężenie procentowe (w procentach masowych) nasyconego wodnego roztworu glukozy jest równe 47,6% w temperaturze około ( 20 o C / 40 o C / 60 o C ).
Zadanie 42. (SP13)
Przygotowano 0,5 dm3 wodnego roztworu glukozy (C6H12O6) o stężeniu 0,25 mol · dm–3. Masa molowa glukozy wynosi 180 g · mol -1 . Wymień kolejne czynności, które należy wykonać, aby otrzymać 0,5 dm3 wodnego roztworu glukozy o stężeniu 0,25 mol · dm-3.
Uzupełnij poniższe zdania, wpisując w odpowiedniej formie poprawne odpowiedzi wybrane z poniższego zestawu.
woda, glukoza, roztwór glukozy, 22,5 g, 45 g, 90 g, 250 cm3, 500 cm3, 1000 cm3
a) W celu przygotowania 0,5 dm3 wodnego roztworu glukozy o stężeniu 0,25 mol·dm–3 należy odważyć ………………………………. glukozy
b) Odważoną próbkę glukozy należy przenieść do kolby miarowej o pojemności ………………………….. i dodać niewielką ilość wody w celu rozpuszczenia substancji. Następnie zawartość naczynia należy dopełnić …………………………………. do kreski znajdującej się na szyjce kolby miarowej.
Poprawna odpowiedź: 1. W celu przygotowania 0,5 dm3 wodnego roztworu glukozy o stężeniu 0,25 mol·dm–3 należy odważyć 22,5 g glukozy. 2. Odważoną próbkę glukozy należy przenieść do kolby miarowej o pojemności 500 cm3 i dodać niewielką ilość wody w celu rozpuszczenia substancji. Następnie zawartość naczynia należy dopełnić wodą do kreski znajdującej się na szyjce kolby miarowej.
Zadanie 43. (SP14)
Na etykiecie naczynia z roztworem kwasu ortofosforowego(V) podane są następujące informacje:
Wzór: H3PO4
Stężenie procentowe (w proc. masowych): 85%
Gęstość: 1,71 kg/litr
Oblicz, ile kilogramów czystego kwasu ortofosforowego(V) zawiera 1 litr opisanego roztworu. Wynik podaj z dokładnością do dwóch miejsc po przecinku.
Zadanie 44. (SP14)
Oceń, czy można całkowicie rozpuści 1 mol tlenku siarki(IV) w 1 dm3 wody w temperaturze 20 °C. Wykonaj odpowiednie obliczenia.
Zadanie 45. (SP14)
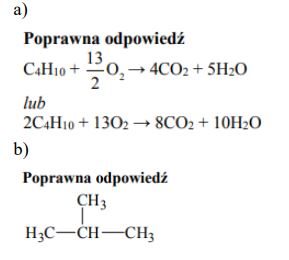
Reakcja całkowitego spalania butanu zachodzi zgodnie z równaniem
Oblicz, ile dm3 tlenku węgla(IV) (w przeliczeniu na warunki normalne) powstanie w wyniku całkowitego spalenia 29 gramów butanu. W obliczeniach zastosuj masy molowe zaokrąglone do liczb całkowitych.
Zadanie 46. (SP14)
Oblicz stężenie molowe roztworu glukozy, wiedząc, że w 0,1 dm3 tego roztworu znajduje się 3,6 grama glukozy. Przyjmij masę molową glukozy M = 180 g · mol–1.
Zadanie 47. (SP15)
Masa jodu stanowi 3% masy jodyny. Oblicz, ile gramów jodu należy użyć, aby otrzymać 100,0 cm3 jodyny, której gęstość jest równa 0,8 g · cm–3. Wynik zaokrąglij do pierwszego miejsca po przecinku.
Zadanie 48. (SP15)
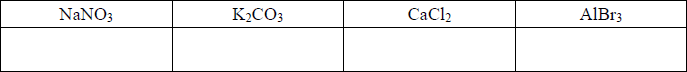
Określ łączną liczbę moli jonów powstających w wyniku całkowitej dysocjacji jonowej 0,1 mola każdego elektrolitu, którego wzór wymieniono poniżej.
Zadanie 49. (SP15)
Reakcja całkowitego spalania pentanu zachodzi zgodnie z równaniem
Oblicz, ile dm3 tlenku węgla(IV) (w przeliczeniu na warunki normalne) powstanie w wyniku całkowitego spalenia 18 gramów pentanu. W obliczeniach zastosuj masy molowe zaokrąglone do jedności.
Zadanie 50. (SP15)
Zapotrzebowanie na magnez dorosłej osoby wynosi około 300 mg na dobę.
Wykonaj obliczenia, aby sprawdzić, czy zażycie dwóch tabletek zawierających po 500 mg mleczanu magnezu zaspokoi dobowe zapotrzebowanie na ten pierwiastek osoby dorosłej, która w ciągu doby przyjęła z pożywieniem 200 mg magnezu.
Zadanie 51. (SP15)
Mleczan etylu jest estrem stosowanym jako rozpuszczalnik i substancja zapachowa.
Napisz równanie reakcji otrzymywania tego estru z kwasu i alkoholu. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
Zadanie 52. (SP16)
Rozpuszczalność bromku potasu w temperaturze 20 °C jest równa 65 gramów w 100 gramach wody.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2003.
Wykonaj obliczenia i oceń, czy można całkowicie rozpuścić 1 mol bromku potasu w 180 gramach wody w temperaturze 20 °C.
Zadanie 53. (SP16)
Spośród związków o wzorach przedstawionych poniżej wybierz wszystkie te, które w wodnych roztworach nie ulegają dysocjacji elektrolitycznej. Podkreśl wzory wybranych związków.
HCOONa, HNO3, C2H5OH, KOH, C6H12O6 (fruktoza)
C2H5OH
C6H12O6 (fruktoza)
Zadanie 54. (SP16)
Rozpuszczono w wodzie 33,2 g jodku potasu (KI), w wyniku czego otrzymano 150 cm3 roztworu.
Oblicz stężenie molowe tego roztworu.
Zadanie 55. (SP16)
Wykonano doświadczenie, którego przebieg zilustrowano na poniższym rysunku. 10 cm3 wodnego roztworu KOH o stężeniu 1 mol·dm–3 4 cm3 wodnego roztworu H2SO4 o stężeniu 1 mol·dm–3
a) Napisz w formie cząsteczkowej równanie reakcji, która zaszła w probówce.
b) Określ odczyn roztworu otrzymanego w tym doświadczeniu.
- a) 2KOH + H2SO4 → K2SO4 + 2H2O
- b) zasadowy
Zadanie 56. (SP17)
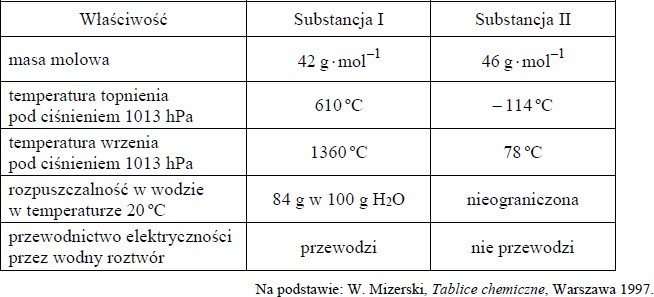
W poniższej tabeli zestawiono wybrane właściwości dwóch substancji oznaczonych numerami I i II:
a) Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.
b) Oblicz stężenie procentowe (w procentach masowych) nasyconego wodnego roztworu substancji I w temperaturze 20 ºC.
Zadanie 57. (SP17)
Oblicz, ile cm3 wodnego roztworu NaOH o stężeniu cp = 5,0% (w procentach masowych) i gęstości równej 1,1 g·cm–3 należy odmierzyć, aby w odmierzonej objętości roztworu znajdowało się 0,5 mola NaOH.
Zadanie 58. (SP17)
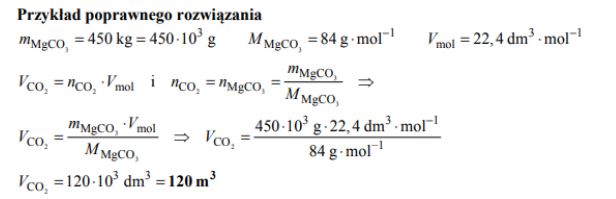
Węglan magnezu ulega termicznemu rozkładowi zgodnie z równaniem:
Oblicz, ile m3 tlenku węgla(IV) powstanie (w przeliczeniu na warunki normalne) w wyniku termicznego rozkładu 450 kg węglanu magnezu.
Zadanie 59. (SP18)
Stwierdzono, że w pewnym związku chemicznym zawartość sodu wyrażona w procentach masowych jest równa 74,2%.
Wykonaj odpowiednie obliczenia i ustal, czy opisanym związkiem jest nadtlenek sodu, czy – tlenek sodu.
Zadanie 60. (SP18)
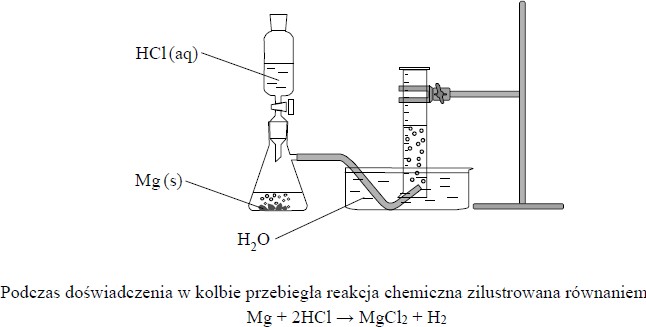
Przeprowadzono doświadczenie zgodnie z poniższym rysunkiem.
Podczas doświadczenia w kolbie przebiegła reakcja chemiczna zilustrowana równaniem:
Mg + 2HCl → MgCl2 + H2
a) W kolbie umieszczono próbkę magnezu o masie 2,4 grama i stopniowo dodawano kwas solny. Stwierdzono, że magnez przereagował całkowicie po dodaniu 100 cm3 roztworu HCl o stężeniu cm. Przebiegła reakcja opisana powyższym równaniem.
Oblicz stężenie molowe użytego do reakcji kwasu solnego.
b) Po zakończeniu opisanego doświadczenia, w którym magnez przereagował całkowicie, z roztworu otrzymanego w kolbie odparowano wodę.
Podaj wzór związku, który pozostał po odparowaniu wody, i wskaż występujący w nim rodzaj wiązania (jonowe, kowalencyjne niespolaryzowane, kowalencyjne spolaryzowane).
c) Napisz, dlaczego gaz wydzielający się w opisanej reakcji można zbierać nad wodą.
d) Oceń, czy zmieni się (wzrośnie albo zmaleje), czy też nie ulegnie zmianie szybkość opisanej reakcji magnezu z kwasem solnym, jeżeli:
I. zamiast użytych w doświadczeniu wiórków magnezu użyje się pyłu magnezowego
II. zamiast użytego do reakcji kwasu solnego o stężeniu cm użyje się kwasu solnego o stężeniu 0,5 cm.
Zadanie 61. (SP18)
W poniższej tabeli przedstawiono wartości rozpuszczalności trzech związków chemicznych w wodzie w różnych temperaturach
a) Skorzystaj z informacji wprowadzającej i uzupełnij poniższe zdania wzorami substancji, tak aby powstały informacje prawdziwe.
I. W miarę podwyższania temperatury zmniejsza się rozpuszczalność …………………………….. .
II. Po porównaniu wartości rozpuszczalności dwóch soli można stwierdzić, że w mniejszym stopniu zależy od temperatury rozpuszczalność…………………………………………………………. .
III. W 150 g wody o temperaturze 40 ºC można maksymalnie rozpuścić 95,85 g ………………… .
b) W zlewce zmieszano chlorek sodu z wodą w stosunku masowym msoli : mwody = 1 : 5. Otrzymano roztwór o temperaturze 20 ºC.
I. Określ, jaki roztwór otrzymano – nasycony czy nienasycony.
II. Oblicz w procentach masowych stężenie otrzymanego roztworu.
Zadanie 63. (SP18)
W wyniku spalenia próbki pewnego węglowodoru X zawierającej 6,02·1023 cząsteczek otrzymano 4 mole CO2 oraz 90 gramów H2O. Wiadomo też, że cząsteczki węglowodoru X charakteryzują się rozgałęzionymi łańcuchami.
a) Napisz, stosując wzór sumaryczny węglowodoru X, równanie opisanej reakcji spalania.
b) Napisz wzór półstrukturalny (grupowy) opisanego węglowodoru X.