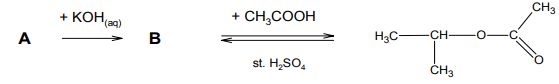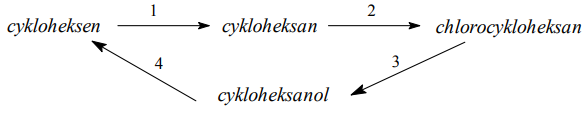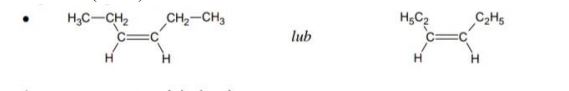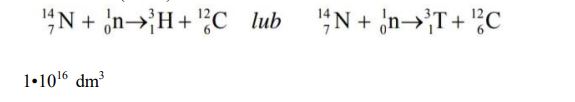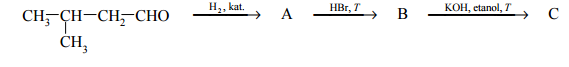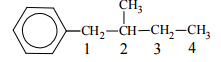Zadania maturalne z Chemii
Tematyka: węglowodory, chloropochodne, alkohole, aldehydy, ketony, kwasy karboksylowe, estry.
Zadania pochodzą z oficjalnych arkuszy maturalnych CKE, które służyły przeprowadzaniu majowych egzaminów. Czteroznakowy kod zapisany przy każdym zadaniu wskazuje na jego pochodzenie: S/N – „stara”/”nowa” formuła; P/R – poziom podstawowy/rozszerzony; np. 08 – rok 2008.
Zbiór zadań maturalnych w formie arkuszy, możesz pobrać >> TUTAJ <<.
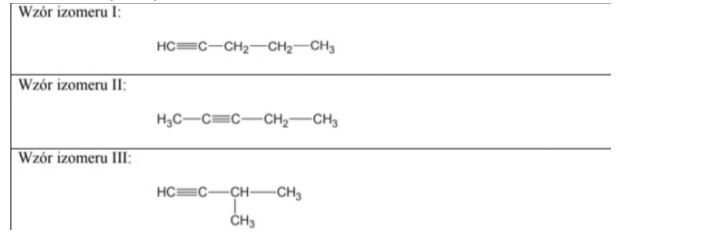
Zadanie 59. (SR06)
Napisz wzory półstrukturalne (grupowe) trzech izomerycznych alkinów zawierających 5 atomów węgla w cząsteczce.
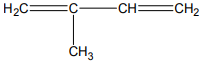
Zadanie 60. (SR06)
Określ liczbę wiązań typu σ i typu π między atomami węgla w cząsteczce związku o następującym wzorze:
Liczba wiązań typu σ: 4
Liczba wiązań typu π: 2
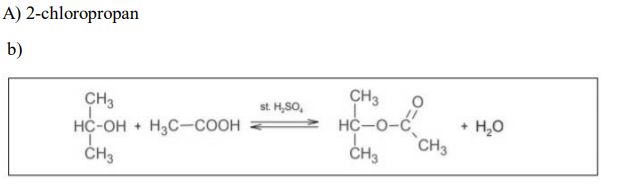
Zadanie 61. (SR06)
Związek A, będący chloropochodną pewnego alkanu, poddano przemianom, które ilustruje poniższy schemat:
Podaj nazwę systematyczną związku A. b) Napisz, używając wzorów półstrukturalnych (grupowych), równanie reakcji, której ulega związek B.
Zadanie 62. (SR07)
Poniżej przedstawiono wartości iloczynu rozpuszczalności wybranych węglanów w temperaturze 25°C:
Ir MgCO3 = 3,5⋅ 10–8
Ir CaCO3 =2,8·10–9
Ir SrCO3 =1,1·10–10
Ir BaCO3 =5,1·10–9
Korzystając z przedstawionych wyżej wartości iloczynu rozpuszczalności, oceń, który z węglanów metali II grupy jest najlepiej rozpuszczalny w wodzie, i podaj jego wzór.
MgCO3
Zadanie 63. (SR07)
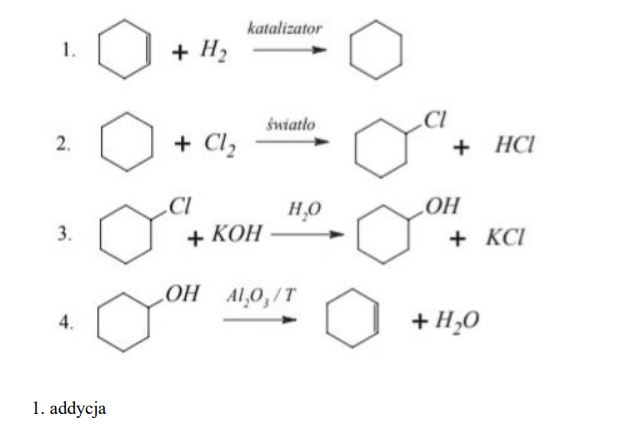
Poniżej przedstawiono cykl reakcji zachodzących z udziałem związków organicznych.
Wiedząc, że węglowodory cykliczne ulegają analogicznym reakcjom jak węglowodory łańcuchowe, napisz równania reakcji (1. – 4.) zilustrowane na powyższym schemacie. Zastosuj wzory półstrukturalne (grupowe) lub uproszczone związków organicznych. Określ typ każdej reakcji (1. – 4.) z powyższego schematu, wybierając odpowiednią nazwę ze zbioru: substytucja, addycja, eliminacja, kondensacja.
Zadanie 64. (SR09)
Podaj liczbę wszystkich wiązań σ i wiązań π w cząsteczce węglowodoru o wzorze:
Liczba wiązań σ : 12
Liczba wiązań π : 2
Zadanie 65. (SR10)
Narysuj wzór strukturalny lub półstrukturalny (grupowy) węglowodoru, w którego cząsteczce występuje osiem wiązań σ i jedno wiązanie π.
Zadanie 66. (SR10)
Uzupełnij poniższy schemat, tak aby otrzymać wzór izomeru geometryczngo cis węglowodoru o wzorze grupowym CH3–CH2–CH=CH–CH2–CH3
Zadanie 67. (SR11)
Pomiędzy cząsteczkami, w których obecne są atomy wodoru związane bezpośrednio z silnie elektroujemnymi atomami niemetalu (fluoru, tlenu, azotu), tworzą się wiązania wodorowe mające wpływ na właściwości fizyczne związku. a) Spośród związków o wzorach: CH3OH, CH3COCH3, CH3F, CH3NH2, CH3CH3, CH3Cl wybierz i napisz wzory tych, których cząsteczki tworzą wiązania wodorowe.
Wiązania wodorowe utrudniają przejście związku w stan gazowy, ponieważ powodują asocjację cząsteczek – łączenie się ich w większe agregaty. Wiązania te są tym silniejsze, im bardziej elektroujemny jest atom niemetalu będący donorem pary elektronowej. b) Uszereguj związki o wzorach: CH3CH3, CH3NH2, CH3OH zgodnie ze wzrastającą lotnością (od najmniejszej do największej).
- a) CH3OH, CH3NH 2,
- b) CH3OH, CH3NH2, CH3CH3
Zadanie 68. (SR11)
Tryt 3H (T) jest nietrwałym izotopem wodoru o okresie półtrwania 12,3 lat, który emituje cząstki β– . Powstaje on między innymi w wyższych warstwach atmosfery na skutek zderzeń neutronów z atomami azotu 14N. W przemianie tej obok trytu powstaje także trwały izotop węgla. Tryt w reakcji z tlenem tworzy wodę trytową, która w opadach przedostaje się do wód powierzchniowych. Szacuje się, że w 1 cm3 wody będącej w naturalnym obiegu znajduje się 6 · 104 atomów trytu.
Napisz równanie reakcji wytwarzania trytu w wyższych warstwach atmosfery. Uzupełnij poniższy schemat.
Podaj w przybliżeniu, w ilu dm3 wody będącej w naturalnym obiegu znajduje się 1 mol atomów trytu.
Zadanie 69. (SR11)
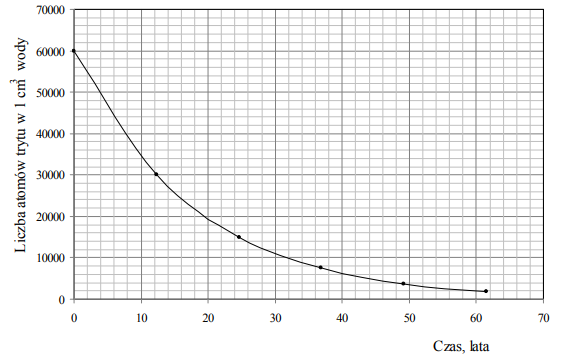
Próbkę wody o objętości 10 cm3 umieszczono w naczyniu i szczelnie zamknięto. Na podstawie poniższego wykresu przedstawiającego zależność liczby atomów trytu w 1 cm3 wody od czasu oszacuj, ile atomów trytu pozostanie w próbce wody o objętości 10 cm3 po 40 latach.
Po 40 latach w próbce pozostanie około 6•104 lub 60000 atomów trytu.
Zadanie 70. (SR11)
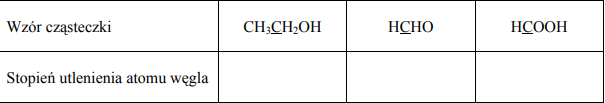
Określ stopnie utlenienia atomów węgla (podkreślone symbole) w cząsteczkach, których wzory podano w tabeli.
Zadanie 71. (SR15)
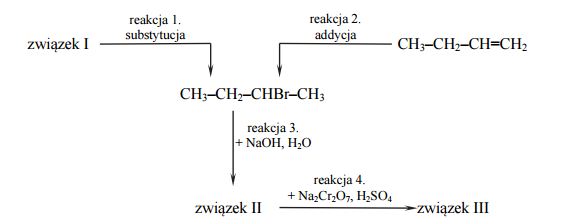
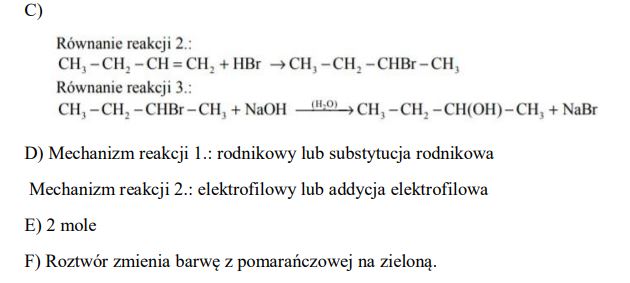
Poniżej przedstawiono schemat przemian, którym poddano: dwa węglowodory − związek oznaczony numerem I i związek o wzorze CH3–CH2–CH=CH2– a także ich pochodne.
Wodny roztwór związku III, który jest jedynym organicznym produktem reakcji 4., ma odczyn obojętny.
Napisz wzory półstrukturalne (grupowe) organicznych związków o numerach I−III.
Napisz nazwy systematyczne związków o poniżej podanych wzorach. CH3–CH2–CH=CH2, CH3–CH2–CHBr–CH3
Napisz, stosując wzory półstrukturalne (grupowe) związków organicznych, równanie reakcji 2. i 3.
Określ mechanizm (elektrofilowy, nukleofilowy, rodnikowy) reakcji 1. i 2.
Określ, ile moli elektronów oddaje 1 mol związku II, gdy przekształca się w związek III w reakcji 4.
Napisz, jak zmienia się barwa wodnego roztworu Na2Cr2O7 zakwaszonego stężonym H2SO4 po wprowadzeniu do niego związku II (reakcja 4.).
Zadanie 72. (SR15)
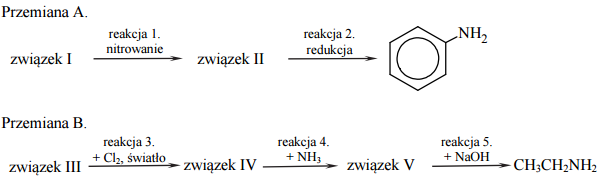
Poniżej przedstawiono dwa schematy ciągów przemian A i B, ilustrujących dwa sposoby otrzymywania amin. Związki, których wzory oznaczono numerami I i III, są węglowodorami.
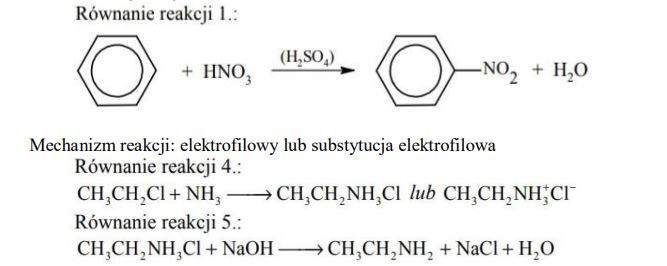
Reakcja nitrowania oznaczona na schemacie numerem 1. jest reakcją substytucji. Stosując wzory półstrukturalne (grupowe) lub uproszczone związków organicznych, napisz w formie cząsteczkowej równanie reakcji 1. oraz określ jej mechanizm (elektrofilowy, nukleofilowy, rodnikowy).
Napisz w formie cząsteczkowej równania reakcji oznaczonych na schemacie numerami 4. i 5. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
Zadanie 73. (SR16)
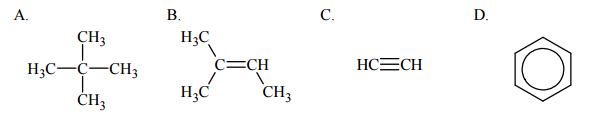
Poniżej podano wzory półstrukturalne (grupowe) lub uproszczone czterech węglowodorów.
Uzupełnij poniższe zdania, tak aby powstały informacje prawdziwe.
- Związek oznaczony literą B nie występuje w postaci izomerów geometrycznych cis–trans, ponieważ ……………………………………………………………………………………………….. ……………………………………………………………………………………………………………………………..
- Węgiel stanowi taki sam procent masy cząsteczek związków oznaczonych literami: ………………………………………. . Wzór empiryczny (elementarny) związku oznaczonego literą D jest następujący: ……………………………………… .
Uzupełnij poniższe zdania – wybierz i zaznacz właściwe nazwy lub litery spośród podanych w nawiasach.
a) Nitrowanie związku oznaczonego literą D jest reakcją (addycji / eliminacji / substytucji) przebiegającą według mechanizmu (elektrofilowego / nukleofilowego / rodnikowego).
b) Z bromem reagują łatwo – bez użycia katalizatora, bez ogrzewania, w ciemności – związki oznaczone literami (A / B / C / D), natomiast reakcja związku oznaczonego literą (A / B / C / D) z tym odczynnikiem wymaga użycia katalizatora, np. FeBr3. Monomerem w reakcji polimeryzacji prowadzącej do powstania poli(octanu winylu) jest związek o wzorze CH2=CH‒O‒COCH3, otrzymywany przez katalityczne przyłączenie kwasu etanowego (octowego) do związku oznaczonego literą (A / B / C / D).
- a) Nitrowanie związku oznaczonego literą D jest reakcją substytucji przebiegającą według mechanizmu elektrofilowego.
- b) Z bromem reagują łatwo – bez użycia katalizatora, bez ogrzewania, w ciemności – związki oznaczone literami B i C , natomiast reakcja związku oznaczonego literą D z tym odczynnikiem wymaga użycia katalizatora, np. FeBr3.
Monomerem w reakcji polimeryzacji prowadzącej do powstania poli(octanu winylu) jest związek o wzorze CH2=CH‒O‒COCH3, otrzymywany przez katalityczne przyłączenie kwasu etanowego (octowego) do związku oznaczonego literą C .
Zadanie 74. (SR16)
Przeprowadzono ciąg przemian opisany poniższym schematem.
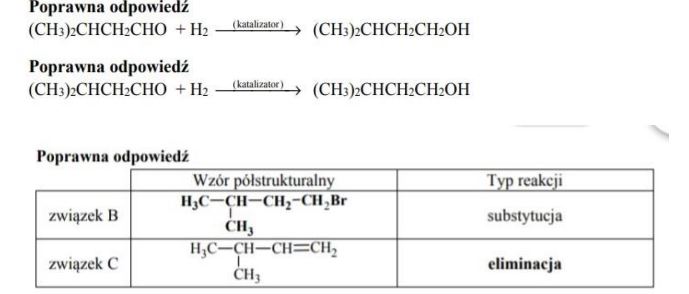
Napisz równanie reakcji prowadzącej do otrzymania produktu A. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
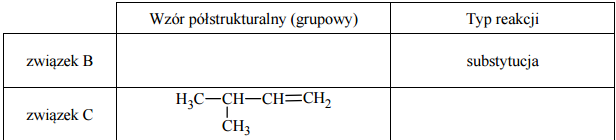
Uzupełnij poniższą tabelę. Podaj wzór półstrukturalny (grupowy) związku organicznego oznaczonego na schemacie literą B. Określ typ reakcji (addycja, eliminacja, substytucja), w wyniku której powstaje związek C.
Zadanie 75. (SR16)
Budowę związku X opisuje następujący wzór:
W cząsteczce związku X można wyróżnić atomy węgla o różnej rzędowości. Określ rzędowość atomów węgla oznaczonych numerami 2, 3 i 4.
Rzędowość atomu węgla numer 2: III numer 3: II numer 4: I
Zadanie 76. (NR15)
Przeprowadzono doświadczenie z udziałem dwóch różnych węglowodorów. W wyniku dwóch odrębnych reakcji − jednej addycji, a drugiej substytucji − i przy użyciu odpowiednich reagentów jako główny produkt każdej reakcji otrzymano 2-bromo-2-metylobutan.
Napisz równania obu reakcji. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
Określ, według jakiego mechanizmu (nukleofilowego, rodnikowego, elektrofilowego) przebiega każda z opisanych reakcji.
Wyjaśnij, dlaczego głównym produktem opisanych reakcji addycji i substytucji jest ta sama monobromopochodna 2-metylobutanu (2-bromo-2-metylobutan).
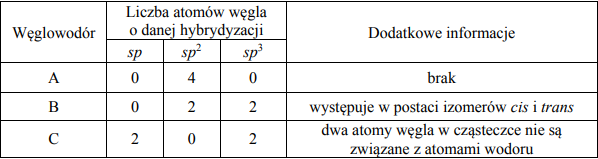
Zadanie 77. (NR18)
W poniższej tabeli zestawiono informacje na temat cząsteczek trzech węglowodorów o prostych (nierozgałęzionych) łańcuchach węglowych.
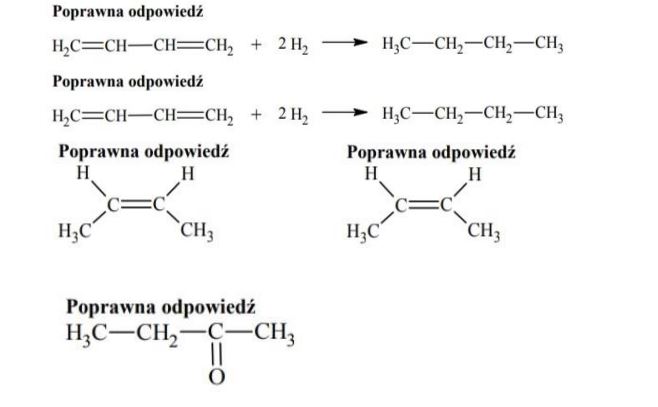
Przeprowadzono reakcję węglowodoru A z wodorem, w której stosunek molowy węglowodoru do wodoru był równy n(węglowodoru A) : n (H2) = 1:2
Napisz równanie reakcji węglowodoru A z wodorem. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
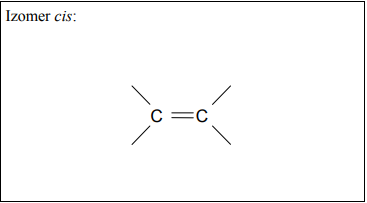
Narysuj wzór półstrukturalny (grupowy) izomeru cis węglowodoru B.
Przeprowadzono reakcję węglowodoru C z wodą w stosunku molowym n(węglowodoru C) : n (H2O) = 1:1
Napisz wzór półstrukturalny (grupowy) trwałego (dominującego) produktu reakcji, której substratami są węglowodór C i woda.