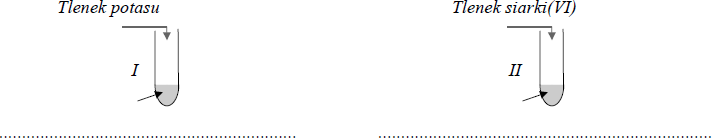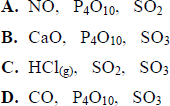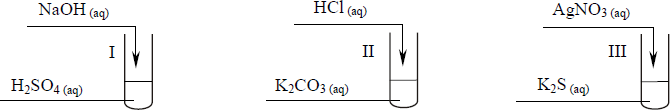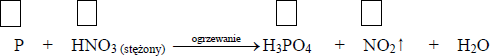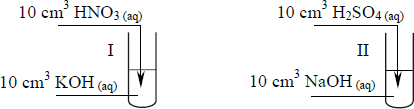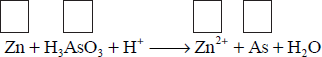Zadania maturalne z Chemii
Tematyka: tlenki, wodorotlenki, kwasy, sole; charakterystyczne reakcje, właściwości i otrzymywanie.
Zadania pochodzą z oficjalnych arkuszy maturalnych CKE, które służyły przeprowadzaniu majowych egzaminów. Czteroznakowy kod zapisany przy każdym zadaniu wskazuje na jego pochodzenie: S/N – „stara”/”nowa” formuła; P/R – poziom podstawowy/rozszerzony; np. 08 – rok 2008.
Zbiór zadań maturalnych w formie arkuszy, możesz pobrać >> TUTAJ <<.
Zadanie 1. (SP05)
Reakcja rozkładu tlenku azotu(V) przebiega według równania: 2N2O5(g) → 4NO2(g) + O2(g)
Przedstaw interpretację ilościową powyższego równania, uzupełniając wolne miejsca w tabelce:
1 mol O2
184 g NO2 lub 4· 46 g NO2
44,8 dm3
N2O5 lub 2· 22,4 dm3
N2O
Zadanie 2. (SP05)
Uszereguj tlenki: CaO, MgO i Na2O zgodnie ze wzrostem charakteru zasadowego.
MgO, CaO, Na2O
Zadanie 3. (SP05)
Spośród niżej podanych właściwości
I. Rozpuszczanie go w wodzie jest procesem endoenergetycznym,
II. Jego stężony wodny roztwór działa parząco na skórę,
III. Jest higroskopijny,
IV. Jego roztwór jest słabym elektrolitem,
V. Chłonie tlenek węgla(IV) z powietrza, tworząc węglan sodu.
Wybierz i zaznacz te, które są prawdziwe dla wodorotlenku sodu:
A. I, II, III
B. II, III, IV
C. II, IV, V
D. II, III,V
odp. D
Zadanie 4. (SP05)
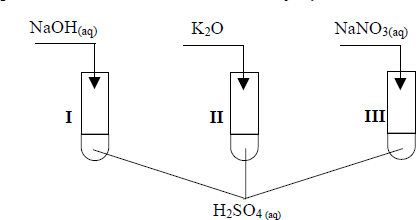
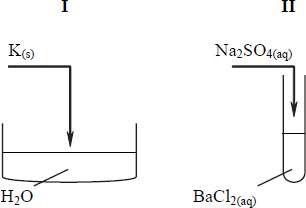
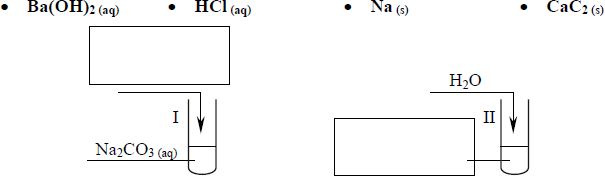
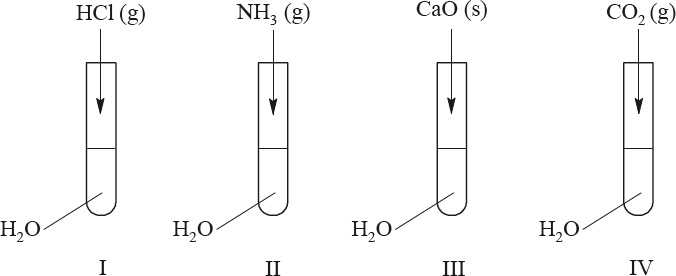
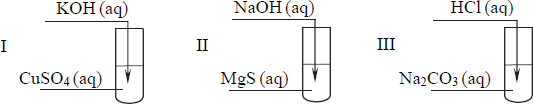
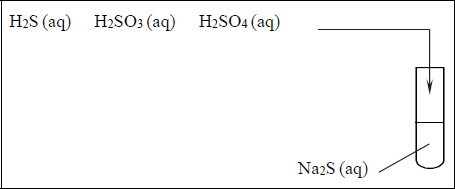
Uczeń przeprowadził doświadczenia, które ilustruje rysunek:
Przedstaw, w formie jonowej skróconej, równania reakcji zachodzących w probówkach I, II i III lub zaznacz, że reakcja nie zachodzi.
Zadanie 5. (SP05)
Napisz, co zaobserwowano podczas doświadczenia przedstawionego na rysunku.
wydzielanie się (pęcherzyków) gazu, pienienie się cieczy (roztworu)
Zadanie 6. (SP05)
Efekt energetyczny pewnej reakcji scharakteryzowano następująco: nastąpiło przekazanie energii z otoczenia do układu; energia wewnętrzna układu wzrosła.
Analizując tekst określ, czy reakcja jest egzoenergetyczna czy endoenergetyczna.
(reakcja) endoenergetyczna
Zadanie 7. (SP05)
Zaprojektuj doświadczenie, za pomocą którego można wykazać charakter chemiczny tlenków P4O10 i Na2O, mając do dyspozycji wodę i papierek uniwersalny.
Narysuj schemat doświadczenia, podaj spostrzeżenia i wniosek.
– za schemat doświadczenia przedstawiający dwie probówki zawierające tlenki i wodę (reagenty mogą być podane w dowolnej kolejności; nie musi być zaznaczony papierek)
– za spostrzeżenia, odpowiednie do zaprojektowanego doświadczenia np.: w probówce, w której do wody dodano P4O10, papierek uniwersalny zabarwił się na czerwono (różowo), a w probówce, w której do wody dodano Na2O, papierek uniwersalny zabarwił się na niebiesko lub niebiesko-zielono lub zielono
– za wnioski: P4O10 – (charakter) kwasowy Na2O – (charakter) zasadowy
Zadanie 8. (SP05)
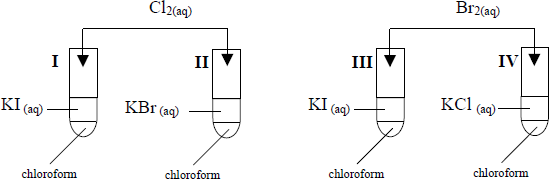
W celu porównania aktywności wybranych fluorowców, wykonano doświadczenia zgodnie z przedstawionym poniżej rysunkiem:
Podaj, w których probówkach przebiegały reakcje chemiczne oraz sformułuj wniosek dotyczący aktywności chloru, bromu i jodu.
– I, II i III
– najaktywniejszy jest chlor (Cl, Cl2), (mniej aktywny brom (Br, Br2)), a najmniej aktywny jod (I, I2) lub: aktywność fluorowców maleje ze wzrostem masy (liczby) atomowe
Zadanie 9. (SP05)
Wiele proszków do prania zawiera w swoim składzie fosforany(V) sodu. Ich zadaniem jest zmiękczanie wody (usuwanie jonów wapnia i magnezu). Fosforany(V) sodu wraz ze ściekami komunalnymi dostają się do zbiorników wodnych.
Podaj nazwę zjawiska wywołanego wzbogacaniem zbiorników wodnych w związki fosforu i określ, jaki jest jego skutek.
– eutrofizacja, użyźnianie
– gwałtowny rozwój flory bakteryjnej lub glonów, nadmierne zarastanie zbiorników wodnych, zmniejszenie zawartości tlenu w wodzie, obumieranie organizmów typowych dla określonych zbiorników, zanik życia w zbiornikach wodnych, obumieranie zbiorników wodnych
Zadanie 10. (SP05)
Z podanego poniżej zbioru kwasów wybierz i wpisz do tabeli te, które można zaliczyć do odpowiednich grup.
Stężony kwas siarkowy(VI), kwas chlorowodorowy (solny), kwas siarkowodorowy, kwas etanowy (octowy), stężony kwas azotowy(V), kwas bromowodorowy.
kwasy o właściwościach silnie utleniających: stężony kwas siarkowy(VI) i stężony kwas azotowy(V) lub podanie wzorów: H2SO4 i HNO3
kwasy słabe: kwas siarkowodorowy i kwas octowy lub podanie wzorów H2S i CH3COOH
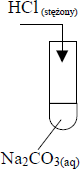
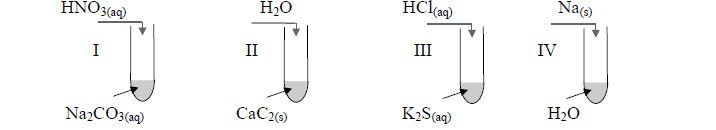
Zadanie 11. (SP05)
W laboratorium uczeń chciał otrzymać trudno rozpuszczalne związki i wykonał doświadczenia przedstawione na poniższym rysunku:
Wskaż, w której probówce nie wytrącił się osad
probówka II
Zadanie 12. (SP05)
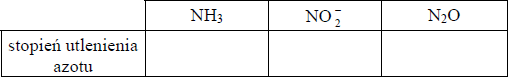
Określ stopnie utlenienia azotu w podanych w tabeli cząsteczkach i jonie:
NH3 = -III
NO2- = III
N2O = I
Zadanie 13. (SP06)
Chlorek glinu otrzymuje się w reakcji glinu z chlorowodorem lub działając chlorem na glin. Związek ten tworzy kryształ, rozpuszczalne w wodzie zakwaszonej kwasem solnym. Z roztworów tych krystalizuje uwodniona sól – tak zwany heksahydrat chlorku glinu. Hydraty (sole uwodnione) to sole zawierające w sieci krystalicznej cząsteczki wody, np. dekahydrat węglanu sodu Na2Co3•10H2O. Zapis ten oznacza, że w sieci krystalicznej tej soli na 2 jony Na1 i jon Co32- przypada 10 cząsteczek wody. Chlorek glinu jest stosowany jako katalizator w wielu syntezach organicznych.
Na podstawie: Encyklopedia szkolna. Chemia. Warszawa 2001.
a) Napisz w formie cząsteczkowej równania reakcji ilustrujące wymienione w informacji metody otrzymywania chlorku
Równanie reakcji ilustrujące I metodę:
Równanie reakcji ilustrujące II metodę:
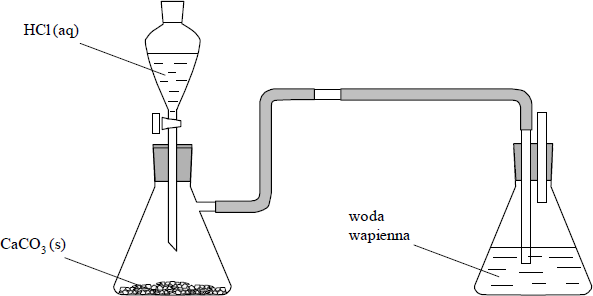
b) Podaj liczbę moli chloru cząsteczkowego, która całkowicie przereaguje z jednym molem glinu.
a) Równanie reakcji ilustrujące I metodę: 2Al + 6HCl → 2AlCl3 + 3H2
Równanie reakcji ilustrujące II metodę: 2Al + 3Cl2 → 2AlCl3
b) 1,5 mola
Zadanie 14. (SP06)
Dysponujesz wodnymi roztworami następujących soli: KNO3, AgNO3, Ba(NO3)2 Korzystając z tablicy rozpuszczalności, wybierz spośród nich roztwór tej soli, za pomocą którego wytrącisz z wodnego roztworu chlorku glinu jony chlorkowe w postaci trudno rozpuszczalnego osadu.
Napisz w formie jonowej skróconej równanie reakcji zachodzącej w czasie mieszania tych roztworów.
a) wzór odczynnika (wpisz wzór soli):
b) równanie reakcji w formie jonowej skróconej:
a) AgNO3
b) Ag+ + Cl– → AgCl↓
Zadanie 15. (SP06)
Tlenek magnezu ma zastosowanie do produkcji cegieł, którymi wykłada się wnętrza pieców hutniczych. Związek ten stosuje się również w medycynie jako składnik leków przeciw nadkwasocie (dolegliwości polegającej na nadmiernym wydzielaniu się w żołądku kwasu solnego).
a) Korzystając z tablicy elektroujemności, oblicz różnicę elektroujemności magnezu i tlenu, a następnie określ rodzaj wiązania chemicznego w tlenku
Różnica elektroujemności: ……………………………………………………………………………………………..
Rodzaj wiązania: …………………………………………………………………………………………………………..
b) Poniżej wymieniono pięć właściwości fizycznych tlenku magnezu. Spośród nich wybierz i podkreśl dwie, uzasadniające zastosowanie tego związku do obudowy wnętrz pieców
ma wysoką temperaturę topnienia; ma wysoką temperaturę wrzenia; jest ciałem stałym; stopiony przewodzi prąd elektryczny; jest białej barwy
a)Różnica elektroujemności: 3,5 – 1,2 = 2,3
Rodzaj wiązania: jonowe
b)ma wysoką temperaturę topnienia; ma wysoką temperaturę wrzenia; jest ciałem stałym; stopiony przewodzi prąd elektryczny; jest białej barwy
Zadanie 16. (SP06)
Tlenek magnezu ma zastosowanie do produkcji cegieł, którymi wykłada się wnętrza pieców hutniczych. Związek ten stosuje się również w medycynie jako składnik leków przeciw nadkwasocie (dolegliwości polegającej na nadmiernym wydzielaniu się w żołądku kwasu solnego).
a) Napisz w formie cząsteczkowej równanie reakcji zachodzącej w żołądku po zażyciu przez osobę cierpiąca na nadkwasotę leku zawierającego tlenek magnezu.
b) Określ, jaki charakter chemiczny (kwasowy, zasadowy, obojętny) przejawia tlenek magnezu w tej reakcji.
a) MgO + 2HCl → MgCl2 + H2O
b) zasadowy
Zadanie 17. (SP06)
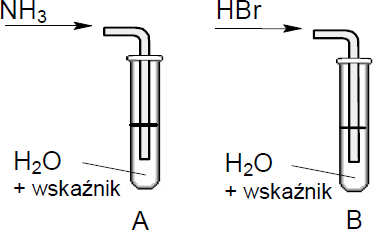
W celu zbadania zachowania gazowego amoniaku i bromowodoru wobec wody wykonano doświadczenia, które ilustruje poniższy rysunek. Określ odczyn roztworów otrzymanych w obu probówkach.
Odczyn roztworu w probówce A: ……………………………………………………………………………………
Odczyn roztworu w probówce B: ……………………………………………………………………………………
Odczyn roztworu w probówce A: zasadowy
Odczyn roztworu w probówce B: kwasowy
Zadanie 18. (SP06)
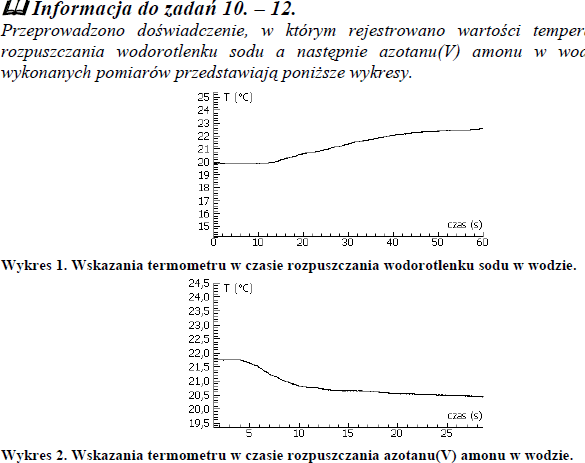
Przeprowadzono doświadczenie, w którym rejestrowano wartości temperatur rozpuszczenia wodorotlenku sodu, a następnie azotanu (V) amonu w wodzie. Wyniki wykonanych pomiarów przedstawiają poniższe wykresy.
a) Określ efekt energetyczny rozpuszczania w wodzie wodorotlenku sodu i azotanu(V) amonu. W tym celu uzupełnij następujące zdania.
Rozpuszczanie wodorotlenku sodu w wodzie jest procesem ………………………………………………, ponieważ w czasie tego procesu temperatura …………………………………………………………………… Rozpuszczanie azotanu(V) amonu w wodzie jest procesem ………………………………………………, ponieważ w czasie tego procesu temperatura ……………………………………………………………………
b) Spośród poniższych zdań wybierz to, które jest poprawnie sformułowanym wnioskiem na temat efektów energetycznych procesów rozpuszczania związków jonowych w wodzie, jaki można wyciągnąć na podstawie tego doświadczenia.
A. Na podstawie wyników tego doświadczenia nie można wnioskować o efekcie cieplnym rozpuszczania związków jonowych w wodzie, ponieważ wodorotlenek sodu i azotan(V) amonu nie są związkami jonowymi.
B. Rozpuszczaniu związków jonowych w wodzie zawsze towarzyszy wydzielenie ciepła.
C. Rozpuszczaniu związków jonowych w wodzie zawsze towarzyszy pochłonięcie ciepła.
D. Rozpuszczaniu związków jonowych w wodzie może towarzyszyć wydzielenie lub pochłonięcie ciepła.
a) Rozpuszczanie wodorotlenku sodu w wodzie jest procesem egzotermicznym, ponieważ w czasie tego procesu temperatura rośnie. Rozpuszczanie azotanu(V) amonu w wodzie jest procesem endotermicznym, ponieważ w czasie tego procesu temperatura maleje
b) D. Rozpuszczaniu związków jonowych w wodzie może towarzyszyć wydzielenie lub pochłonięcie ciepła.
Zadanie 19. (SP06)
Wybierz poprawne sformułowanie.
Chlorku miedzi(II) nie można otrzymać działając
A. kwasem solnym na tlenek miedzi(II).
B. kwasem solnym na wodorotlenek miedzi(II).
C. kwasem solnym na miedź.
D. chlorem na miedź.
Odp. C
Zadanie 20. (SP06)
W jednej probówce znajduje się wodny roztwór chlorku potasu, a w drugiej – wodny roztwór bromku potasu. Którego odczynnika – Br2(aq) czy Cl2(aq) – należy użyć, aby rozróżnić te roztwory? Podaj wzór chemiczny wybranego odczynnika oraz przewidywane obserwacje.
Napisz w formie cząsteczkowej równanie reakcji, będącej podstawą rozróżnienia tych roztworów.
Wzór odczynnika: ……………………………..
Obserwacje: …………………………………..
Równanie reakcji: ……………………………..
Wzór odczynnika: Cl2 (aq) Obserwacje: W roztworze bromku potasu pojawia się ciemnopomarańczowe zabarwienie, w roztworze chlorku potasu nie obserwujemy żadnych zmian.
Równanie reakcji: Cl2 + 2KBr → Br2 + 2KCl
Zadanie 21. (SP06)
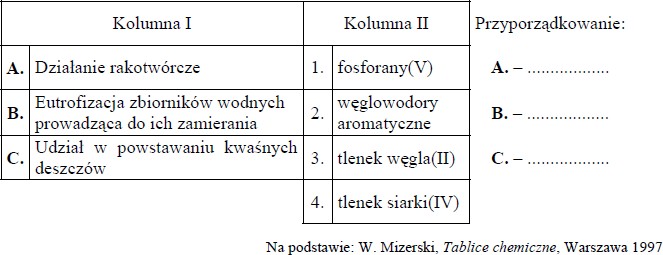
W kolumnie I poniższej tabeli przedstawiono skutki działania substancji chemicznych, a w kolumnie II wymieniono nazwy substancji, które mogą je wywoływać.
Przyporządkuj każdemu skutkowi nazwę jednej substancji, która go wywołuje.
A. – 2
B. – 1
C. – 4
Zadanie 22. (SP06)
Ozon obecny w stratosferze (warstwie atmosfery położonej powyżej troposfery) pochłania szkodliwe promieniowanie ultrafioletowe. Zmniejszenie ilości ozonu w tej warstwie może mieć istotny wpływ na funkcjonowanie organizmów. Stężenie ozonu w troposferze (przyziemnej warstwie atmosfery) jest znacznie mniejsze niż w stratosferze. Wzrost ilości ozonu troposferycznego pozostaje w ścisłym związku ze wzrostem liczby przypadków astmy i problemów z układem oddechowym wśród populacji miejskiej.
Na podstawie: Peter O`Niell: Chemia środowiska, Warszawa 1997
Przeanalizuj przytoczony tekst i z poniższych zdań wybierz zdanie prawdziwe.
- Zmniejszenie ilości ozonu stratosferycznego i wzrost ilości ozonu troposferycznego są zjawiskami pozytywnymi.
- Zmniejszenie ilości ozonu stratosferycznego jest zjawiskiem pozytywnym, a wzrost ilości ozonu troposferycznego jest zjawiskiem negatywnym.
- Zmniejszenie ilości ozonu stratosferycznego jest zjawiskiem negatywnym, a wzrost ilości ozonu troposferycznego jest zjawiskiem pozytywnym.
- Zmniejszenie ilości ozonu stratosferycznego i wzrost ilości ozonu troposferycznego są zjawiskami negatywnymi.
Odp. D
Zadanie 23. (SP07)
Korzystając ze skali elektroujemności wg Paulinga, określ rodzaj wiązania chemicznego w następujących związkach:
RbCl ………………………………………………………………………..
CO2 ………………………………………………………………………..
PH3 ………………………………………………………………………..
RbCl – wiązanie jonowe
CO2 – wiązanie kowalencyjne spolaryzowane
PH3 – wiązanie kowalencyjne
Zadanie 24. (SP07)
Napisz równanie reakcji magnezu z parą wodną. Określ charakter chemiczny produktu reakcji zawierającego magnez.
Równanie reakcji: ……………………………………………………………………………………………………………..
Charakter chemiczny: ………………………………………………………………………………………………………..
Równanie reakcji: Mg + 2H2O → Mg(OH)2 + H2
Charakter chemiczny: zasadowy
Zadanie 25. (SP07)
Wskaż prawidłowe zakończenie poniższego zdania. Do gaszenia płonącego magnezu nie należy używać wody, gdyż
A. powstaje substancja nierozpuszczalna w wodzie.
B. wydziela się palny gaz.
C. wydziela się trujący gaz.
D. powstaje łatwopalny związek magnezu.
Odp. B
Zadanie 26. (SP07)
Przedstaw projekt doświadczenia, którego celem jest określenie charakteru chemicznego tlenku potasu i tlenku siarki(VI). W tym celu:
a) Uzupełnij poniższy opis doświadczenia, wpisując nazwy potrzebnych odczynników wybranych spośród następujących: woda, oranż metylowy,
b) Napisz, jakie obserwacje umożliwią określenie charakteru chemicznego tlenków (uwzględnij zmianę barwy wybranych wskaźników).
c) Napisz w formie cząsteczkowej równania zachodzących
a)
b)
I: Roztwór zabarwia się na malinowo.
II: Roztwór zmienia barwę z żółtej na czerwoną.
c)
I: K2O + H2O → 2KOH
II: SO3 + H2O → H2SO4
Zadanie 27. (SP07)
Przeprowadzono następujące doświadczenia:
Wskaż numer probówki, w której wydzielił się trujący gaz o charakterystycznym, przykrym zapachu.
A. I
B. II
C. III
D. IV
Odp. C
Zadanie 28. (SP07)
W kolumnie I przedstawiono nazwy wybranych zjawisk, a w kolumnie II nazwy substancji, których nadmiar może być przyczyną występowania tych zjawisk.
Przyporządkuj zjawiskom z kolumny I odpowiednie nazwy substancji z kolumny II.
- C
- B
- A
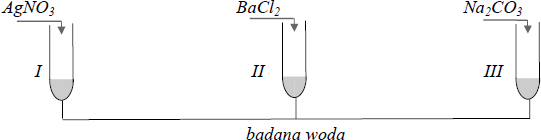
Zadanie 29. (SP07)
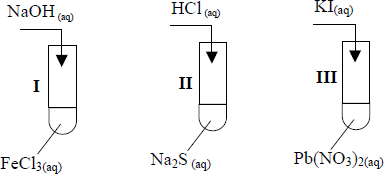
Na etykiecie wody mineralnej podano informację, że zawiera ona między innymi kationy: Na+ , K+ , Ca2+ oraz aniony: Cl – , SO4 2– . W celu potwierdzenia obecności jonów w tej wodzie przeprowadzono doświadczenie, którego przebieg przedstawiono na poniższym rysunku. Jako odczynników użyto stężonych roztworów soli. We wszystkich probówkach zaobserwowano powstanie białych osadów.
Podaj wzory jonów, których obecność potwierdzono, a następnie napisz w formie jonowej skróconej równania reakcji, jakie przebiegały podczas doświadczenia.
Potwierdzono obecność jonów
I: ………………………………………
II: ……………………………………..
III: …………………………………….
Równania reakcji (w formie jonowej skróconej):
I: ………………………………………..
II: ……………………………………….
III: ………………………………………
Potwierdzono obecność jonów:
I: Cl–
II: SO42-
III: CO32-
Równania reakcji (w formie jonowej skróconej):
I: Ag+ + Cl– → AgCl↓
II: Ba2+ + SO42- → BaSO4↓
III: Ca2+ + CO32- → CaCO3↓
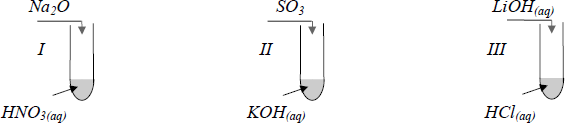
Zadanie 30. (SP07)
Przeprowadzono następujące doświadczenia, podczas których otrzymano różne sole.
Przedstaw w formie cząsteczkowej równania reakcji chemicznych, które zaszły w każdej probówce.
Probówka I: ………………………………………………………………………………………………………………………
Probówka II: …………………………………………………………………………………………………………………….
Probówka III: ……………………………………………………………………………………………………………………
Probówka I: Na2O + 2HNO3 → 2NaNO3 + H2O
Probówka II: 2KOH + SO3 → K2SO4 + H2O
Probówka III: LiOH + HCl → LiCl + H2O
Zadanie 31. (SP08)
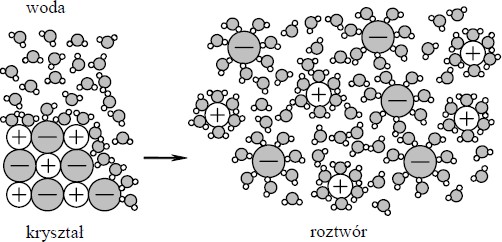
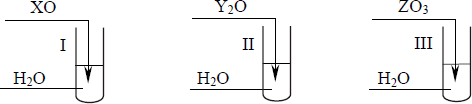
Na rysunku przedstawiono schemat ilustrujący proces rozpuszczania w wodzie pewnej substancji.
Spośród związków, których wzory wymieniono poniżej, wybierz ten, którego rozpuszczanie w wodzie można przedstawić za pomocą tego schematu.
CBr4; HCl; KCl
Wybrany związek: …………………………………………
KCl
Zadanie 32. (SP08)
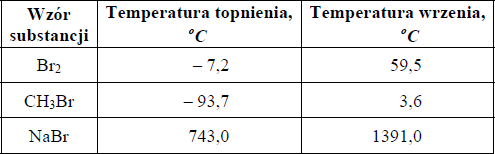
W tabeli podano wartości temperatury topnienia i temperatury wrzenia wybranych substancji (mierzone pod ciśnieniem 1013 hPa).
Określ stan skupienia wymienionych substancji w temperaturze pokojowej (ok. 20°C) i pod ciśnieniem 1013 hPa.
Br2: ………………………………………………………….
CH3Br: …………………………………………………….
NaBr: ……………………………………………………….
Br2: ciekły
CH3Br: gazowy
NaBr: stały
Zadanie 33. (SP08)
Dysponujesz trzema probówkami, w których znajdują się wodne rozcieńczone roztwory wodorotlenku sodu, kwasu azotowego(V) oraz azotanu(V) sodu.
Nie wiesz jednak, który roztwór znajduje się w której probówce.
a) Spośród następujących wskaźników kwasowo-zasadowych wybierz jeden, za pomocą którego można określić zawartość każdej probówki:
fenoloftaleina; oranż metylowy; papierek uniwersalny
Wybrany wskaźnik: ……………………………………………………………………………………………………….
b) Napisz przewidywane obserwacje, wpisując do tabeli barwy, jakie wybrany wskaźnik przybiera w badanych
a) Wybrany wskaźnik: papierek uniwersalny
b) wodorotlenek sodu – granatowa
kwasu azotowego(V) – czerwona
azotanu(V) sodu – żółta
Zadanie 34. (SP08)
Określ charakter chemiczny (kwasowy lub zasadowy) tlenku wapnia i tlenku siarki(VI). Napisz w formie cząsteczkowej równania reakcji każdego z tych tlenków odpowiednio z wodorotlenkiem sodu lub z kwasem solnym.
CaO – zasadowy – CaO + 2HCl → CaCl2 + H2O
SO3 – kwasowy – SO3 + 2Na2SO4 + H2O
Zadanie 35. (SP08)
Napisz w formie cząsteczkowej:
a) równania reakcji, za pomocą których można z siarki otrzymać tlenek siarki(VI).
b) równanie reakcji otrzymywania tlenku wapnia z węglanu wapnia, zaznaczając, w jakich warunkach zachodzi ta reakcja.
a)
b)
Zadanie 36. (SP08)
Kamień budowlany, zawierający węglan wapnia (CaCO3) lub magnezu (MgCO3), łatwo ulega atakowi kwaśnego opadu atmosferycznego, w wyniku którego powstają rozpuszczalne w wodzie sole wapnia lub magnezu.
Na podstawie: Peter O’Neill, „Chemia środowiska”, Warszawa – Wrocław 1997
Dokończ poniższy schemat tak, aby otrzymać skrócony jonowy zapis równania opisanej reakcji z udziałem węglanu wapnia.
CaCO3 + 2H+ → ………………………………………………………….
CaCO3 + 2H+→ Ca2+ + H2O + CO2↑
Zadanie 37. (SP08)
Przeprowadzono doświadczenie, którego przebieg zilustrowano na poniższym rysunku.
Napisz w formie jonowej równania reakcji zachodzących w probówkach I i II (w razie potrzeby skorzystaj z tablicy rozpuszczalności).
Równanie I:
2K + 2H2O → 2K+ + 2OH– +H2↑
Równanie II:
Ba2+ + 2Cl– + 2Na+ + SO42- → BaSO4↓ +2Na+ +2Cl–
Zadanie 38. (SP08)
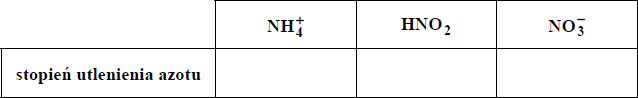
Określ stopnie utlenienia azotu w cząsteczce i jonach, których wzory podano w tabeli.
NH4+ = -III
HNO2 = III
NO3- = V
Zadanie 39. (SP08)
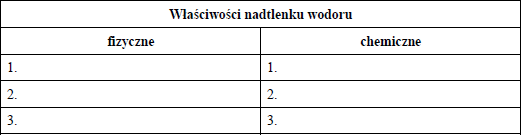
Nadtlenek wodoru, H2O2 to bezbarwna ciecz, której gęstość w temperaturze 25°C jest równa 1,44 g/cm3. Temperatura topnienia H2O2 wynosi – 0,4°C, a temperatura wrzenia 152°C. Nadtlenek wodoru jest silnym utleniaczem, może również działać jako reduktor. Jest bardzo słabym kwasem. Nadtlenek wodoru w postaci wodnego roztworu o stężeniu 30% masowych nosi nazwę perhydrolu. Wodny roztwór H2O2 o stężeniu 6% masowych stosuje się do rozjaśniania włosów, zaś wodny roztwór tego związku o stężeniu 3% masowych to woda utleniona, która jest używana jako środek bakteriobójczy.
Na podstawie: L. Jones, P. Atkins „Chemia ogólna. Cząsteczki, materia, reakcje”, Warszawa 2004.
a) Z powyższego tekstu wybierz trzy właściwości fizyczne i trzy właściwości chemiczne nadtlenku wodoru. Zapisz je w tabeli.
b) Spośród właściwości chemicznych nadtlenku wodoru wybierz i podaj tę, która decyduje o zastosowaniu tego związku (w postaci rozcieńczonego wodnego roztworu) do rozjaśniania włosów. Zapisz obserwacje, jakich można było dokonać w czasie tego doświadczenia.
a) fizyczne:
- bezbarwny
- gęstość równa 1,44g/cm3
- temperatura wrzenia równa 152 ⁰C
chemiczne:
- silny utleniacz
- może być reduktorem
- bardzo słaby kwas
b) Jest silnym utleniaczem.
Zadanie 40. (SP08)
Nadtlenek wodoru jest związkiem nietrwałym. Ulega reakcji rozkładu według równania:
2 H2O2 → 2 H2O + O2
Reakcja ta w temperaturze pokojowej zachodzi powoli, lecz katalizuje ją obecność różnych substancji, na przykład MnO2.
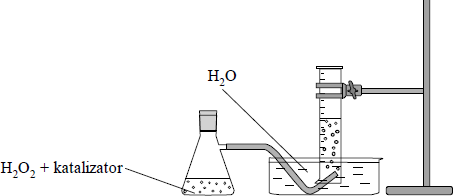
Wykonano doświadczenie, którego przebieg ilustruje poniższy rysunek:
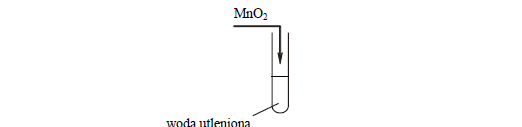
Zadanie 41. (SP09)
Korzystając ze skali elektroujemności według Paulinga, określ rodzaj wiązania chemicznego w następujących substancjach: CaBr2,Br2, HBr.
CaBr2 – wiązanie jonowe
Br2 – wiązanie kowalencyjne
HBr – wiązanie kowalencyjne spolaryzowane
Zadanie 42. (SP09)
Spośród podanych niżej właściwości a, b, c, d, e, f wybierz te, które są charakterystyczne dla chlorku sodu ze względu na występujący w nim rodzaj wiązania. Zapisz litery oznaczające te właściwości.
a) Tworzy kryształy
b) Nie ulega dysocjacji
c) Rozpuszcza się w rozpuszczalnikach polarnych.
d) Topi się w wysokiej
e) Rozpuszcza się w rozpuszczalnikach niepolarnych.
f) Stopiony przewodzi prąd
Właściwości: a, c, d, f
Zadanie 43. (SP09)
Podkreśl zbiór zawierający wyłącznie wzory związków, które w wyniku reakcji z wodą lub po rozpuszczeniu w wodzie tworzą kwasy.
C. (HCl(gaz), SO2, SO3)
Zadanie 44. (SP09)
W celu porównania aktywności wybranych fluorowców przeprowadzono kilka doświadczeń. Po ich zakończeniu sformułowano wnioski w formie równań reakcji (jeśli reakcja przebiegła) i przedstawiono je w poniższej tabeli.
Korzystając z powyższych informacji, uszereguj badane niemetale (brom, chlor i jod) pod względem aktywności od najmniejszej do największej.
jod, brom, chlor
Zadanie 45. (SP09)
Litowce reagują z wodą. Reakcja litu z wodą przebiega najmniej gwałtownie. Podczas reakcji sodu z wodą wydzielające się ciepło wystarcza do stopienia metalu. Potas zapala się w zetknięciu z wodą. Jeszcze gwałtowniej działają na wodę rubid i cez. Ten ostatni jest tak aktywny, że zapala się samorzytnie w zetknięciu z powietrzem nawet w obecności wody.
Na podstawie: A. Bielański: Podstawy chemii nieorganicznej, Wydawnictwo Naukowe PWN, Warszawa 2004.
a) Korzystając z powyższych informacji, uszereguj opisane metale (cez, lit, potas, rubid, sód) pod względem aktywności od najmniejszej do największej.
b) Napisz w formie cząsteczkowej równanie reakcji litowca z wodą, wiedząc, że jednym z jej produktów jest wodorotlenek. Zastosuj ogólny symbol metalu M.
a) lit, sód, potas, rubid, cez
b) 2M + 2H2O → 2MOH + H2↑
Zadanie 46. (SP09)
Napisz w formie cząsteczkowej równania trzech różnych reakcji, za pomocą których można otrzymać chlorek wapnia. Substraty reakcji wybierz spośród zaproponowanych poniżej.
HCl (aq); Ca; Ca(NO3)2(aq); CaO(s); Cl2(g); Ca(OH)2 (aq);
- Ca + Cl2 → CaCl2
- Ca + 2HCl → CaCl2 + H2↑
- Ca(OH)2 + 2HCl → CaCl2 + 2H2O
- CaO + 2HCl → CaCl2 + H2O
Zadanie 47. (SP09)
Z poniższych zbiorów podkreśl ten, który zawiera wyłącznie wzory mocnych elektrolitów.
A. H2O, KCl, NaOH
B. Na2SO4, KOH, H2S C.FeCl3,
C. Ca(NO3)2, CH3COOH
D. NaCl, Fe2(SO4)3, HNO3
D. (NaCl, Fe2(SO4)3, HNO3)
Zadanie 48. (SP09)
Przeczytaj poniższe zdania i zakwalifikuj opisane reakcje (1, 2 i 3) do egzotermicznych lub endotermicznych.
1. W wyniku spalania tlenku węgla(II) powstaje tlenek węgla(IV). Tlenek węgla(II) jest wysokoenergetycznym paliwem.
2. W wyniku ogrzewania manganianu(VII) potasu otrzymuje się tlen. Przerwanie ogrzewania powoduje zaprzestanie wydzielania się gazu.
3. Podczas reakcji cynku z kwasem solnym można zaobserwować wzrost temperatury reagentów w probówce.
Reakcja 1. ………………………………………………………
Reakcja 2. ………………………………………………………
Reakcja 3. ………………………………………………………
Reakcja 1 – egzotermiczna
Reakcja 2 – endotermiczna
Reakcja 3 – egzotermiczna
Zadanie 49. (SP09)
Wodorotlenek sodu otrzymywano dawniej w wyniku reakcji węglanu sodu i wodorotlenku wapnia.
Napisz w formie cząsteczkowej równanie reakcji otrzymywania wodorotlenku sodu podaną metodą i wyjaśnij, dlaczego możliwe jest oddzielenie jego roztworu od drugiego produktu reakcji poprzez sączenie lub dekantację.
Na2CO3 + Ca(OH)2 → 2NaOH + CaCO3↓
Zadanie 50. (SP09)
Podkreśl właściwe zakończenie zdania.
W reakcji zilustrowanej równaniem: Al2O3 + 3Cl2 + 3C → 2AlCl3 + 3CO
A. chlor jest reduktorem.
B. węgiel jest reduktorem.
C. węgiel redukuje się.
D. chlor utlenia się.
Powstaje nierozpuszczalny w wodzie CaCO3 i można go oddzielić od roztworu NaOH poprzez sączenie lub dekantację.
Zadanie 51. (SP09)
Krzemian wapnia można otrzymać w wyniku reakcji przebiegającej zgodnie ze schematem:
CaSO4 + C + SiO2 → CaSiO3 + SO2↑ + CO2↑
Stosując metodę bilansu elektronowego, dobierz współczynniki stechiometryczne i zapisz równanie tej reakcji.
Zadanie 52. (SP10)
Lit i sód to aktywne metale, które w związkach chemicznych przyjmują stopień utlenienia I. Reakcje litu i sodu z chlorem i siarką przebiegają podobnie – ich produktami są odpowiednie chlorki oraz siarczki. Reakcją, która odróżnia lit od sodu, jest utlenianie obu metali w strumieniu tlenu. Lit tworzy w tych warunkach tlenek o wzorze Li2O, a sód – nadtlenek o wzorze Na2O2. Oba metale reagują z wodą, przy czym reakcja sodu z wodą przebiega gwałtowniej niż reakcja litu z wodą.
a) Napisz, jakie stopnie utlenienia przyjmują sód i tlen w nadtlenku sodu (Na2O2).
Stopień utlenienia sodu: ……………………………..
Stopień utlenienia tlenu: ……………………………..
b) Napisz w formie cząsteczkowej równanie reakcji otrzymywania siarczku sodu z pierwiastków.
a) Stopień utlenienia sodu: I Stopień utlenienia tlenu: –I
b) 2Na + S → Na2S
Zadanie 53. (SP10)
Wśród substancji o wzorach: Cl2, I2, KCl, KI, HCl, HI znajduje się substrat X oraz produkt Y reakcji opisanej schematem: KBr + X → Br2 + Y
Napisz w formie cząsteczkowej równanie reakcji zilustrowanej schematem, zastępując litery X i Y wzorami substancji wybranymi spośród podanych w informacji (pamiętaj o uzgodnieniu współczynników stechiometrycznych).
2KBr + Cl2 → Br2 + 2KCl
Zadanie 54. (SP10)
Amoniak (NH3) wytwarza się w przemyśle w drodze bezpośredniej syntezy z pierwiastków (sposób 1). W laboratorium amoniak można otrzymać, działając na chlorek amonu (NH4Cl) mocną zasadą, np. NaOH (sposób 2), lub przez rozkład termiczny chlorku amonu (sposób 3).
Napisz w formie cząsteczkowej równania opisanych reakcji.
Sposób 1: ………………………………………………………..
Sposób 2: ………………………………………………………..
Sposób 3: ………………………………………………………..
- Równania reakcji
Sposób 1: N2 + 3H2 → 2NH3
Sposób 2: NH4Cl + NaOH → NH3 + NaCl + H2O
NH4Cl + NaOH → NH3‧H2O + NaCl
Zadanie 55. (SP10)
Korzystając z tabeli rozpuszczalności, zaprojektuj doświadczenie umożliwiające odróżnienie umieszczonych w oddzielnych, nieoznakowanych probówkach dwóch wodnych roztworów: chlorku baru (BaCl2) i chlorku potasu (KCl).
a) Wybierz z podanego poniżej zestawu wodnych roztworów substancji jeden odczynnik potrzebny do przeprowadzenia doświadczenia i napisz jego wzór.
NaBr; AgNO3; Na3PO4
Wzór wybranego odczynnika: ………………………………………………………………………………………..
b) Napisz, co zaobserwowano w każdej z probówek po dodaniu wybranego
Probówka z roztworem BaCl2: …………………………………..
Probówka z roztworem KCl: …………………………………..
a) Na3PO4
b)
Probówka z roztworem BaCl2:
- Wytrącił się (biały) osad.
Probówka z roztworem KCl:
- Brak objawów reakcji.
- Nie obserwujemy zmian.
- Nic się nie dzieje.
- Nie wytrącił się osad.
Zadanie 56. (SP10)
Przeprowadzono trzy doświadczenia, których przebieg zilustrowano na poniższych schematach. W jednej z probówek zaobserwowano wydzielanie gazu, a w innej wytrącenie osadu.
a) Podaj numer probówki, w której wydzielił się gaz, oraz numer probówki, w której wytrącił się osad.
Numer probówki, w której wydzielił się gaz: ………………………………..
Numer probówki, w której wytrącił się osad: ………………………………..
b) Napisz w formie jonowej skróconej równania reakcji przebiegających w probówkach oznaczonych numerami I i III.
Równanie reakcji w probówce I: …………………………………
Równanie reakcji w probówce II: ………………………………..
a)
Numer probówki, w której wydzielił się gaz: II
Numer probówki, w której wytrącił się osad: III
b)
Równanie reakcji w probówce I: H + + OH– → H2O
Równanie reakcji w probówce III: 2Ag + + S2– → Ag2S (↓)
Zadanie 57. (SP10)
Po delikatnym ogrzaniu węgiel reaguje ze stężonym roztworem kwasu azotowego(V) zgodnie ze schematem: C + HNO3 (stęż.) → CO2↑ + NO2↑ + H2O
a) Dobierz i uzupełnij współczynniki stechiometryczne w podanym wyżej schemacie reakcji, stosując metodę bilansu
Równanie reakcji: …… C + …… HNO3 (stęż.) → …… CO2↑ + …… NO2↑ + …… H2O
b) Podaj stosunek molowy utleniacza do reduktora.
Stosunek molowy utleniacza do reduktora: ……………………. : ……………………….
a)
b) Stosunek molowy utleniacza do reduktora: 4:1
Zadanie 58. (SP11)
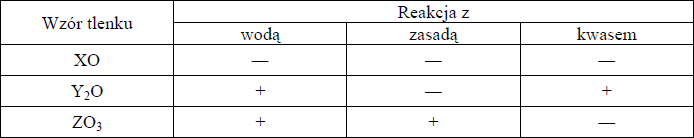
Atomy trzech różnych pierwiastków: X, Y i Z mają w stanie podstawowym następujące konfiguracje elektronów walencyjnych:
Pierwiastek X: 2s2 2p2, (L4 )
Pierwiastek Y: 3s1, (M1 )
Pierwiastek Z: 3s2 3p4, (M6 )
a) Napisz symbole chemiczne lub nazwy pierwiastków X, Y i Z.
X: ……………………………..
Y: ……………………………..
Z: ……………………………..
b) Zbadano trzy tlenki pierwiastków X, Y i Z. Informacje o ich właściwościach zestawiono w tabeli.
Uwaga: Znak „+” oznacza, że tlenek reaguje z daną substancją; znak „−” oznacza, że tlenek nie reaguje z daną substancją.
Korzystając z powyższej informacji, określ charakter chemiczny tlenków.
Charakter chemiczny tlenku XO: …………………………………………………………………………………….
Charakter chemiczny tlenku Y2O: …………………………………………………………………………………..
Charakter chemiczny tlenku ZO3: ………………………………………………………………………………
c) Przeprowadzono doświadczenie, do którego użyto tlenków opisanych w powyższym zadaniu, i jego przebieg zilustrowano rysunkiem. W każdej probówce umieszczono uniwersalny papierek wskaźnikowy.
Określ barwę uniwersalnego papierka wskaźnikowego w każdej probówce.
Probówka I: ………………………………………………………………………………………………………………….
Probówka II: …………………………………………………………………………………………………………………
Probówka III: ……………………………………………………………………………………………………………….
a) X: C lub węgiel Y: Na lub sód Z: S lub siarka
b)
Charakter chemiczny tlenku XO: obojętny
Charakter chemiczny tlenku Y2O: zasadowy
Charakter chemiczny tlenku ZO3: kwasowy
c)
Probówka I: żółta
Probówka II: niebieska lub niebieskozielona lub zielona
Probówka III: czerwona
Zadanie 59. (SP11)
Uzupełnij zdania, wpisując określenia wybrane z poniższego zestawu: zmniejszy się, zwiększy się, nie ulegnie zmianie.
Po emisji cząstki − β liczba masowa jądra ……………………………………………….., natomiast ładunek ……………………………………………….. o jeden ładunek elementarny. W wyniku emisji cząstki α liczba masowa jądra ……………………………………………….. o cztery jednostki, a jego ładunek ……………………………………………….. o dwa ładunki elementarne.
Po emisji cząstki − β liczba masowa jądra nie ulegnie zmianie, natomiast ładunek zwiększy się o jeden ładunek elementarny. W wyniku emisji cząstki α liczba masowa jądra zmniejszy się o cztery jednostki, a jego ładunek zmniejszy się o dwa ładunki elementarne.
Zadanie 60. (SP11)
Oceń prawdziwość poniższych zdań i uzupełnij tabelę. Wpisz literę P, jeżeli uznasz zdanie za prawdziwe, lub literę F, jeżeli uznasz je za fałszywe.
- F
- P
- F
Zadanie 61. (SP11)
Przeprowadzono doświadczenie zilustrowane poniższym rysunkiem. Zaobserwowano, że metal stapia się, tworząc kulkę, i pływa po powierzchni wody. Wskutek reakcji objętość kulki zmniejszała się.
a) Zapisz w formie jonowej równanie reakcji przebiegającej podczas tego doświadczenia.
b) Napisz, co zaobserwowano podczas doświadczenia. Wpisz do tabeli barwę roztworu przed reakcją i po reakcji. Barwa roztworu przed reakcją Barwa roztworu po reakcji
c) Korzystając z informacji wprowadzającej, określ, czy reakcja jest egzoenergetyczna, czy endoenergetyczna.
d) Uzupełnij poniższe zdanie. W każdym nawiasie wybierz i podkreśl właściwe słowo.
Po wrzuceniu do wody małego kawałka sodu przebiega gwałtowna reakcja. Zachowanie sodu, który przybiera kształt kulisty i pływa na powierzchni wody, wskazuje na jego (niską / wysoką) temperaturę topnienia oraz gęstość (mniejszą / większą) od gęstości wody.
a) 2Na + 2H2O → 2Na+ + 2OH − + H2(↑)
b)Brarwa roztworu przed reakcją – brak barwy lub bezbarwna
Barwa roztworu po reakcji – malinowa lub różowa lub różowofioletowa
c)Odczyn zasadowy
d) egzoenergetyczna lub egzo
e) Po wrzuceniu do wody małego kawałka sodu przebiega gwałtowna reakcja. Zachowanie sodu, który przybiera kształt kulisty i pływa na powierzchni wody, wskazuje na jego ( niską / wysoką ) temperaturę topnienia oraz gęstość ( mniejszą / większą ) od gęstości wody.
Zadanie 62. (SP11)
Siarkowodór (H2S) można otrzymać w laboratorium w wyniku działania kwasu solnego na siarczek żelaza(II). Oprócz siarkowodoru produktem tej reakcji jest chlorek żelaza(II). Siarkowodór spala się w powietrzu słabym płomieniem, dając w przypadku dostatecznego dopływu tlenu tlenek siarki(IV) i parę wodną. Przy ograniczonym dopływie tlenu wydziela się siarka i para wodna. Korzystając z powyższej informacji, napisz w formie cząsteczkowej:
a) równanie reakcji otrzymywania siarkowodoru w
b) równanie reakcji spalania siarkowodoru przy ograniczonym dostępie tlenu i podaj stopień utlenienia siarki przed reakcją oraz stopień utlenienia siarki po zakończeniu
Równanie reakcji:
Stopień utlenienia siarki przed reakcją: ……………………………………………………………………………
Stopień utlenienia siarki po reakcji: …………………………………………………………………………………
a) FeS + 2HCl → H2S + FeCl2
b) Równanie reakcji: 2H2S + O2 → 2S + 2H2O
Stopień utlenienia siarki przed reakcją: –II
Stopień utlenienia siarki po reakcji: 0
Zadanie 63. (SP11)
Spośród soli o wzorach: K2CO3, MgSO3, Na2SO4, Ca(NO2)2, AlCl3 wybierz tę, której aniony mają właściwości redukujące, a kationy mają konfigurację elektronową argonu. Napisz jej wzór.
Ca(NO2)2
Zadanie 64. (SP11)
W trzech probówkach oznaczonych numerami I, II i III znajdują się oddzielnie wodne roztwory następujących substancji: NaCl, MgCl2, CuCl2. Przeprowadzono doświadczenie, podczas którego do każdej probówki dodano wodny roztwór NaOH, i w tabeli zanotowano obserwacje
a) Napisz wzór chemiczny substancji, której roztwór znajdował się w probówce III przed dodaniem wodnego roztworu NaOH.
b) Napisz w formie jonowej skróconej równanie reakcji zachodzącej w probówce
c) Wyjaśnij, dlaczego odparowanie nie jest odpowiednią metodą, którą można zastosować do oddzielenia powstałego w probówce II osadu od pozostałych składników mieszaniny
a) NaCl
b) Mg2+ + 2OH − → Mg(OH)2 (↓)
c) Po odparowaniu pozostałaby mieszanina substancji. Odparowanie nie jest odpowiednią metodą, którą można zastosować do rozdzielenia powstałego w probówce II osadu od roztworu, gdyż wodorotlenek miedzi(II) rozkłada się pod wpływem wysokiej temperatury i powstaje czarny tlenek miedzi(II).
Zadanie 65. (SP11)
Pewna substancja organiczna składająca się z węgla, wodoru i tlenu jest bezbarwną cieczą o dużej lepkości, mieszającą się z wodą w każdym stosunku i nieulegającą dysocjacji. Jest silną trucizną. Reaguje z zawiesiną wodorotlenku miedzi(II), powodując rozpuszczanie się osadu i powstanie roztworu o barwie szafirowej. W cząsteczce tego związku organicznego stosunek liczby atomów węgla, wodoru i tlenu wynosi 1 : 3 : 1.
Napisz wzór półstrukturalny (grupowy) opisanego związku.
HO‒CH2‒CH2‒OH lub CH2(OH)‒CH2(OH)
Zadanie 65. (SP12)
Właściwości chlorowodoru wynikają z charakteru wiązania chemicznego występującego w jego cząsteczce.
a) Określ charakter wiązania (kowalencyjne niespolaryzowane, kowalencyjne spolaryzowane, jonowe) w cząsteczce chlorowodoru.
Charakter wiązania: ………………………………………………………………………………………………………
b) Uzupełnij poniższą charakterystykę chlorowodoru, podkreślając jedną z podanych w każdym nawiasie właściwości.
W temperaturze pokojowej i pod ciśnieniem atmosferycznym jest (gazem / cieczą / ciałem stałym). (dobrze / słabo) rozpuszcza się w rozpuszczalnikach polarnych, np. w wodzie.
a) Charakter wiązania: kowalencyjne spolaryzowane
b)
- W temperaturze pokojowej i pod ciśnieniem atmosferycznym jest ( gazem / cieczą / ciałem stałym).
- ( Dobrze / słabo ) rozpuszcza się w rozpuszczalnikach polarnych, np. w wodzie.
Zadanie 66. (SP12)
Poniżej przedstawiono struktury elektronowe dwóch cząsteczek: X2 i Z2.
a) Uzupełnij poniższe zdanie, podkreślając jeden wzór podany w każdym
Wzór I ilustruje elektronową strukturę cząsteczki (Br2 / H2 / N2), a wzór II strukturę cząsteczki (Br2 / H2 / N2).
b) Na podstawie struktury elektronowej cząsteczki X2 określ liczbę elektronów walencyjnych w atomie pierwiastka X.
Liczba elektronów walencyjnych: ……………….
c) Określ charakter wiązań (kowalencyjne niespolaryzowane, kowalencyjne spolaryzowane, jonowe) występujących w cząsteczkach, których budowę przedstawiają oba
Charakter wiązań: ………………………………………………………………………………………………………..
d) Określ krotność wiązania w cząsteczce X2.
Krotność wiązania: ……………………………………
a) Wzór I ilustruje elektronową strukturę cząsteczki ( Br2 / H2 / N2 ), a wzór II strukturę cząsteczki ( Br2 / H2 / N2 ).
b) Liczba elektronów walencyjnych: 5
c) Charakter wiązań: kowalencyjne (niespolaryzowane)
d) Krotność wiązania: 3 lub 1 σ i 2 π
Zadanie 67. (SP12)
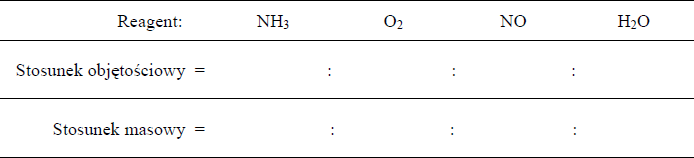
Katalityczne utlenianie amoniaku przebiega zgodnie z równaniem
a) Określ stosunek objętościowy i masowy substratów i produktów tej reakcji, jeżeli przebiega ona w warunkach, w których wszystkie reagenty są
b) Ustal liczbę moli tlenu cząsteczkowego potrzebną do powstania 20 moli tlenku azotu(II).
Liczba moli tlenu: ……………………..
a)
b) Liczba moli tlenu: 25 (moli)
Zadanie 68. (SP12)
Do wody destylowanej wprowadzono chlorek baru i chlorek miedzi(II), otrzymując roztwór.
a) Korzystając z tablicy rozpuszczalności, wybierz spośród wymienionych poniżej odczynnik, którego dodanie do otrzymanego roztworu spowoduje usunięcie jonów miedzi(II) przez wytrącenie trudno rozpuszczalnego związku, a nie spowoduje usunięcia jonów baru. Uzasadnij odpowiedź, pisząc w formie jonowej skróconej równanie reakcji, która zajdzie po dodaniu do roztworu wybranego odczynnika.
Wybrany odczynnik (podkreśl): Na2SO4 (aq); NaNO3 (aq); (NH4)3PO4 (aq); (NH4)2S (aq) .
Równanie reakcji
b) Podaj nazwę metody, którą należy zastosować, aby otrzymany osad oddzielić od
a)
Wybrany odczynnik: (NH4)2S(aq)
Równanie reakcji: Cu2+ + S2-→ CuS↓
b) sączenie lub filtracja lub (sedymentacja i) dekantacja
Zadanie 69. (SP12)
Uzupełnij poniższe zdania, podkreślając jedno określenie z trzech podanych w każdym nawiasie. Roztwór o odczynie obojętnym ma pH (mniejsze od / równe / większe od) 7, a roztwór o odczynie zasadowym ma pH (mniejsze od / równe / większe od) 7.
Roztwór o odczynie obojętnym ma pH ( mniejsze od / równe / większe od ) 7, a roztwór o odczynie zasadowym ma pH ( mniejsze od / równe / większe od ) 7.
Zadanie 70. (SP12)
Tlenek srebra(I) w zetknięciu z roztworem nadtlenku wodoru reaguje zgodnie ze schematem:
Ag2O + H2O2 → Ag + O2 + H2O
a) Dobierz i uzupełnij współczynniki stechiometryczne w podanym wyżej schemacie reakcji, stosując metodę bilansu elektronowego.
Bilans elektronowy:
Równanie reakcji: ………. Ag2O + ………. H2O2 → ………. Ag + ………. O2 + ………. H2O
b) Określ funkcję, jaką w tej reakcji pełni nadtlenek wodoru.
Nadtlenek wodoru pełni w tej reakcji funkcję …………………………………………………………………..
a)
b) Nadtlenek wodoru pełni w tej reakcji funkcję reduktora
Zadanie 71. (SP12)
Dysproporcjonowanie to reakcja utleniania i redukcji, w której część atomów tego samego pierwiastka na pośrednim stopniu utlenienia ulega redukcji, działając jako utleniacz, a część utlenia się, będąc reduktorem. Na podstawie: K.-H. Lautenschläger, W. Schröter, A. Wanninger, Nowoczesne kompendium chemii, Warszawa 2007.
Spośród podanych niżej równań reakcji utleniania i redukcji wybierz to, które jest równaniem procesu dysproporcjonowania. Wybrane równanie podkreśl.
C. 2NO2 + H2O → HNO3 + HNO2
Zadanie 72. (SP12)
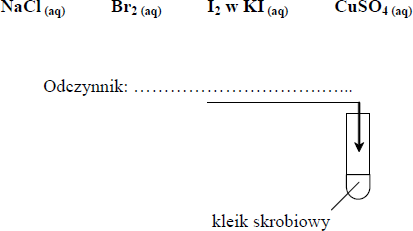
a) Spośród odczynników o podanych niżej wzorach wybierz ten, który należy dodać do probówki z kleikiem skrobiowym, aby potwierdzić obecność skrobi. Uzupełnij schemat doświadczenia, wpisując wzór wybranego
b) Opisz zmianę, jaką zaobserwuje się po wprowadzeniu do probówki wybranego
a)
b) Zawartość probówki zabarwiła się na granatowo lub (ciemno) niebiesko.
Zadanie 73. (SP13)
Podkreśl zestaw, w którym podane są wzory dwóch gazów palnych.
- CH4, CO2
- O2, H2
- CH4, H2
- CO2, O2
Odp. 3.
Zadanie 74. (SP13)
Tlenek wapnia jest substancją higroskopijną. Łatwo łączy się z wodą, dzięki czemu może być stosowany do osuszania gazów.
Spośród gazów, których wzory podano w informacji wprowadzającej, wybierz i napisz wzór tego, którego nie powinno osuszać się przy użyciu tlenku wapnia. Uzasadnij swój wybór.
Wzór: CO2
Ponieważ tlenek węgla(IV) reaguje z tlenkiem wapnia.
CaO + CO2 → CaCO3
Zadanie 75. (SP13)
Wapno gaszone, składnik zaprawy wapiennej, powstaje w reakcji wapna palonego CaO z wodą. Zaprawa wapienna twardnieje dzięki reakcji wapna gaszonego z tlenkiem węgla(IV) zawartym w powietrzu.
Korzystając z powyższej informacji, napisz w formie cząsteczkowej równania reakcji:
a) Otrzymywania wapna
b) Twardnienia zaprawy
a) CaO + H2O → Ca(OH)2
b) Ca(OH)2 + CO2 → CaCO3 + H2O
Zadanie 76. (SP13)
Wapno gaszone, składnik zaprawy wapiennej, powstaje w reakcji wapna palonego CaO z wodą. Zaprawa wapienna twardnieje dzięki reakcji wapna gaszonego z tlenkiem węgla(IV) zawartym w powietrzu.
Uzupełnij poniższe zdanie. Wybierz i podkreśl właściwe określenie spośród podanych w nawiasie.
Reakcja otrzymywania wapna gaszonego jest przemianą egzotermiczną, co oznacza, że podczas tej przemiany energia w postaci ciepła jest (pochłaniana / wydzielana).
Reakcja otrzymywania wapna gaszonego jest przemianą egzotermiczną, co oznacza, że podczas tej przemiany energia w postaci ciepła jest ( pochłaniana / wydzielana ).
Zadanie 77. (SP13)
Przeprowadzono doświadczenie, którego celem było otrzymanie dwóch gazów. Przygotowano dwie probówki I i II. Jednym z substratów reakcji, która zaszła w probówce I, był węglan sodu, natomiast jednym z substratów reakcji, która zaszła w probówce II, była woda. Gaz otrzymany w probówce I jest związkiem nieorganicznym, który powoduje mętnienie wody wapiennej. Natomiast gaz otrzymany w probówce II jest związkiem organicznym, który powoduje odbarwienie wody bromowej.
Zaprojektuj doświadczenie opisane w powyższej informacji.
a) Uzupełnij schemat doświadczenia, wpisując w każde puste pole wzór substancji wybranej z podanej listy:
b) Napisz w formie cząsteczkowej równanie reakcji zachodzącej w probówce II, wiedząc, że w przemianie tej bierze udział dwa razy więcej moli wody niż drugiego
a)
b)
CaC2 + 2H2O → Ca(OH)2 + CH≡CH
CaC2 + 2H2O → Ca(OH)2 + C2H2
Zadanie 78. (SP13)
Przeprowadzono doświadczenie, którego celem było otrzymanie dwóch gazów. Przygotowano dwie probówki I i II. Jednym z substratów reakcji, która zaszła w probówce I, był węglan sodu, natomiast jednym z substratów reakcji, która zaszła w probówce II, była woda. Gaz otrzymany w probówce I jest związkiem nieorganicznym, który powoduje mętnienie wody wapiennej. Natomiast gaz otrzymany w probówce II jest związkiem organicznym, który powoduje odbarwienie wody bromowej.
Po zakończeniu reakcji i zebraniu wydzielonego gazu, do mieszaniny poreakcyjnej z probówki II dodano kilka kropli fenoloftaleiny.
Napisz, jaką barwę przyjmie wskaźnik oraz określ odczyn powstałego roztworu.
Barwa wskaźnika: malinowa lub różowa
Odczyn powstałego roztworu: zasadowy
Zadanie 79. (SP13)
Przeprowadzono doświadczenie, którego celem było otrzymanie dwóch gazów. Przygotowano dwie probówki I i II. Jednym z substratów reakcji, która zaszła w probówce I, był węglan sodu, natomiast jednym z substratów reakcji, która zaszła w probówce II, była woda. Gaz otrzymany w probówce I jest związkiem nieorganicznym, który powoduje mętnienie wody wapiennej. Natomiast gaz otrzymany w probówce II jest związkiem organicznym, który powoduje odbarwienie wody bromowej.
Gaz powstający w probówce II łatwo reaguje z bromem. Napisz, stosując wzory półstrukturalne (grupowe) związków organicznych, równanie tej reakcji. Załóż, że jej produktem jest związek nasycony.
CH≡CH + 2Br2 → CHBr2─CHBr2
Zadanie 80. (SP13)
Stężony kwas azotowy(V) reaguje z niektórymi niemetalami. Jego reakcja z fosforem przebiega zgodnie z poniższym schematem:
a) Uzupełnij schemat, wpisując stopnie utlenienia fosforu i
b) W odpowiednie pola wpisz liczbę elektronów pobranych (poprzedzoną znakiem „+”) oraz liczbę elektronów oddanych (poprzedzoną znakiem „−”)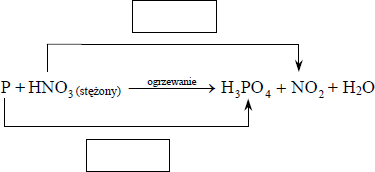
c) Uzupełnij współczynniki stechiometryczne w podanym schemacie
d) Korzystając z informacji wprowadzającej, oceń prawdziwość poniższych zdań. Wpisz literę P, jeżeli zdanie jest prawdziwe, lub literę F, jeśli jest fałszywe.
a)
b)
c)
Zadanie 81. (SP13)
W celu przeprowadzenia doświadczenia przygotowano wodne roztwory substancji o wzorach: HNO3, H2SO4, KOH, NaOH. Stężenia molowe wszystkich roztworów były jednakowe i wynosiły 0,1 3 mol dm.
Przebieg doświadczenia zilustrowano na poniższym rysunku, na którym zaznaczono ilości użytych roztworów. Po wykonaniu doświadczenia w rozworach otrzymanych w probówkach I i II zanurzono żółty uniwersalny papierek wskaźnikowy.
Określ barwę uniwersalnego papierka wskaźnikowego w tych roztworach.
Probówka I: …………………………………..
Probówka II: ………………………………….
Probówka I: żółta
Probówka II: czerwona
Zadanie 82. (SP13)
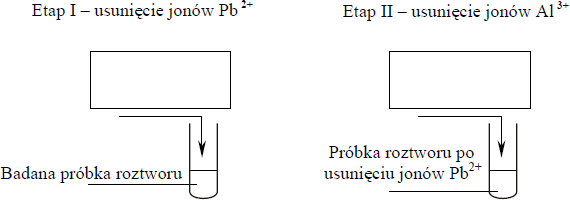
Pewien roztwór zawiera kationy: Al 3+ , Pb 2+ i Mg 2+ oraz aniony NO – 3 . Korzystając z tabeli rozpuszczalności, zaprojektuj dwuetapowe doświadczenie umożliwiające usunięcie z badanej próbki jonów Al 3+ i Pb2+ oraz pozostawienie jonów Mg 2+ .
a)Wybierz z podanego poniżej zestawu wodnych roztworów substancji dwa odczynniki potrzebne do przeprowadzenia doświadczenia i uzupełnij poniższe schematy, wpisując w odpowiednie miejsca wzory użytych odczynników.
W pierwszym etapie doświadczenia należy usunąć wybranym odczynnikiem tylko jony Pb2+. W drugim etapie doświadczenia należy usunąć jony Al 3+.
(NH4)3PO4; Na2CrO4; KI
b) Napisz w formie jonowej skróconej równania reakcji, które zaszły podczas każdego z etapów doświadczenia.
Etap I: ……………………………………………………
Etap II: …………………………………………………..
a)
b)
Zadanie 83. (SP14)
Podczas prażenia mieszaniny tlenku ołowiu(II) i siarczku ołowiu(II) bez dostępu powietrza zachodzi reakcja zgodnie ze schematem:
PbO + PbS ĺ Pb + SO2
a) Uzgodnij współczynniki w równaniu reakcji chemicznej zachodzącej podczas prażenia mieszaniny PbO i PbS bez dostępu powietrza. Zastosuj metodę bilansu elektronowego.
Bilans elektronowy:
Zbilansowane równanie reakcji: …..…. PbO + …..…. PbS ĺ …..…. Pb + …..…. SO2
b) Określ funkcję, jaką w tej reakcji pełni siarka w siarczku ołowiu(II).
Siarka w siarczku ołowiu(II) pełni funkcję……
a)
b) Siarka w siarczku ołowiu(II) pełni funkcję reduktora.
Zadanie 84. (SP14)
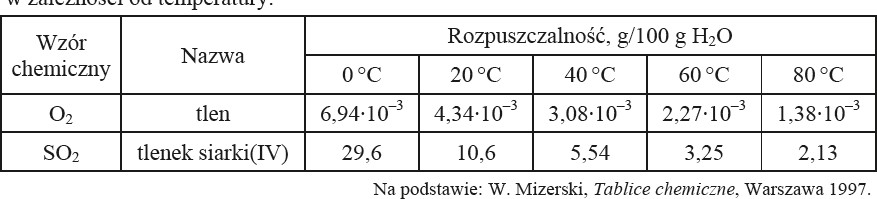
Poniższa tabela zawiera dane dotyczące rozpuszczalności dwóch gazów w wodzie, w zależności od temperatury.
a) Uzupełnij poniższe zdania. Wybierz i podkreśl jedno określenie spośród podanych w nawiasach.
Rozpuszczalność tlenu i tlenku siarki(IV) (maleje / rośnie / nie zmienia się) w miarę obniżania temperatury.
Tlen (jest dobrze / jest słabo / nie jest) rozpuszczalny w wodzie.
b) Określ odczyn wodnych roztworów tlenu i tlenku siarki(IV).
Odczyn wodnego roztworu tlenu: ………………………………………………………………………………
Odczyn wodnego roztworu tlenku siarki(IV): ……………………………………………………………..
c) Napisz w formie cząsteczkowej równanie reakcji tlenku siarki(IV) z wodą.
d) Uzupełnij poniższe zdanie. Wybierz i podkreśl jedno określenie spośród podanych w każdym nawiasie.
Gazem, który słabiej rozpuszcza się w wodzie, jest (tlenek siarki(IV) / tlen), ponieważ (ma mniejszą gęstość / jego cząsteczki są polarne / nie reaguje z wodą).
a) 1. Rozpuszczalność tlenu i tlenku siarki(IV) (maleje / rośnie / nie zmienia się) w miarę obniżania temperatury.
2. Tlen (jest dobrze / jest słabo / nie jest) rozpuszczalny w wodzie.
b)
- Odczyn wodnego roztworu tlenu: obojętny
- Odczyn wodnego roztworu tlenku siarki(IV): kwasowy
c)
SO2 + H2O → H2SO3
d) Gazem, który słabiej rozpuszcza się w wodzie, jest (tlenek siarki(IV) / tlen), ponieważ (ma mniejszą gęstość / jego cząsteczki są polarne / nie reaguje z wodą).
Zadanie 85. (SP14)
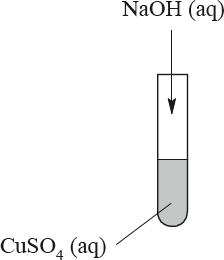
Do wodnego roztworu siarczanu(VI) miedzi(II) o barwie niebieskiej dodano bezbarwny wodny roztwór wodorotlenku sodu.
a) Opisz zmianę, jaką zaobserwowano po zmieszaniu roztworów. Uwzględnij stan skupienia i barwę powstałego związku miedzi(II).
b) Napisz w formie jonowej skróconej równanie reakcji, która zaszła po zmieszaniu roztworów.
a) Wytrącił się niebieski (galaretowaty) osad.
b)
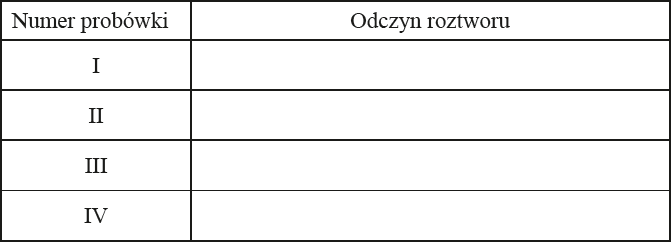
Zadanie 86. (SP14)
W czterech probówkach oznaczonych numerami I–IV znajdują się roztwory wodne otrzymane w sposób przedstawiony na rysunku.
a) Określ odczyn roztworów wodnych otrzymanych w probówkach oznaczonych numerami I–IV.
c) Podaj wzór sumaryczny i nazwę soli otrzymanej w wyniku zmieszania roztworów otrzymanych w probówkach I oraz II i po odparowaniu wody.
a) I. kwasowy
II. zasadowy
III. zasadowy
IV. kwasowy
b)
H+ + OH– → H2O
lub H3O+ + OH– → 2H2O
lub Ca(OH)2 + 2H+ → Ca2+ + 2H2O
lub Ca(OH)2 + 2H3O+ → Ca2+ + 4H2O
c)
Wzór sumaryczny: NH4Cl
Nazwa: chlorek amonu
Zadanie 87. (SP15)
Wykonano eksperyment, którego przebieg zilustrowano na rysunku.
a) Napisz w formie jonowej skróconej równanie reakcji zachodzącej w kolbie.
b) Opisz sposób identyfikacji gazu, który wydzielał się w czasie tej reakcji.
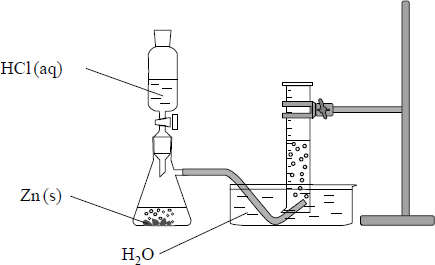
c) Wybierz i podkreśl w każdym nawiasie poprawne uzupełnienie poniższych zdań.
Sól, której roztwór otrzymano w kolbie po całkowitym roztworzeniu cynku w kwasie, jest związkiem (jonowym / niejonowym). Aby go wyodrębnić z mieszaniny poreakcyjnej, należy (z roztworu odparować wodę / roztwór przesączyć). W temperaturze pokojowej i pod ciśnieniem atmosferycznym związek ten jest (ciałem stałym / cieczą).
d) Szybkość reakcji zachodzącej w czasie opisanego doświadczenia jest niewielka. Wymień dwa sposoby zmiany warunków wykonania doświadczenia, w których wyniku szybkość zachodzącej reakcji będzie większa.
a)
Zn + 2H+ → Zn2+ + H2
b)
- Należy spróbować zapalić gaz. Jeżeli po umieszczeniu u wylotu cylindra z gazem palącego się łuczywa nastąpi spalenie gazu z charakterystycznym odgłosem, oznacza to, że w cylindrze był wodór.
- Spalaniu gazu towarzyszy charakterystyczny dźwięk.
c)
Sól, której roztwór otrzymano w kolbie po całkowitym roztworzeniu cynku w kwasie, jest
związkiem (jonowym / niejonowym). Aby go wyodrębnić z mieszaniny poreakcyjnej,
należy (z roztworu odparować wodę / roztwór przesączyć). W temperaturze pokojowej
i pod ciśnieniem atmosferycznym związek ten jest (ciałem stałym / cieczą).
d)
- ogrzanie kolby z mieszaniną reakcyjną
- użycie roztworu kwasu o większym stężeniu
- mieszanie
- rozdrobnienie cynku
- dodanie katalizatora
Zadanie 88. (SP15)
Jodyna to roztwór jodu I2 w etanolu. Aby zwiększyć jego trwałość, dodaje się do niego niewielką ilość jodku potasu KI. Jodyna jest brunatną cieczą, a stały jodek potasu tworzy bezbarwne kryształy, przypominające wyglądem sól kuchenną.
Na szalkę wlano kilkanaście kropli jodyny i pozostawiono pod wyciągiem. Po upływie godziny stwierdzono, że w naczyniu pozostał ciemnobrunatny osad. Po upływie kolejnej godziny na szalce zauważono jedynie niewielką ilość białego nalotu. Przemiany ilustruje schemat.
jodyna przemiana I → ciemnobrunatny osad przemiana II → biały nalot
Wybierz i podkreśl w każdym nawiasie poprawne uzupełnienie poniższych zdań.
a) Ciemnobrunatny osad to (jod / jodek potasu / stałe składniki jodyny).
b) Biały nalot to (jod / jodek potasu / stałe składniki jodyny).
c) Przemiana I, polegająca na (parowaniu etanolu / sublimacji jodu / resublimacji jodu), jest (zjawiskiem fizycznym / reakcją chemiczną).
d) Przemiana II, polegająca na (parowaniu etanolu / sublimacji jodu / resublimacji jodu), jest (zjawiskiem fizycznym / reakcją chemiczną).
a) Ciemnobrunatny osad to (jod / jodek potasu / stałe składniki jodyny).
b) Biały nalot to (jod / jodek potasu / stałe składniki jodyny).
c) Przemiana I, polegająca na (parowaniu etanolu / sublimacji jodu / resublimacji jodu), jest (zjawiskiem fizycznym / reakcją chemiczną).
d) Przemiana II, polegająca na (parowaniu etanolu / sublimacji jodu / resublimacji jodu), jest (zjawiskiem fizycznym / reakcją chemiczną).
W zadaniu a) należy uznać za poprawną odpowiedź:
a) Ciemnobrunatny osad to (jod / jodek potasu / stałe składniki jodyny).
Zadanie 89. (SP15)
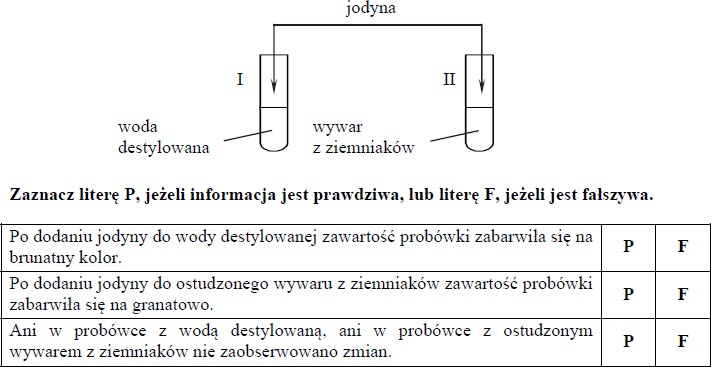
Jodyna to roztwór jodu I2 w etanolu. Aby zwiększyć jego trwałość, dodaje się do niego niewielką ilość jodku potasu KI. Jodyna jest brunatną cieczą, a stały jodek potasu tworzy bezbarwne kryształy, przypominające wyglądem sól kuchenną.
Do dwóch probówek zawierających oddzielnie wodę destylowaną i ostudzony wywar z ziemniaków dodano niewielką ilość jodyny, a następnie wymieszano zawartość każdej probówki.
- P
- P
- F
Zadanie 90. (SP15)
Spośród związków chemicznych, których wzory przedstawiono poniżej, wybierz te, które dysocjują na jony pod wpływem wody.
Podkreśl wzory wybranych związków.
KOH; Al2O3; K2SO4; CH3CH2OH; HNO3
KOH, K2SO4, HNO3
Zadanie 91. (SP15)
Napisz w formie jonowej skróconej równanie reakcji tlenku glinu z mocnym kwasem
Al2O3 +6H+ → 2Al3+ + 3H2O
Zadanie 92. (SP15)
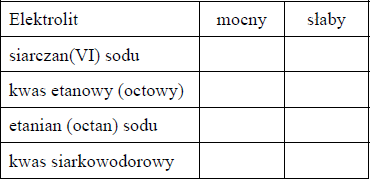
Określ, jakimi elektrolitami (mocnymi czy słabymi) są związki, których nazwy wymieniono w tabeli. Wpisz znak x w odpowiednie rubryki.
mocne: siarczan(VI) sodu, etanian (octan) sodu,
słabe: kwas etanowy (octowy), kwas siarkowodorowy.
Zadanie 93. (SP15)
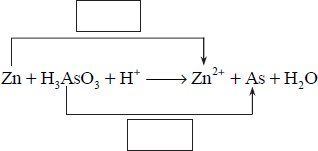
Związek o wzorze H3AsO3 w środowisku o odczynie kwasowym reaguje z cynkiem zgodnie z następującym schematem:
a) Uzupełnij schemat − wpisz stopnie utlenienia cynku i arsenu.
b) W odpowiednie pola wpisz liczbę elektronów pobranych (poprzedzoną znakiem „+”) oraz liczbę elektronów oddanych (poprzedzoną znakiem „−”).
c) Uzupełnij współczynniki stechiometryczne w podanym schemacie reakcji.
d) Wybierz i podkreśl w każdym nawiasie poprawne uzupełnienie poniższych zdań.
W opisanej reakcji związek o wzorze H3AsO3 pełni funkcję (reduktora / utleniacza), gdyż ulega (redukcji / utlenieniu). W czasie reakcji stopień utlenienia wodoru (nie ulega zmianie / się zmniejsza / się zwiększa).
W trakcie opisanej reakcji pH roztworu, w którym ona zachodzi, (nie ulega zmianie / maleje / wzrasta).
a)
b)
c)
d)
- W opisanej reakcji związek o wzorze H3AsO3 pełni funkcję (reduktora / utleniacza), gdyż ulega (redukcji / utlenieniu). W czasie reakcji stopień utlenienia wodoru (nie ulega zmianie / się zmniejsza / się zwiększa).
2. W trakcie opisanej reakcji pH roztworu, w którym ona zachodzi, (nie ulega zmianie / maleje / wzrasta).
Zadanie 94. (SP16)
Przeprowadzono doświadczenie zilustrowane poniższym schematem. Objawy reakcji zaobserwowano we wszystkich probówkach.
a) Podaj numer probówki, w której wydzielił się gaz, oraz numer probówki, w której wytrącił się niebieski, galaretowaty osad.
Numer probówki, w której wydzielił się gaz: ……………………………………………………………………
Numer probówki, w której wytrącił się niebieski osad: ………………………………………………………
b) Napisz w formie jonowej skróconej równanie reakcji przebiegającej w probówce I.
a)
Numer probówki, w której wydzielił się gaz: III
Numer probówki, w której wydzielił się niebieski osad: I
b) Cu 2+ + 2OH − → Cu(OH)2
Zadanie 95. (SP16)
W przemyśle wapno gaszone otrzymuje się w dwuetapowym procesie. Najpierw węglan wapnia poddaje się rozkładowi w temperaturze 1000 o C. W wyniku tego procesu otrzymuje się tlenek zwany wapnem palonym, który w procesie gaszenia przekształca się w wapno gaszone.
Uzupełnij poniższy schemat otrzymywania wapna gaszonego z węglanu wapnia. W puste (większe) pola wpisz wzory związków chemicznych.
W pole umieszczone nad strzałką oznaczoną numerem 1 wpisz warunki konieczne do przeprowadzenia przemiany, a w pole nad strzałką oznaczoną numerem 2 wpisz wzór drugiego substratu przemiany.
Zadanie 96. (SP16)
Energia aktywacji określa wielkość bariery energetycznej, którą muszą pokonać reagujące drobiny, aby doszło do reakcji chemicznej. Im mniejsza jest energia aktywacji dla danej reakcji, tym szybciej zachodzi przemiana. Dużą energię aktywacji reakcji można zmniejszyć, jeżeli wprowadzi się do układu katalizator. Nadtlenek wodoru ulega reakcji rozkładu według równania:
2H2O2 → 2H2O + O2
W temperaturze pokojowej szybkość rozkładu H2O2 jest mała. W poniższej tabeli podano wartości energii aktywacji reakcji rozkładu H2O2 bez udziału katalizatora oraz z udziałem różnych katalizatorów.
a) Oceń, którego katalizatora spośród wymienionych w informacji należy użyć, aby reakcja rozkładu nadtlenku wodoru w temperaturze T przebiegła z największą szybkością. Napisz nazwę tego katalizatora.
b) Przeprowadzono doświadczenie zilustrowane poniższym schematem.
Uzupełnij poniższe zdania. W każdym nawiasie wybierz i podkreśl właściwe określenie.
Podczas doświadczenia zaobserwowano wydzielanie (barwnego / bezbarwnego) gazu, który (dobrze / słabo) rozpuszcza się w wodzie. Po umieszczeniu w probówce z zebranym gazem tlącego się łuczywka zapala się ono jasnym płomieniem, co świadczy o tym, że otrzymany gaz (jest palny / podtrzymuje palenie).
a) peroksydaza
b)
Podczas doświadczenia zaobserwowano wydzielanie (barwnego / bezbarwnego) gazu, który (dobrze / słabo) rozpuszcza się w wodzie. Po umieszczeniu w probówce z zebranym gazem tlącego się łuczywka zapala się ono jasnym płomieniem, co świadczy o tym, że otrzymany gaz (jest palny / podtrzymuje palenie).
Zadanie 97. (SP16)
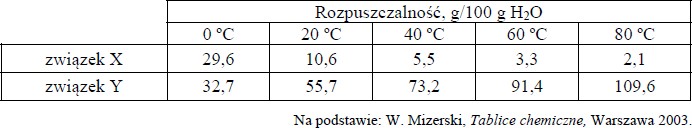
W poniższej tabeli przedstawiono wartości rozpuszczalności dwóch związków chemicznych X i Y w wodzie w różnych temperaturach. Wiadomo, że jeden ze związków jest gazem, a drugi – ciałem stałym.
Napisz, który związek jest gazem, i uzasadnij swój wybór.
Gazem jest związek oznaczony literą X.
Uzasadnienie: Rozpuszczalność gazów w wodzie maleje wraz ze wzrostem temperatury
Zadanie 98. (SP16)
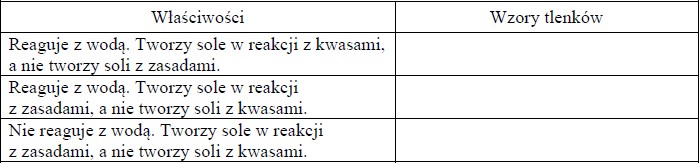
Uzupełnij tabelę – wpisz wzory wszystkich tlenków o podanych właściwościach. Tlenki wybierz spośród następujących:
CaO; K2O; NO; SiO2; SO2; SO3.
- CaO, K2O
- SO2, SO3
- SiO2
Zadanie 99. (SP16)
W poniższej tabeli zestawiono wartości pH różnych roztworów.
Spośród wymienionych powyżej wybierz roztwór o odczynie najsilniej kwasowym.
Sok cytryny
Zadanie 100. (SP16)
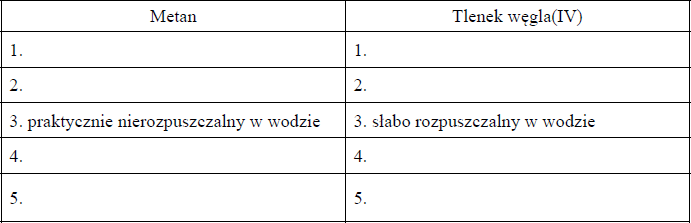
Scharakteryzuj metan i tlenek węgla(IV) w temperaturze pokojowej i pod ciśnieniem atmosferycznym. Wybierz ich właściwości spośród podanych poniżej i wpisz je (zgodnie z podanym przykładem) w odpowiednie kolumny tabeli.
- ciało stałe, ciecz, gaz
- bezbarwny, barwny
- słabo rozpuszczalny w wodzie, praktycznie nierozpuszczalny w wodzie
- palny, niepalny
- gęstość mniejsza od gęstości powietrza, gęstość większa od gęstości powietrza
Metan:
- gaz
- bezbarwny
- praktycznie nierozpuszczalny w wodzie
- palny
- gęstość mniejsza od gęstości powietrza
Tlenek węgla(IV):
- gaz
- bezbarwny
- słabo rozpuszczalny w wdzie
- niepalny
- gęstość większa od gęstości powietrza
Zadanie 101. (SP17)
Poniżej podano wzory sześciu substancji. Spośród substancji, których wzory przedstawiono poniżej, wybierz wszystkie substancje niejonowe i podkreśl ich wzory.
CH3OH, HBr, O2
Zadanie 102. (SP17)
Wybierz i podkreśl w każdym nawiasie poprawne uzupełnienie poniższych zdań.
I. Związek chemiczny (wykazuje / nie wykazuje) właściwości pierwiastków, z których powstał.
II. Składniki mieszaniny mogą być zmieszane (w dowolnym / tylko w ściśle określonym) stosunku masowym. Stosunek masowy pierwiastków wchodzących w skład danego związku chemicznego jest (dowolny / ściśle określony).
I. Związek chemiczny (wykazuje / nie wykazuje) właściwości pierwiastków, z których powstał.
II. Składniki mieszaniny mogą być zmieszane (w dowolnym / tylko w ściśle określonym) stosunku masowym. Stosunek masowy pierwiastków wchodzących w skład danego związku chemicznego jest (dowolny / ściśle określony).
Zadanie 103. (SP17)
Wykonano eksperyment, którego przebieg zilustrowano na rysunku.
a) Napisz, co w czasie doświadczenia zaobserwowano w kolbie ze stałym węglanem wapnia, do której wkraplano kwas solny, a co – w kolbie zawierającej wodę wapienną.
Kolba ze stałym węglanem wapnia:
Kolba z wodą wapienną:
b) Napisz w formie cząsteczkowej równanie reakcji zachodzącej po dodaniu kwasu solnego do stałego węglanu wapnia.
c) Poniżej wymieniono pięć metod otrzymywania soli:
1. reakcja metalu z niemetalem
2. reakcja metalu z kwasem
3. reakcja tlenku metalu z kwasem
4. reakcja tlenku metalu z tlenkiem kwasowym
5. reakcja wodorotlenku z kwasem Spośród wymienionych metod wybierz te, za pomocą których można otrzymać sole magnezu o wzorach MgCl2 i Mg3(PO4)2.
W tabeli wpisz numery, którymi oznaczono te metody.

a)
Kolba ze stałym węglanem wapnia: wydzielanie bezbarwnego gazu lub pienienie się zawartości kolby lub roztwarzanie się węglanu wapnia Kolba z wodą wapienną: mętnienie wody wapiennej
b)
CaCO3 + 2HCl → CaCl2 + H2O + CO2
c) MgCl2: 1, 2, 3, 5
Mg3(PO4)2 : 2, 3, 4, 5
Zadanie 104. (SP17)
Sole niektórych kwasów można otrzymać z soli innych kwasów.
a) Zaprojektuj doświadczenie (przeprowadzone pod wyciągiem) polegające na otrzymaniu wodnego roztworu siarczanu(VI) sodu w wyniku działania roztworem odpowiedniego kwasu na roztwór siarczku sodu. Uzupełnij schemat doświadczenia – podkreśl wzór wybranego kwasu.
b) Napisz, jakie obserwacje potwierdzą, że po zmieszaniu roztworów zaszła reakcja chemiczna.
c) Napisz w formie jonowej równanie reakcji, która zaszła podczas doświadczenia.
d) Sole trudno rozpuszczalne w wodzie można otrzymać w reakcji strąceniowej. Napisz w formie jonowej skróconej równanie reakcji strąceniowej, w której powstaje jodek ołowiu(II) o wzorze PbI2.
a)
H2SO4(aq)
b)
Wydziela się (bezbarwny) gaz (o charakterystycznym zapachu).
c)
2H+ + S2- → H2S lub 2H+ +SO42- +2Na+ + S2- → 2Na+ + SO42- + H2S
d)
Pb2+ + 2I– → PbI2
Zadanie 105. (SP17)
Poniżej opisano właściwości dwóch metali. Metal I: srebrzystobiały, kowalny, ciągliwy, daje się łatwo walcować. Metal lekki, bardzo dobry przewodnik elektryczności. Na powietrzu szybko matowieje. Z powodu pasywacji odporny na działanie czynników atmosferycznych i stężonego kwasu azotowego(V). Po usunięciu warstwy ochronnej reaguje energicznie z tlenem i wodą, wypierając z niej wodór. Roztwarza się w roztworach mocnych kwasów i zasad. Metal II: srebrzystobiały, ciągliwy, daje się walcować. Metal lekki, dobry przewodnik elektryczności. Na powietrzu szybko matowieje. Po ogrzaniu do temperatury powyżej 700 ºC zapala się oślepiająco białym płomieniem. W podwyższonej temperaturze reaguje z wodą, wypierając z niej wodór. Roztwarza się w roztworach kwasów, odporny na działanie alkaliów.
Na podstawie: J. Ciba, J., Trojanowska, M. Zołotajkin, Mała encyklopedia pierwiastków, Warszawa 1996 oraz A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Wybierz i podkreśl w każdym nawiasie poprawne uzupełnienie poniższego zdania.
Metalem I może być (glin / magnez / sód), a metalem II – (glin / magnez / sód).
Metalem I może być (glin / magnez / sód), a metalem II – (glin / magnez / sód).
Zadanie 106. (SP18)
Sód to aktywny metal, który w związkach chemicznych przyjmuje stopień utlenienia I. Spalany w powietrzu tworzy nadtlenek o wzorze Na2O2 (reakcja 1.). W reakcji nadtlenku sodu z tlenkiem węgla(IV) powstają węglan sodu oraz bezbarwny i bezwonny gaz podtrzymujący palenie (reakcja 2.).
a) Napisz, jakie stopnie utlenienia przyjmują sód i tlen w nadtlenku sodu (Na2O2).
Stopień utlenienia sodu: ……….……..……
Stopień utlenienia tlenu: ………….…….….
b) Napisz w formie cząsteczkowej równania dwóch opisanych Równanie reakcji 1.: ………….…….….
Równanie reakcji 2.: ………….…….….
a)
Stopień utlenienia sodu: I
Stopień utlenienia tlenu: −I
b)
Równanie reakcji 1.: 2Na + O2 → Na2O2
Równanie reakcji 2.: 2Na2O2 + 2CO2 → 2Na2CO3 + O2
Zadanie 107. (SP18)
Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.
- – P, 2. – P, 3. – F
Zadanie 108. (SP18)
Masa molowa pewnej soli jednego z metali 1. grupy układu okresowego pierwiastków jest równa 150 g mol . Sporządzono wodny roztwór tej soli i wykonano doświadczenie zgodnie z poniższym schematem. Po zakończeniu reakcji do otrzymanego roztworu dodano kleik skrobiowy i zaobserwowano pojawienie się granatowego zabarwienia.
Napisz w formie cząsteczkowej równanie reakcji zachodzącej w roztworze podczas przeprowadzonego doświadczenia.
2NaI + Cl2 → 2NaCl + I2
Zadanie 109. (SP18)
Siarczek magnezu (MgS) można otrzymać w bezpośredniej syntezie z pierwiastków (reakcja 1.). Siarczek wapnia (CaS) natomiast otrzymuje się przez redukcję siarczanu(VI) wapnia (CaSO4) węglem; drugim produktem tej przemiany jest tlenek węgla(II) (reakcja 2.).
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2013.
Napisz w formie cząsteczkowej równania dwóch opisanych przemian.
Równanie reakcji 1.: ……………………………………………………………………………………………………..
Równanie reakcji 2.: ……………………………………………………………………………………………………..
Równanie reakcji 1: Mg + S → MgS
Równanie reakcji 2: CaSO4 + 4C → CaS + 4CO
Zadanie 110. (SP18)
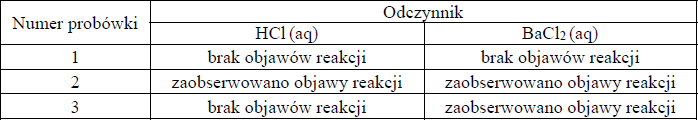
W probówkach 1–3 znajdują się (w nieznanej kolejności) bezbarwne wodne roztwory następujących substancji: chlorku sodu, siarczanu(VI) magnezu i węglanu sodu. Ponieważ probówki z roztworami nie były opisane, aby zidentyfikować ich zawartość, wybrano dwa odczynniki: wodny roztwór HCl i wodny roztwór BaCl2.
Roztwór z każdej probówki podzielono na dwie części i do każdej części dodano inny odczynnik. Wyniki eksperymentu zestawiono w tabeli:
a) Napisz wzory lub nazwy substancji znajdujących się w probówkach 1–3.
Probówki:
1: ……………………………………..
2: ……………………………………..
3: ……………………………………..
b) Napisz w formie jonowej skróconej równania obu reakcji, które umożliwiły identyfikację substancji znajdującej się w probówce 2.
a)
1. chlorek sodu (NaCl)
2. węglanu sodu (Na2CO3)
3. siarczanu(VI) magnezu (MgSO4)
b)
2H+ + CO32- → H2O + CO2↑ i Ba2+ + CO32- → BaCO3↓