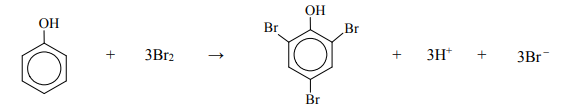
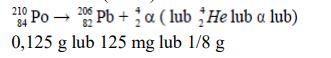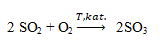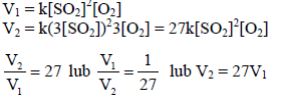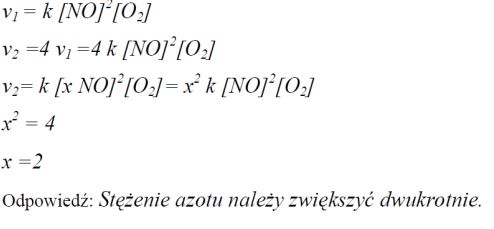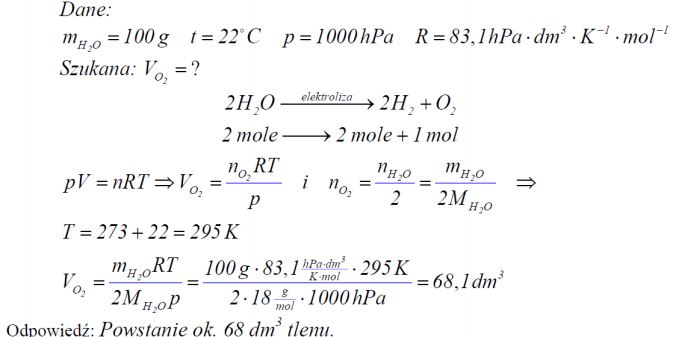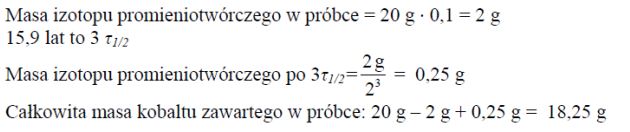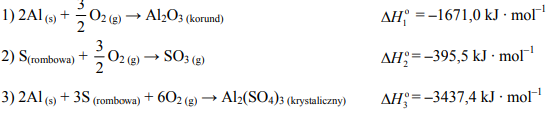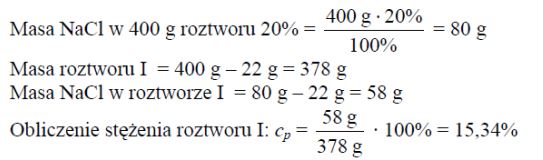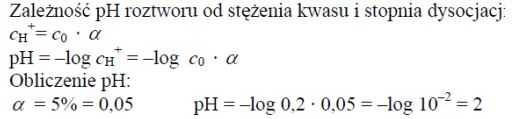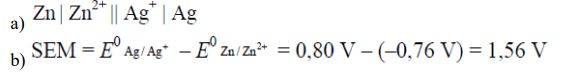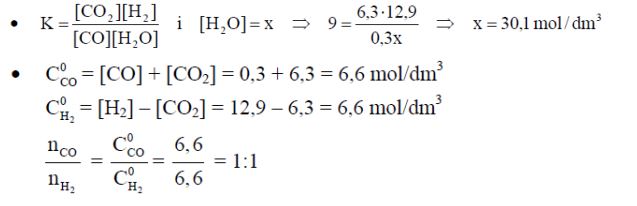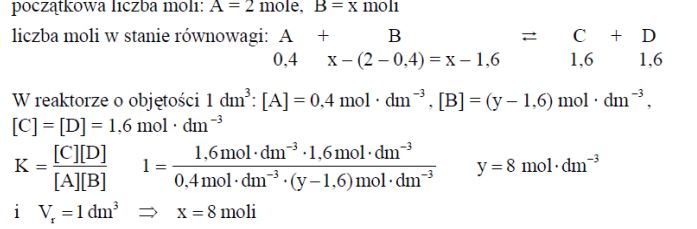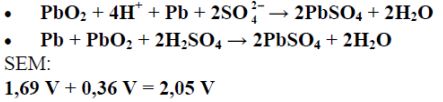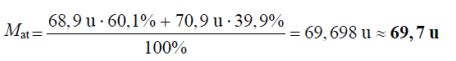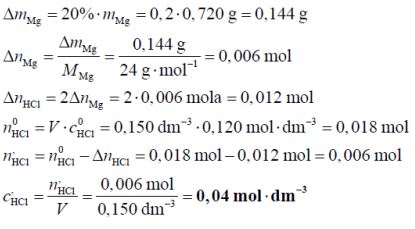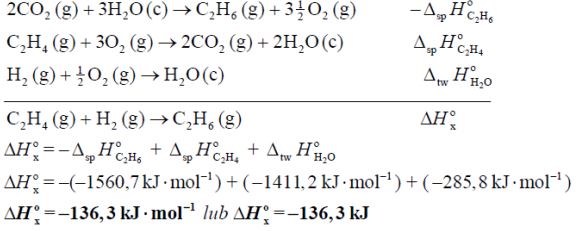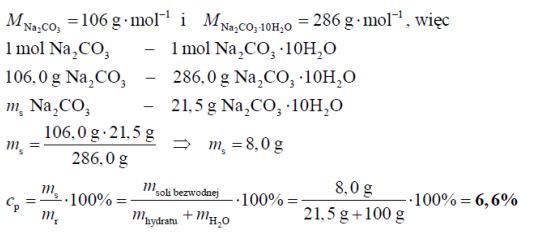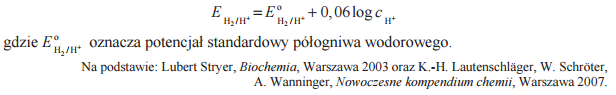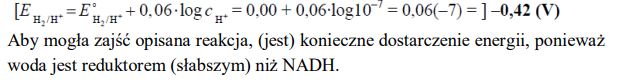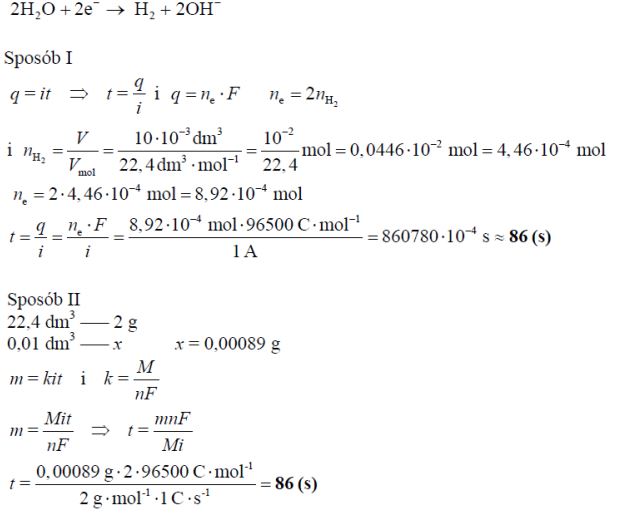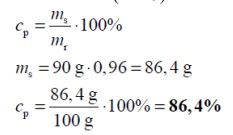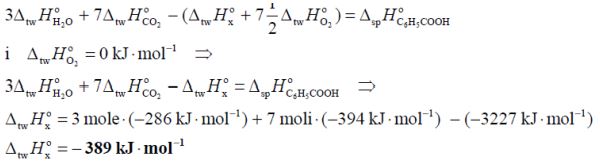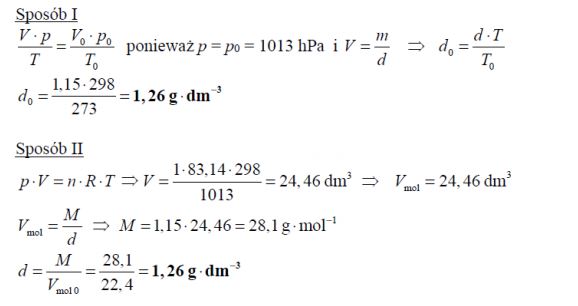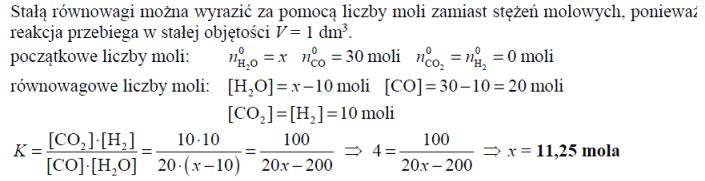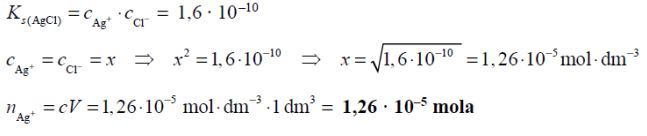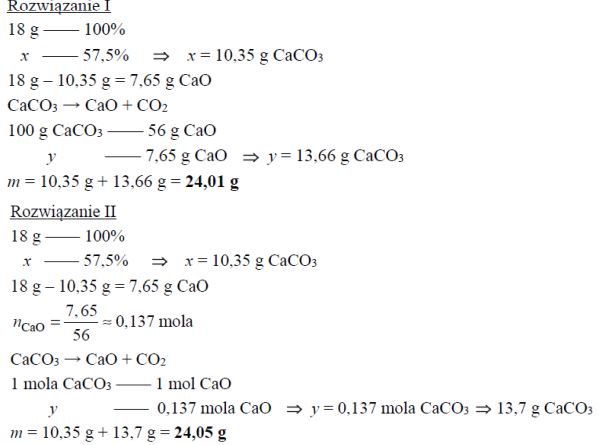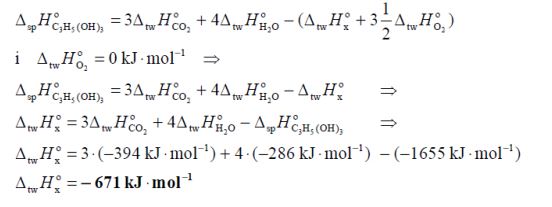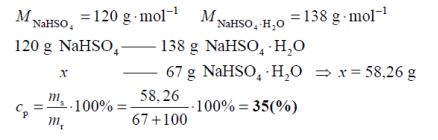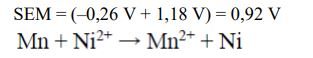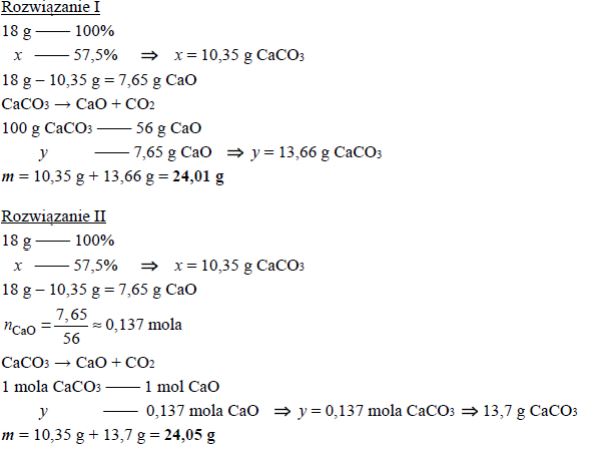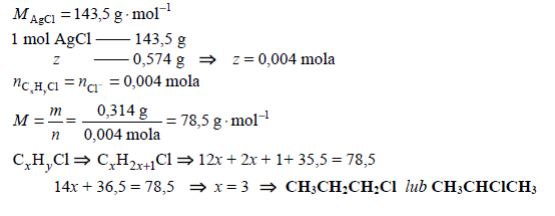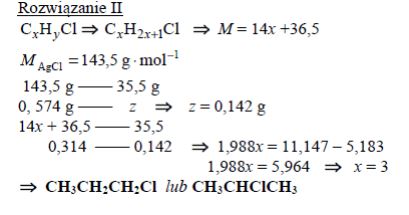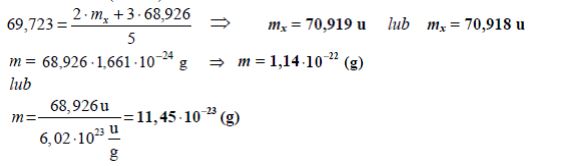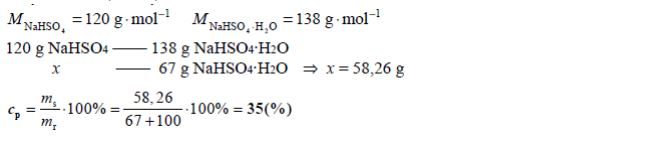Zadania maturalne z Chemii
Tematyka: mol, stężenia roztworów, prawo Avogadra, gazy doskonałe i rzeczywiste, wydajność reakcji, entalpia, szybkość reakcji, odczyn pH, stała reakcji chemicznej, stopień dysocjacji, prawo Ostwalda.
Zadania pochodzą z oficjalnych arkuszy maturalnych CKE, które służyły przeprowadzaniu majowych egzaminów. Czteroznakowy kod zapisany przy każdym zadaniu wskazuje na jego pochodzenie: S/N – „stara”/”nowa” formuła; P/R – poziom podstawowy/rozszerzony; np. 08 – rok 2008.
Zbiór zadań maturalnych w formie arkuszy, możesz pobrać >> TUTAJ <<.
Zadanie 62. (SR05)
W pojemniku umieszczono 1 gram polonu o liczbie A = 210, a liczbie Z = 84. Oszacuj masę tego izotopu, która pozostanie po upływie 414 dni.
Zadanie 63. (SR05)
Szybkość reakcji:
wyraża się równaniem kinetycznym:
Oblicz, jak zmieni się szybkość tej reakcji, jeżeli do przeprowadzenia procesu, przy niezmienionej ilości reagentów, zastosuje się naczynie o trzykrotnie mniejszej objętości.
Zadanie 64. (SR05)
W zbiorniku o pojemności 30 dm3 znajduje się 34 g gazu pod ciśnieniem 1520 hPa w temperaturze 275K. Oblicz masę molową tego gazu. Stała gazowa R = 83,14 hPa·dm3 ·K-1·mol-1.
Zadanie 65. (SR05)
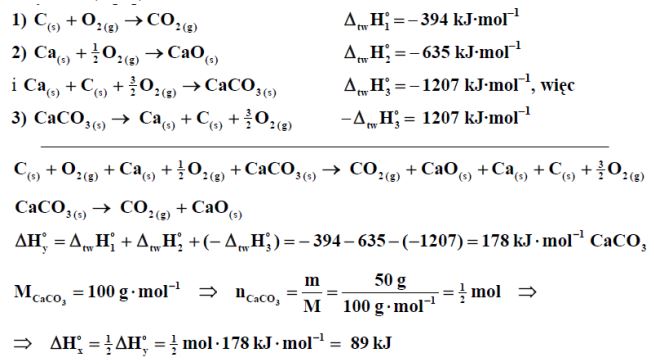
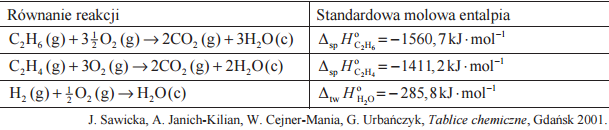
Oblicz entalpię tworzenia (∆ HX) tlenku węgla(II):
na podstawie entalpii następujących reakcji:
Zadanie 66. (SR05)
Pomiędzy osadem a roztworem trudno rozpuszczalnej soli AnBm ustala się równowaga opisana równaniem:
AnBm(s) ⇄ +
Iloczyn stężeń jonów w stanie równowagi w nasyconym roztworze tej soli, który można przedstawić jako zależność:
Ir = n m
jest nazywany iloczynem rozpuszczalności.
Jeśli iloczyn ze stężeń jonów A(m+) x B(m-) obecnych w roztworze jest większy od iloczynu rozpuszczalności, wówczas z roztworu wytrąca się osad.
Przeprowadź odpowiednie obliczenia i odpowiedz, czy po zmieszaniu równych objętości roztworu CaCl2 o stężeniu 0,05 mol·dm-3 i roztworu Na2SO4 o stężeniu 0,05 mol·dm-3 wytrąci się osad CaSO4 (iloczyn rozpuszczalności CaSO4 Ir = 4,93·10-5).
Zadanie 67. (SR06)
Promieniotwórczy izotop węgla C-14 powstaje w górnych warstwach atmosfery i ulega asymilacji przez rośliny w postaci tlenku węgla(IV). Równowaga, jaka się ustala w procesach odżywiania i oddychania w danym środowisku sprawia, że zawartość węgla w organizmach żywych jest stała. W przypadku obumarcia organizmu izotop C-14 przestaje być uzupełniany i z upływem czasu jego ilość w obumarłych szczątkach organizmu ulega zmniejszeniu na skutek rozpadu promieniotwórczego.
Na podstawie: A. Czerwiński, Energia jądrowa i promieniotwórczość, Warszawa 1998
Ustal, wykonując obliczenia, ile razy zmalała zawartość izotopu węgla C-14 w drewnie, które pochodzi z drzewa obumarłego przed 11460 laty. Okres półtrwania tego izotopu węgla wynosi 5730 lat.
Zadanie 68. (SR06)
Oblicz maksymalną objętość tlenku siarki(IV), jaka może być związana przez wodny roztwór zawierający 3 mole wodorotlenku sodu w temperaturze 25ºC i pod ciśnieniem 1013 hPa. Załóż, że produktem reakcji jest sól obojętna. Wartość stałej gazowej R wynosi 83,1 [(hPa*dm3)/(K*mol)].
Zadanie 69. (SR06)
W temperaturze 25ºC zmierzono pH wodnego roztworu słabego jednoprotonowego kwasu o stężeniu 0,1 mol·dm–3. Wynosiło ono 4. Oblicz stałą dysocjacji tego kwasu w temperaturze 25ºC.
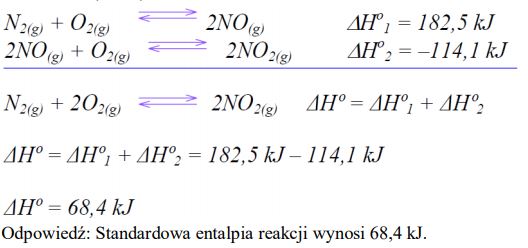
Zadanie 70. (SR06)
Oblicz standardową entalpię reakcji:
N2(g) + 2O2(g) 2NO2(g)
Zadanie 71. (SR06)
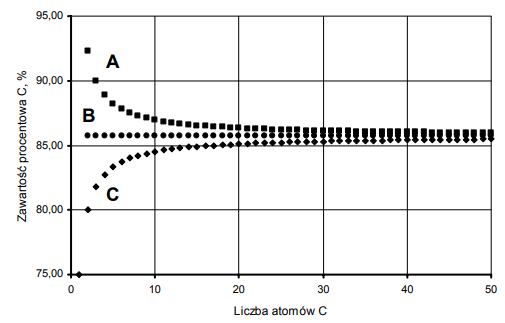
Określ, do jakiej wartości procentowej zawartości węgla dążą krzywe A i C. Odpowiedź uzasadnij obliczeniami.
Zadanie 72. (SR07)
Oblicz, w jakim stosunku masowym należy zmieszać ze sobą wodę destylowaną i roztwór wodorotlenku sodu o stężeniu 6,10 mol/dm3 i gęstości 1,22 g/cm3 , aby otrzymać roztwór o stężeniu 10%.
Zadanie 73. (SR07)
Zmieszano 100 cm3 roztworu CaCl2 o stężeniu 0,001 mol/dm3 i 100 cm3 roztworu Na2CO3 o stężeniu 0,001 mol/dm3 . Wykonaj odpowiednie obliczenia i oceń, czy po zmieszaniu roztworów nastąpiło wytrącenie osadu CaCO3.
Zadanie 74. (SR07)
Oblicz, ile moli tytanu i ile moli glinu zawiera tzw. gwóźdź ortopedyczny o masie 120 g wykonany ze stopu tytanu o podanym wyżej składzie.
Zadanie 75. (SR07)
Tlenek azotu(II) reaguje z tlenem, tworząc tlenek azotu(IV):
2NO + O2 → 2NO2
Szybkość tej reakcji opisuje równanie kinetyczne:
v = k [NO]2 [O2]
Oblicz, ile razy należy zwiększyć stężenie tlenku azotu(II), nie zmieniając stężenia tlenu i warunków przebiegu procesu, aby szybkość reakcji wzrosła czterokrotnie.
Zadanie 76. (SR08)
Oblicz stężenie molowe badanego roztworu wodorotlenku sodu. Wynik podaj z dokładnością do dwóch miejsc po przecinku.
Zadanie 77. (SR08)
Mangan można otrzymać w wyniku reakcji MnO2 z glinem, przebiegającej zgodnie z równaniem
Źródłem MnO2 jest występujący w przyrodzie minerał, piroluzyt, który zawiera od 94% do 99% masowych tego tlenku. Oblicz, ile gramów glinu potrzeba do redukcji 55 g piroluzytu, który zawiera 95% masowych tlenku manganu(IV). Pozostałe 5% masy minerału to substancje niereagujące z glinem ani z manganem.
Zadanie 78. (SR08)
Oblicz, jaką objętość, w temperaturze 22°C i pod ciśnieniem 1000 hPa, zajmie tlen otrzymany w wyniku elektrolitycznego rozkładu 100 gramów wody. Wartość stałej gazowej R wynosi 83,1 [(hPa*dm3)/(K-1*mol-1)].
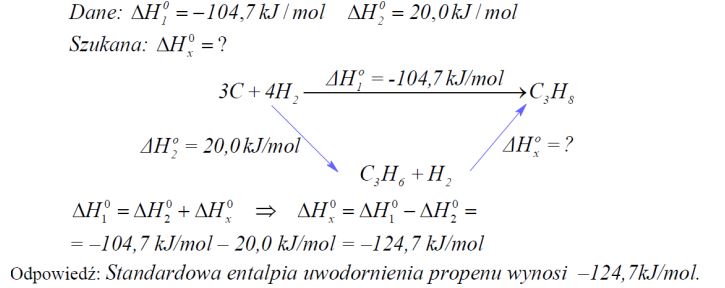
Zadanie 79. (SR08)
Oblicz standardową entalpię uwodornienia propenu 0 Δ , jeżeli standardowa entalpia tworzenia propanu Δ wynosi 104,7 kJ /mol , a standardowa entalpia tworzenia propenu Δ wynosi 20,0 kJ /mol .
Na podstawie: W. Mizerski „Tablice chemiczne”, Warszawa 1997
Zadanie 80. (SR09)
Próbka metalicznego kobaltu o masie 20 g zawiera 10% masowych promieniotwórczego izotopu 60Co, którego okres półtrwania τ1/2 = 5,3 lat. Pozostałą masę próbki stanowią trwałe izotopy kobaltu. Oblicz, jaka będzie całkowita masa kobaltu zawartego w próbce po upływie 15,9 lat.
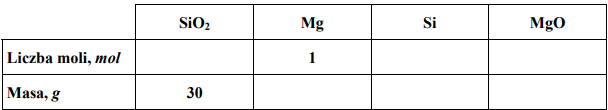
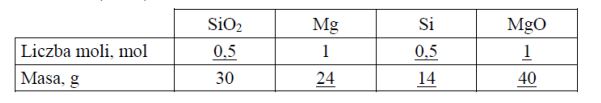
Zadanie 81. (SR09)
Wolny krzem można otrzymać w laboratorium, redukując SiO2 za pomocą metalicznego magnezu. Proces ten ilustruje równanie reakcji:
Uzupełnij tabelę, wpisując w odpowiednie miejsca obliczone liczby moli oraz masy substratów i produktów tej reakcji. W obliczeniach przyjmij przybliżone wartości mas molowych: MSi = 28 g · mol–1, MMg = 24 g · mol–1, MO = 16 g · mol–1.
Zadanie 82. (SR09)
Oblicz standardową entalpię (ΔHo ) reakcji opisanej równaniem:
Al2O3 (korund) + 3SO3(g) → Al2 (SO4)3 (krystaliczny)
znając standardowe entalpie tworzenia:
Wynik podaj z dokładnością do jednego miejsca po przecinku.
Zadanie 83. (SR09)
Do roztworu chlorku sodu o nieznanym stężeniu (roztwór I) dodano 22,00 g stałego NaCl. Otrzymano 400,00 g roztworu o stężeniu 20% masowych. Oblicz stężenie procentowe roztworu I w procentach masowych. Wynik podaj z dokładnością do dwóch miejsc po przecinku.
Zadanie 84. (SR09)
Oblicz pH roztworu kwasu o wzorze ogólnym HR i stężeniu c0 = 0,2 mol · dm–3, jeżeli stopień dysocjacji tego kwasu α = 5%.
Zadanie 85. (SR09)
Podczas pracy pewnego ogniwa zachodzą procesy elektrodowe, których przebieg można przedstawić sumarycznym równaniem reakcji:
Zn + 2Ag+ → Zn2+ + 2Ag
Korzystając z szeregu elektrochemicznego metali, przedstaw schemat ogniwa, w którym zachodzi powyższa reakcja b) Oblicz SEM tego ogniwa dla warunków standardowych.
Zadanie 86. (SR09)
Szybkość pewnej reakcji zachodzącej w fazie gazowej wyraża się równaniem kinetycznym
v = k · cA2 · cB.
Przedstaw zależność między początkową i końcową szybkością tej reakcji oraz oblicz, jak zmieni się szybkość reakcji, jeżeli przy niezmienionej ilości reagentów i niezmienionej temperaturze ciśnienie reagujących gazów zmaleje dwukrotnie.
Zadanie 87. (SR10)
W dwóch jednakowych zbiornikach o objętości 2,0 dm3 każdy umieszczono oddzielnie takie same liczby moli substancji gazowych X i Y. Masa molowa substancji X jest dwa razy większa od masy molowej substancji Y. Temperatura w obu zbiornikach jest równa 481,3 K, a ciśnienie w zbiorniku z substancją X jest równe 2000,0 hPa.
Podaj wartość ciśnienia panującego w zbiorniku z substancją Y.
Oblicz, jaką wartość osiągnie ciśnienie w zbiorniku z substancją X, jeśli temperatura wzrośnie w nim o 100,0 K. Stała gazowa R = 83,1 dm3 * hPa *mol-1 *K-1 Wynik podaj z dokładnością do jednego miejsca po przecinku.
Wskaż gaz (X lub Y), który ma większą gęstość w warunkach normalnych.
Zadanie 88. (SR10)
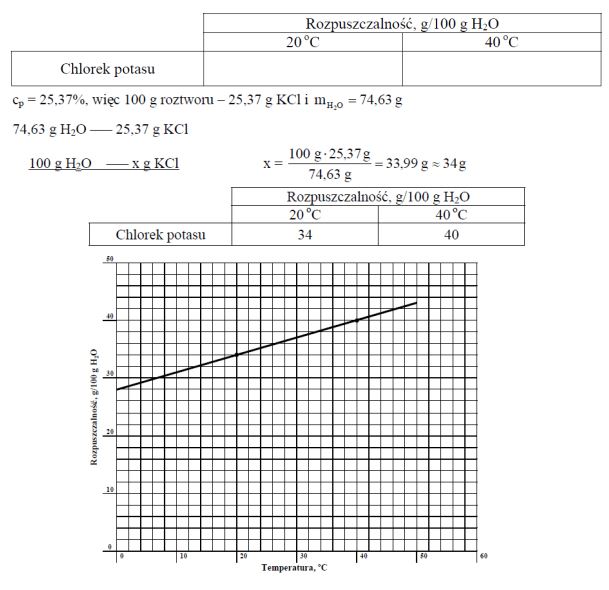
Stężenie procentowe nasyconego wodnego roztworu chlorku potasu o temperaturze 20 ºC wynosi 25,37% masowych. Rozpuszczalność w wodzie tego związku w temperaturze 40 ºC jest równa 40 g/100 g wody. W przedziale od 0 ºC do 50 ºC zależność rozpuszczalności chlorku potasu od temperatury jest liniowa. Korzystając z powyższych informacji, uzupełnij tabelę, a następnie narysuj wykres zależności rozpuszczalności chlorku potasu w wodzie od temperatury w przedziale od 0 ºC do 50 ºC.
Zadanie 89. (SR10)
W 1,00 dm3 wody rozpuszczono 112,00 dm3 chlorowodoru odmierzonego w warunkach normalnych. Oblicz stężenie procentowe otrzymanego kwasu solnego w procentach masowych. Załóż, że gęstość wody wynosi 1,00 g·cm–3. Wynik podaj z dokładnością do dwóch miejsc po przecinku.
Zadanie 90. (SR10)
W temperaturze 700 K stężeniowa stała równowagi reakcji opisanej równaniem:
CO(g) + H2O(g) ⇄ CO2(g) + H2(g)
ma wartość 9,0. Do reakcji tej użyto pary wodnej (H2O) oraz gazu syntezowego, czyli mieszaniny CO i H2, zamiast czystego CO. Reakcję prowadzono w układzie zamkniętym. Po osiągnięciu stanu równowagi w temperaturze 700 K stężenia CO, CO2, H2 były odpowiednio równe:
[CO] = 0,3 mol/dm3 , [CO2] = 6,3 mol/dm3 , [H2] = 12,9 mol/dm3 .
Oblicz stężenie równowagowe pary wodnej w temperaturze 700 K. Wynik podaj z dokładnością do jednego miejsca po przecinku. Korzystając z podanych w informacji wartości stężeń równowagowych reagentów, oblicz i napisz, w jakim stosunku molowym występowały CO i H2 w gazie syntezowym użytym do realizacji opisanej przemiany.
Zadanie 91. (SR11)
Sporządzono 200 g roztworu zawierającego 100 g sacharozy. Sacharozę poddano reakcji hydrolizy:
Reakcję przerwano w momencie, gdy całkowite stężenie cukrów redukujących w roztworze było równe 40% masowych. Oblicz stężenie sacharozy, wyrażone w procentach masowych, w roztworze po przerwaniu reakcji. W obliczeniach przyjmij przybliżone wartości mas molowych: M C12H22O11= 342 g · mol −1 , M C6H12O6 = 180 g · mol−1 .
Zadanie 92. (SR11)
W reaktorze o objętości 1 dm3 przebiegła przemiana zgodnie z równaniem A + B ⇄ C + D. Do reakcji użyto 2 mole substancji A i nadmiar substancji B. Po ustaleniu się stanu równowagi stwierdzono, że w mieszaninie poreakcyjnej znajduje się 0,4 mola substancji A. Stała równowagi tej reakcji w temperaturze prowadzenia procesu jest równa 1. Oblicz, ile moli substancji B użyto do tej reakcji. Wynik podaj z dokładnością do liczby całkowitej.
Zadanie 93. (SR11)
Reakcja A + 2B ⇄ C przebiega w temperaturze T według równania kinetycznego v = k·cA·cB2 . Początkowe stężenie substancji A było równe 2 mol · dm−3 , a substancji B było równe 3 mol · dm−3 . Szybkość początkowa tej reakcji była równa 5,4 mol · dm−3 · s−1 . a) Oblicz stałą szybkości reakcji w temperaturze T, wiedząc, że dla reakcji przebiegającej według równania kinetycznego v = k·cA·cB2 stała szybkości k ma jednostkę: mol−2 * dm6 * s-1. b) Korzystając z powyższych informacji, oblicz szybkość reakcji w momencie, gdy przereaguje 60% substancji A. Wynik podaj z dokładnością do czwartego miejsca po przecinku.
Zadanie 94. (SR12)
Poniżej podano wartości standardowej entalpii tworzenia trzech związków chemicznych.
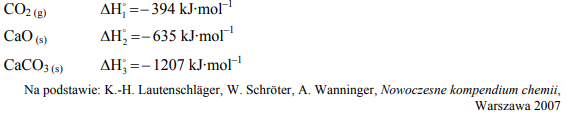
CaCO3(s) → CaO(s) + CO2(g)
Zadanie 95. (SR12)
W pewnych warunkach temperatury i ciśnienia, innych niż warunki normalne, odmierzono 1,00 dm3 gazowego paliwa, którego 55% objętości stanowił propan, 44% objętości stanowił butan, a 1% objętości – składniki niepalne. Oblicz objętość tlenku węgla(IV), który powstanie w tych samych warunkach temperatury i ciśnienia w wyniku całkowitego spalenia odmierzonej objętości paliwa zgodnie z równaniami
C3H8 + 5O2 → 3CO2 + 4H2O i 2C4H10 + 13O2 → 8CO2 + 10H2O
Wynik podaj z dokładnością do drugiego miejsca po przecinku.
Zadanie 96. (SR12)
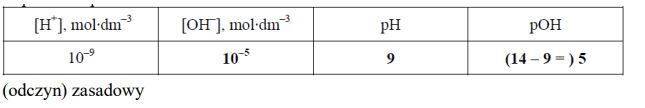
Uzupełnij tabelę, wpisując wartość stężenia jonów OH– oraz wartość pH i pOH roztworu wodnego, w którym stężenie jonów H+ jest równe 10–9 mol·dm–3. Określ odczyn opisanego roztworu.

Zadanie 97. (SR13)
Jednym z promieniotwórczych izotopów strontu jest 90Sr. Jego okres półtrwania wynosi około 28 lat. Izotop ten jest bardzo niebezpieczny dla człowieka, ponieważ ze względu na swoje właściwości chemiczne łatwo wbudowuje się w tkankę kostną w miejsce nieradioaktywnego izotopu innego pierwiastka. a) Oblicz, po jakim czasie z próbki 90Sr o masie 51,2 mg pozostanie 0,4 mg tego izotopu. Podaj symbol chemiczny pierwiastka, w miejsce którego wbudowuje się strony.
Zadanie 98. (SR13)
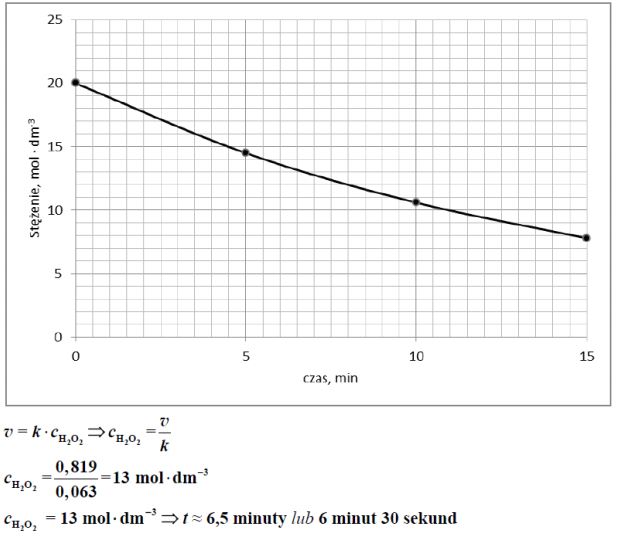
Rozkład nadtlenku wodoru w obecności pewnego katalizatora przebiega według równania kinetycznego
V=k*CH2O2
Do próbki z roztworem nadtlenku wodoru o stężeniu 20,0 mol* dm–3 dodano katalizator i stwierdzono, że po upływie 5 minut stężenie nadtlenku wodoru zmalało do 14,5 mol *dm–3 × , po upływie 10 minut wynosiło 10,6 mol* dm–3 × , a po upływie 15 minut było równe 7,8 . mol dm‑3 × Stała szybkości reakcji w warunkach prowadzenia procesu wynosi k = 0,063 min–1 .
Korzystając z informacji, uzupełnij poniższą tabelę, a następnie narysuj wykres zależności stężenia nadtlenku wodoru od czasu.
Na podstawie odpowiednich obliczeń i wykresu ustal, po jakim czasie szybkość reakcji będzie równa 0,819 mol·dm–3 ·min–1 .
Zadanie 99. (SR13)
W reaktorze o objętości 1 dm3 pr zebiega w stałej temperaturze T reakcja opisana schematem
A (g) + B (g) ⇄ 2C (g) + D (g)
Po zmieszaniu substratów A i B w stosunku molowym 1 : 1 zainicjowano reakcję. W mieszaninie równowagowej stężenie substancji D było równe 2 3 mol dm- × , a stosunek stężeń molowych reagentów B i C wynosił [B]:[C] = 1 : 2,3. Oblicz stałą równowagi tej reakcji w temperaturze T. Wynik podaj z dokładnością do dwóch miejsc po przecinku.
Zadanie 100. (SR13)
Do 100 g wodnego roztworu NaOH o stężeniu 10% masowych dodano 100 g kwasu solnego o stężeniu 10% masowych. Spośród podanych poniżej zależności wybierz i podkreśl tę, która jest prawdziwa dla otrzymanego roztworu.
A. pH > 7
B. pH = 7
C. pH < 7
Zadanie 101. (SR13)
Przygotowano 200 gramów wodnego roztworu maltozy o stężeniu 25,65% masowych. Po częściowej hydrolizie maltozy zachodzącej zgodnie z równaniem:
sumaryczna liczba moli cukrów redukujących (glukozy i maltozy) w roztworze wynosiła 0,28 mola. Oblicz stężenie glukozy, wyrażone w procentach masowych, w roztworze powstałym po częściowej hydrolizie maltozy. Wynik podaj z dokładnością do jednego miejsca po przecinku. W obliczeniach przyjmij przybliżone wartości mas molowych:
Zadanie 102. (SR13)
W poniższej tabeli przedstawiono równania reakcji elektrodowych oraz odpowiadające im wartości potencjałów standardowych dwóch półogniw redoks tworzących tzw. akumulator kwasowo-ołowiowy.
Korzystając z podanych informacji, napisz sumaryczne równanie reakcji, która zachodzi w pracującym akumulatorze kwasowo-ołowiowym, oraz oblicz siłę elektromotoryczną (SEM) tego ogniwa w warunkach standardowych.
Zadanie 103. (SR14)
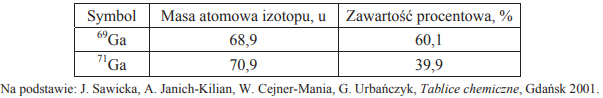
W poniższej tabeli przedstawiono masy atomowe i zawartość procentową trwałych izotopów galu występujących w przyrodzie.
Oblicz masę atomową galu. Wynik zaokrąglij do pierwszego miejsca po przecinku.
Zadanie 104. (SR14)
Po wrzuceniu 0,720 g magnezu do 0,150 dm3 kwasu solnego o stężeniu 0,120 mol · dm–3 zaszła reakcja opisana równaniem:
Mg + 2H3O+ → Mg2+ + H2 + 2H2O
Oblicz stężenie molowe kwasu solnego w momencie, gdy przereagowało 20% masy magnezu. W obliczeniach przyjmij, że objętość roztworu się nie zmienia. Wynik podaj z dokładnością do dwóch miejsc po przecinku.
Zadanie 105. (SR14)
W tabeli podano wartości standardowej molowej entalpii trzech reakcji.
Na podstawie powyższych danych oblicz standardową molową entalpię reakcji uwodornienia etenu która zachodzi zgodnie z równaniem:Wynik podaj z dokładnością do pierwszego miejsca po przecinku.
Zadanie 106. (SR14)
W temperaturze 20 °C rozpuszczalność uwodnionego węglanu sodu o wzorze Na2CO3·10H2O wynosi 21,5 grama w 100 gramach wody. Oblicz, jaki procent masy roztworu nasyconego w temperaturze 20 °C stanowi masa soli bezwodnej Na2CO3. Wynik podaj z dokładnością do pierwszego miejsca po przecinku.
Zadanie 107. (SR14)
Jeżeli w reakcji redoks biorą udział jony H+ , to potencjał układu zależy od stężenia tych jonów, czyli od pH roztworu. Dla takich układów potencjał odnosi się do roztworów, w których Hc+ = 1 mol · dm–3, a więc pH = 0. Wartości potencjałów redoks wielu ważnych biologicznie układów utleniacz – reduktor przedstawiane są dla przyjętego przez biochemików stanu, w którym pH = 7, p = 1013 hPa, T = 298 K. Różnica pH roztworu wpływa na wartość potencjału półogniwa. Potencjał półogniwa wodorowego EH2/H+ w środowisku o pH różnym od zera można obliczyć (w woltach), korzystając z następującej zależności:
Oblicz potencjał półogniwa wodorowego w stanie, w którym pH = 7, p = 1013 hPa, T = 298 K.
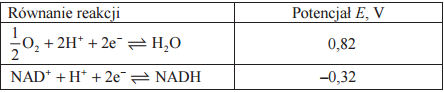
Poniżej przedstawiono równania reakcji i potencjały redoks dwóch układów biologicznych dla pH = 7, p = 1013 hPa, T = 298 K.
Oceń, czy reakcja zilustrowana równaniem
zachodzi samorzutnie, czy do jej zajścia konieczne jest dostarczenie energii. Uzupełnij poniższe zdanie: wybierz i podkreśl jedno określenie w każdym nawiasie. Aby mogła zajść opisana reakcja, (jest / nie jest) konieczne dostarczenie energii, ponieważ woda jest reduktorem (silniejszym / słabszym) niż NADH.
Zadanie 108. (SR14)
Elektroliza wodnego roztworu chlorku sodu na elektrodach grafitowych przebiega zgodnie z równaniem:
Oblicz, ile sekund trwała elektroliza, jeśli otrzymano 10 cm3 wodoru (w przeliczeniu na warunki normalne), a natężenie prądu przepuszczanego przez elektrolizer wynosiło 1 A. Stała Faradaya F = 96500 C · mol–1. Wynik zaokrąglij do liczb całkowitych.
Zadanie 109. (SR14)
Reakcja kwasu etanowego (octowego) z etanolem prowadzona w obecności mocnego kwasu jest reakcją odwracalną, która przebiega według równania:
Stężeniowa stała równowagi tej reakcji w temperaturze 25 °C wynosi Kc = 4,0. Badając kinetykę reakcji kwasu etanowego z etanolem w środowisku wodnym, stwierdzono, że względny rząd reakcji dla etanolu i kwasu etanowego wynosi 1, a całkowity rząd reakcji jest równy 2. Rząd reakcji ze względu na wybrany substrat to wykładnik potęgi, w której stężenie molowe danego substratu występuje w równaniu kinetycznym tej reakcji.
Na podstawie: P. Mastalerz, Chemia organiczna, Wrocław 2000.
W naczyniu o objętości V zmieszano w temperaturze 25 °C 1 mol kwasu etanowego i 1 mol etanolu. Do otrzymanej mieszaniny dodano niewielką ilość stężonego kwasu siarkowego(VI). Oblicz, ile moli kwasu etanowego pozostało w mieszaninie po ustaleniu się stanu równowagi.
Zadanie 110. (SR15)
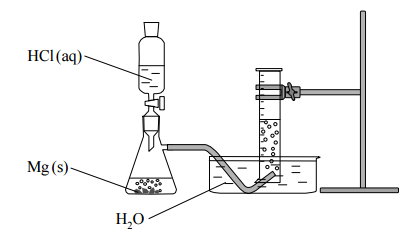
W temperaturze 20 ºC i pod ciśnieniem 1005 hPa wykonano eksperyment, którego przebieg przedstawiono na rysunku. W kolbie zaszła reakcja opisana równaniem:
Mg+ 2HCl →MgCl2 +H2
Oblicz, ile cm3 kwasu solnego o stężeniu 2 mol · dm–3 potrzeba do całkowitego roztworzenia 2 gramów magnezu. Wynik zaokrąglij do jedności.
Opisz sposób wyodrębnienia z mieszaniny poreakcyjnej jonowego produktu tej reakcji. Załóż, że magnez przereagował całkowicie.
Wykonaj obliczenia i oceń, czy wodór wydzielony w reakcji 2 gramów magnezu z nadmiarem kwasu solnego w temperaturze 20 ºC i pod ciśnieniem 1005 hPa zmieści się w użytym w doświadczeniu cylindrze miarowym o pojemności 1000 cm3 . Uniwersalna stała gazowa
R = 83,1 dm3 · hPa · mol–1·K–1.
W opisanych warunkach eksperymentu reakcja magnezu z kwasem solnym zachodziła bardzo szybko. Wymień dwa sposoby zmiany warunków wykonania eksperymentu, w których wyniku szybkość zachodzącej reakcji będzie mniejsza.
Zadanie 111. (SR15)
W temperaturze 25 ºC sacharoza hydrolizuje w środowisku o odczynie kwasowym, tak że po upływie 192 minut reakcji ulega połowa początkowej ilości disacharydu. Oznacza to, że okres półtrwania sacharozy w opisanych warunkach jest równy 192 minuty.
Na podstawie: P.W. Atkins, Chemia fizyczna, Warszawa 2001.
Oblicz, po ilu minutach ulegnie hydrolizie w opisanych warunkach 75% początkowej ilości sacharozy. Wynik podaj w zaokrągleniu do jedności.
Zadanie 112. (SR15)
W odpowiednich warunkach cyklopropan przekształca się w propen według schematu cyklopropan (g) → propen (g)
Szybkość przemiany cyklopropanu w propen jest wprost proporcjonalna do stężenia molowego cyklopropanu i wyraża się równaniem v = k·ccyklopropanu. W temperaturze 500 ºC stała szybkości tej reakcji k wynosi około 7 s–1.
Na podstawie: P.W. Atkins, Chemia fizyczna, Warszawa 2001.
W reaktorze o objętości równej 1 dm3 umieszczono 12 moli cyklopropanu i ogrzano do temperatury 500 ºC. Stwierdzono, że po 17 minutach od momentu zapoczątkowania reakcji liczba moli cyklopropanu wyniosła 6, po 34 minutach wyniosła 3, a po 51 minutach była równa 1,5.
Oblicz szybkość opisanej reakcji w następujących momentach: − początkową, v0
− po 17 minutach od momentu zapoczątkowania reakcji, v1
− po 34 minutach od momentu zapoczątkowania reakcji, v2
− po 51 minutach od momentu zapoczątkowania reakcji, v3.
Wypełnij poniższą tabelę.
Zaznacz literę P, jeżeli zdanie jest prawdziwe, lub literę F, jeżeli jest fałszywe.
Zadanie 113. (SR15)
W zamkniętym reaktorze o stałej pojemności umieszczono n moli jodowodoru i utrzymywano stałą temperaturę. W reaktorze zachodziła reakcja rozkładu jodowodoru opisana równaniem:
Po ustaleniu się stanu równowagi stwierdzono, że rozkładowi uległo 16,7% początkowej liczby moli jodowodoru. Oblicz stężeniową stałą równowagi rozkładu jodowodoru w opisanych warunkach.
Zadanie 114. (SR15)
Jodyna jest preparatem o działaniu odkażającym. Aby otrzymać 100,0 gramów jodyny, miesza się 3,0 gramy jodu, 1,0 gram jodku potasu, 90,0 gramów etanolu o stężeniu 96% masowych (pozostałe 4% masy stanowi woda) oraz 6,0 gramów wody. Powstała mieszanina jest ciemnobrunatnym roztworem. Jod rozpuszczony w etanolu ma ograniczoną trwałość. Reaguje z wodą obecną w roztworze, tworząc jodowodór i kwas jodowy(I) o wzorze HIO, który z kolei utlenia etanol najpierw do aldehydu, a następnie − do dalszych produktów. Aby zapobiec tym przemianom, do jodyny dodaje się rozpuszczalny w wodzie jodek potasu. W wyniku reakcji jodu cząsteczkowego z jonami jodkowymi powstają trwałe jony trijodkowe, dzięki czemu jod nie reaguje z wodą.
Na podstawie: http://www.doz.pl, A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010 oraz R.T. Morrison, R.N. Boyd, Chemia organiczna, t. 1, Warszawa 2008.
Oblicz stężenie procentowe (w procentach masowych) etanolu w jodynie przy założeniu, że nie zaszła reakcja utleniania etanolu. Wynik zaokrąglij do pierwszego miejsca po przecinku.
Zadanie 115. (SR15)
Standardowa molowa entalpia reakcji spalania kwasu benzoesowego opisanej równaniem

Na podstawie: J. Sawicka, A. Janich-Kilian, W. Cejner-Mania, G. Urbańczyk, Tablice chemiczne, Gdańsk 2001.
Na podstawie powyższych danych oblicz standardową entalpię tworzenia kwasu benzoesowego w stałym stanie skupienia Wynik podaj w zaokrągleniu do jedności.
Zadanie 116. (SR16)
Gęstość pewnego gazu w temperaturze t = 25 °C i pod ciśnieniem 1013 hPa jest równa
d = 1,15g*dm−3. Oblicz gęstość tego gazu w warunkach normalnych. Wynik podaj z dokładnością do drugiego miejsca po przecinku. Stała gazowa R = 83,14 . hPa*dm3*k-1*mol-1.
Zadanie 117. (SR16)
W temperaturze 800 K stężeniowa stała równowagi reakcji przebiegającej zgodnie z równaniem
jest równa 4. Oblicz, ile moli wody (w postaci pary wodnej) należy wprowadzić do reaktora o pojemności 1 dm3 , w którym znajduje się 30 moli tlenku węgla(II), aby otrzymać 10 moli wodoru w temperaturze 800 K. Reakcja pary wodnej i tlenku węgla(II) przebiega w zamkniętym reaktorze.
Zadanie 118. (SR16)
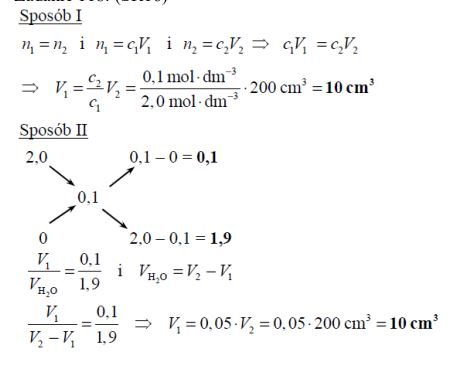
Oblicz, ile cm3 wodnego roztworu NaOH o stężeniu 2,0 mol · dm–3 należy zmieszać z wodą destylowaną, aby otrzymać 200 cm3 roztworu o stężeniu 0,1 mol · dm–3.
Zadanie 119. (SR16)
Halogenki srebra są związkami trudno rozpuszczalnymi w wodzie. Ich iloczyny rozpuszczalności w temperaturze 25 ºC wynoszą:
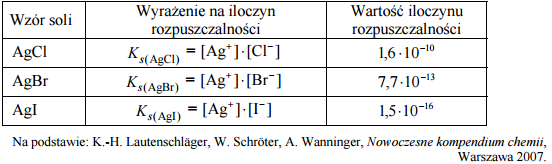
Zadanie 120. (SR16)
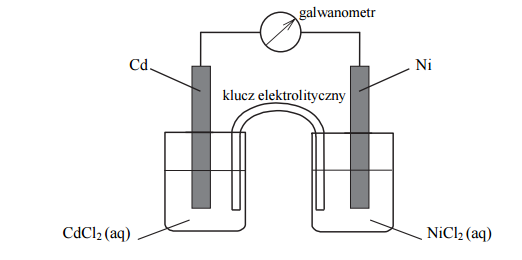
Zbudowano ogniwo według schematu przedstawionego na poniższym rysunku.
Oblicz siłę elektromotoryczną (SEM) ogniwa, którego schemat przedstawiono na rysunku, w warunkach standardowych.
Napisz w formie jonowej skróconej sumaryczne równanie reakcji zachodzącej w czasie pracy tego ogniwa.
SEM ogniwa galwanicznego zależy nie tylko od wartości potencjału standardowego półogniw, z których jest zbudowane, lecz także od stężenia jonów w roztworach tworzących półogniwa. Wartość potencjału półogniwa E – wyrażonego w woltach – oblicza się z równania Nernsta. Dla półogniwa metalicznego równanie to określa wpływ stężenia jonów metalu [Me ] z+ na wartość potencjału półogniwa i dla T = 298 K przyjmuje postać:
gdzie: Eo to potencjał standardowy półogniwa, z – liczba elektronów różniących formę utlenioną metalu od jego formy zredukowanej w procesie
Me ⇄ Mez+ + ze−
Uzupełnij poniższe zdania. Wybierz i zaznacz właściwe wzory spośród podanych w nawiasach.
- Podczas pracy opisanego ogniwa ubywa jonów (Cd2+ / Ni2+).
- Aby zwiększyć siłę elektromotoryczną tego ogniwa, należy zwiększyć stężenie (CdCl2 (aq) / NiCl2 (aq) ).
Zadanie 121. (SR16)
Próbkę 0,86 grama pewnego alkanu poddano całkowitemu spaleniu, a cały otrzymany w tej reakcji tlenek węgla(IV) pochłonięto w wodzie wapiennej, w której zaszła reakcja zgodnie z równaniem:
Otrzymany osad ważył po wysuszeniu 6 gramów. Ustal wzór sumaryczny tego alkanu. W obliczeniach zastosuj wartości masy molowej reagentów zaokrąglone do jedności.
Zadanie 122. (SR16)
Glicyna (kwas aminoetanowy) zaliczana jest do aminokwasów obojętnych, które charakteryzują się punktami izoelektrycznymi w zakresie pH 5,0–6,5. Reaguje z kwasami i zasadami, a w odpowiednich warunkach ulega reakcji kondensacji. Po wprowadzeniu glicyny do świeżo uzyskanej zawiesiny wodorotlenku miedzi(II) tworzy się rozpuszczalny w wodzie związek kompleksowy, a powstający roztwór przyjmuje ciemnoniebieskie zabarwienie.
Na podstawie: J. McMurry, Chemia organiczna, Warszawa 2005.
Sporządzono 100 gramów wodnego roztworu pewnego dipeptydu. Stężenie roztworu wynosiło 10% masowych. Następnie przeprowadzono częściową hydrolizę dipeptydu znajdującego się w roztworze, w wyniku której jako jedyny produkt otrzymano glicynę w ilości 0,1 mola. Oblicz stężenie dipeptydu, wyrażone w procentach masowych, w roztworze otrzymanym po częściowej hydrolizie, tzn. w momencie uzyskania 0,1 mola glicyny.
Zadanie 123. (SR17)
Reakcja syntezy amoniaku przebiega zgodnie z równaniem:
W mieszaninie wodoru i azotu użytej do syntezy amoniaku zawartość wodoru wyrażona w procentach objętościowych jest równa 75%. Wydajność reakcji syntezy amoniaku przeprowadzonej w temperaturze T i pod ciśnieniem p jest równa 93%. Oblicz wyrażoną w procentach objętościowych zawartość amoniaku w mieszaninie poreakcyjnej.
Zadanie 124. (SR17)
Oblicz, ile m3 wodoru w przeliczeniu na warunki normalne powstało w pierwszym etapie parowego reformingu metanu prowadzonego w temperaturze 1070 K i pod ciśnieniem 3 · 104 hPa, jeżeli wykorzystano 1 m3 metanu odmierzony w warunkach przemiany oraz nadmiar pary wodnej. Wydajność przemiany metanu była równa 95%. Uniwersalna stała gazowa R = 83,1 dm3·hPa·mol–1·K–1.
Zadanie 125. (SR17)
Próbkę czystego węglanu wapnia o masie m prażono przez pewien czas w otwartym naczyniu. Przebiegła wtedy reakcja zilustrowana równaniem:
CaCO3 → CaO + CO2
Po przerwaniu ogrzewania stwierdzono, że w naczyniu znajdowała się mieszanina substancji stałych o masie 18,0 gramów. Ustalono, że w tej mieszaninie zawartość węglanu wapnia wyrażona w procentach masowych jest równa 57,5%. Oblicz masę m próbki węglanu wapnia, którą poddano prażeniu.
Zadanie 126. (SR17)
Standardowa molowa entalpia reakcji spalania glicerolu opisanej równaniem:

Zadanie 127. (SR18)
W temperaturze 20 °C rozpuszczalność uwodnionego wodorosiarczanu(VI) sodu o wzorze NaHSO4 · H2O jest równa 67 gramów w 100 gramach wody.
Na podstawie: T. Mizerski, Tablice chemiczne, Warszawa 2004.
Oblicz, jaki procent masy roztworu nasyconego o temperaturze 20 °C stanowi masa soli bezwodnej NaHSO4.
Zadanie 128. (SR18)
Do 10 cm3 kwasu solnego o pH = 1 dodano 20 cm3 wodnego roztworu wodorotlenku sodu o stężeniu 0,2mol*dm-3 Przebiegła wtedy reakcja opisana równaniem
NaOH + HCl → NaCl + H2O
Oblicz pH otrzymanego roztworu. W obliczeniach przyjmij, że objętość powstałego roztworu jest sumą objętości roztworów wyjściowych.
Zadanie 129. (SR18)
Oblicz, ile gramów czystego złota należy stopić z 10 gramami 15-karatowego złota, aby otrzymać złoto 18-karatowe.
Zadanie 130. (SR18)
W jednej z przemysłowych metod otrzymywania kwasu siarkowego(VI) jako substrat pierwszego etapu stosuje się piryt (FeS2) – powszechnie występujący minerał.
FeS2 ⎯⎯→ SO2 ⎯⎯→ SO3 ⎯⎯→ H2SO4
W wyniku opisanego procesu – do którego na pierwszym etapie wykorzystano 100 gramów pirytu niezawierającego zanieczyszczeń – otrzymano wodny roztwór kwasu siarkowego (VI) o stężeniu 96% masowych. Sumaryczna wydajność procesu była równa 85%. Oblicz masę wodnego roztworu kwasu siarkowego(VI) uzyskanego w opisanym procesie.
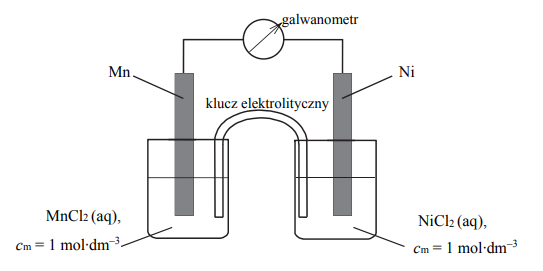
Zadanie 131. (SR18)
Zbudowano ogniwo według schematu przedstawionego na poniższym rysunku.
Oblicz siłę elektromotoryczną (SEM), w warunkach standardowych, ogniwa, którego schemat przedstawiono na rysunku.
Napisz w formie jonowej skróconej sumaryczne równanie reakcji zachodzącej w czasie pracy tego ogniwa.
Zadanie 132. (SR18)
Podczas elektrolizy wodnego roztworu chlorku chromu(III) CrCl3 (prowadzonej przy użyciu elektrod grafitowych) przez roztwór przepłynął ładunek elektryczny Q, co skutkowało wydzieleniem 156 gramów chromu. Oblicz, ile gramów cynku wydzieli się podczas przepływu takiego samego ładunku Q przez roztwór chlorku cynku ZnCl2. Przyjmij, że opisane procesy zachodzą ze 100% wydajnością. Stała Faradaya ma wartość F = 96500 C mol *-1.
Zadanie 133. (SR18)
Do całkowitego spalenia 2,80 dm3 (odmierzonych w warunkach normalnych) mieszaniny zawierającej 60% objętościowych pewnego gazowego alkanu i 40% objętościowych metanu potrzeba 13,16 dm3 tlenu w przeliczeniu na warunki normalne. Reakcje całkowitego spalania metanu oraz dowolnego alkanu przebiegają zgodnie z równaniami:
Wykonaj niezbędne obliczenia i podaj wzór sumaryczny alkanu, stanowiącego 60% objętości opisanej mieszaniny.
Zadanie 134. (NR15)
Brom występuje w przyrodzie w postaci mieszaniny dwóch izotopów o masach atomowych równych 78,92 u i 80,92 u. Średnia masa atomowa bromu jest równa 79,90 u. Pierwiastek ten w reakcjach utleniania i redukcji może pełnić funkcję zarówno utleniacza, jak i reduktora. Tworzy związki chemiczne, w których występują różne rodzaje wiązań.
Mol jest jednostką liczności (ilości) materii. Liczbę drobin odpowiadającą jednemu molowi nazywamy liczbą Avogadra. Oblicz bezwzględną masę (wyrażoną w gramach) pojedynczej cząsteczki bromu zbudowanej z atomów dwóch różnych izotopów.
Oblicz, jaki procent atomów bromu występujących w przyrodzie stanowią atomy o masie atomowej 78,92 u, a jaki procent – atomy o masie atomowej 80,92 u.
Zadanie 135. (NR15)
Tlenek siarki(IV) na skalę techniczną można otrzymać w wyniku redukcji siarczanu(VI) wapnia (anhydrytu) węglem w temperaturze 900 °C. Proces ten opisano poniższym równaniem.
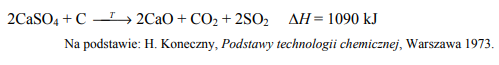
Zadanie 136. (NR15)
W temperaturze 20 °C rozpuszczalność azotanu(V) potasu jest równa 31,9 grama na 100 gramów wody. Oblicz stężenie molowe nasyconego wodnego roztworu azotanu(V) potasu w temperaturze 20 °C, jeżeli gęstość roztworu jest równa 1,16 g · cm −3 .
Na podstawie: J. Sawicka i inni, Tablice chemiczne, Gdańsk 2004.
Zadanie 137. (NR15)
Do 200 gramów wodnego roztworu chlorku glinu o stężeniu 15% (w procentach masowych) dodawano porcjami wodny roztwór wodorotlenku sodu zawierający 32 gramy NaOH, który całkowicie przereagował. Przebieg doświadczenia zilustrowano na poniższym schemacie.
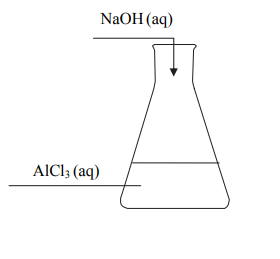
Zapisz, w formie jonowej skróconej, równania wszystkich reakcji zachodzących podczas tego doświadczenia, jeżeli produktem jednej z nich jest jon kompleksowy, w którym glin ma liczbę koordynacyjną równą 4. Równania reakcji zapisz w kolejności, w jakiej zachodzą poszczególne procesy.
Oblicz, ile gramów wodorotlenku glinu znajdowało się w kolbie po zakończeniu doświadczenia.
Zadanie 138. (NR15)
Oblicz pH wodnego roztworu kwasu etanowego o stężeniu 6,0% masowych i gęstości 1,00 g · cm −3 (t = 25 °C), dla którego stopień dysocjacji α ˂ 5%. Wynik końcowy zaokrąglij do pierwszego miejsca po przecinku.
Zadanie 139. (NR16)
Do reaktora wprowadzono 1,0 mol amoniaku i 1,6 mola tlenu, a następnie przeprowadzono – w odpowiednich warunkach – reakcję zilustrowaną poniższym równaniem.
Wykonaj obliczenia i podaj skład mieszaniny poreakcyjnej wyrażony w molach. Załóż, że opisana przemiana przebiegła z wydajnością równą 100%.
Zadanie 140. (NR16)
Amoniak bardzo dobrze rozpuszcza się wodzie, a w powstałym roztworze zachodzi reakcja opisana równaniem:
Oblicz, jaki procent wszystkich wprowadzonych do wody cząsteczek amoniaku ulega tej reakcji w wodnym roztworze amoniaku o stężeniu 0,1 mol · dm–3 w temperaturze 298 K. Przyjmij, że (w opisanych warunkach) reakcji ulega mniej niż 5% wprowadzonych do wody cząsteczek amoniaku.
Zadanie 141. (NR16)
W temperaturze 20 °C rozpuszczalność pentahydratu tiosiarczanu sodu wynosi 176 gramów w 100 gramach wody.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2003.
Oblicz, ile gramów wody należy dodać do 100 gramów nasyconego w temperaturze 20 °C wodnego roztworu tiosiarczanu sodu, aby uzyskać roztwór o stężeniu 25% masowych. W obliczeniach zastosuj wartości masy molowej reagentów zaokrąglone do jedności. Wynik końcowy zaokrąglij do jedności.
Zadanie 142. (NR16)
Do próbki o masie m, która zawierała mieszaninę stałego węglanu wapnia i stałego wodorowęglanu wapnia w stosunku molowym
dodano nadmiar kwasu solnego. W wyniku zachodzących reakcji zebrano 5,6 dm3 tlenku węgla(IV) odmierzonego w warunkach normalnych. Opisane przemiany prowadzące do wydzielenia gazu można zilustrować równaniami: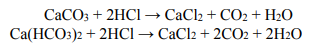
Zadanie 143. (NR16)
Próbkę 0,86 grama pewnego alkanu poddano całkowitemu spaleniu, a cały otrzymany w tej reakcji tlenek węgla(IV) pochłonięto w wodzie wapiennej, w której zaszła reakcja zgodnie z równaniem:
Otrzymany osad ważył po wysuszeniu 6 gramów. Ustal wzór sumaryczny tego alkanu. W obliczeniach zastosuj wartości masy molowej reagentów zaokrąglone do jedności.
Zadanie 144. (NR16)
Przygotowano dwa wodne roztwory kwasu metanowego (mrówkowego) o temperaturze t = 20 °C: roztwór pierwszy o pH = 1,9 i roztwór drugi o nieznanym pH. Stopień dysocjacji kwasu w roztworze pierwszym jest równy 1,33%, a w roztworze drugim wynosi 4,15%.
Na podstawie: Z. Dobkowska, K. Pazdro, Szkolny poradnik chemiczny, Warszawa 1990.
Oblicz pH roztworu, w którym stopień dysocjacji kwasu metanowego jest równy 4,15%. Wynik końcowy zaokrąglij do pierwszego miejsca po przecinku. Oceń, czy wyższa wartość stopnia dysocjacji kwasu w roztworze oznacza, że roztwór ten ma bardziej kwasowy odczyn.
Zadanie 145. (NR17)
W mieszaninie wodoru i azotu użytej do syntezy amoniaku zawartość wodoru wyrażona w procentach objętościowych jest równa 75%. Wydajność reakcji syntezy amoniaku przeprowadzonej w temperaturze T i pod ciśnieniem p jest równa 93%. Oblicz wyrażoną w procentach objętościowych zawartość amoniaku w mieszaninie poreakcyjnej.
Zadanie 146. (NR17)
Próbkę czystego węglanu wapnia o masie m prażono w otwartym naczyniu. Przebiegła wtedy reakcja zilustrowana równaniem:
CaCO3 → CaO + CO2
Po przerwaniu ogrzewania stwierdzono, że w naczyniu znajdowała się mieszanina substancji stałych o masie 18,0 gramów. Ustalono, że w tej mieszaninie zawartość węglanu wapnia wyrażona w procentach masowych jest równa 57,5%.
Oblicz masę m próbki węglanu wapnia poddanej prażeniu.
Zadanie 147. (NR17)
W temperaturze 25 °C wodny roztwór węglanu potasu o stężeniu 0,51 mol* dm−3 ma pH równe 12,0. Oblicz stałą dysocjacji zasadowej (stałą równowagi reakcji hydrolizy) anionu węglanowego. Uwzględnij fakt, że w wyrażeniu na stałą dysocjacji zasadowej anionu węglanowego pomija się stężenie wody.
Zadanie 148. (NR17)
Na próbkę stopu miedzi z cynkiem o masie 4,00 g podziałano 200 cm3 kwasu solnego o stężeniu 0,800 mol· dm–3. Przebiegła wtedy reakcja opisana równaniem:
Me + 2H3O + → Me2+ + H2 + 2H2O
Roztwór otrzymany po reakcji rozcieńczono wodą do objętości 250 cm3 . Stężenie jonów wodorowych w tym roztworze było równe 0,400 mol· dm–3. Oblicz, ile gramów miedzi znajdowało się w opisanej próbce stopu. Wynik końcowy zaokrąglij do drugiego miejsca po przecinku.
Zadanie 149. (NR17)
Podczas ogrzewania próbki monochloropochodnej pewnego nasyconego węglowodoru o budowie łańcuchowej z nadmiarem wodnego roztworu wodorotlenku sodu przebiegła reakcja zilustrowana schematem:
Do otrzymanej mieszaniny poreakcyjnej dodano najpierw wodny roztwór kwasu azotowego(V) w celu zobojętnienia, a następnie – nadmiar wodnego roztworu azotanu(V) srebra. W wyniku reakcji opisanej równaniem:
wytrącił się osad, który odsączono i wysuszono. Masa próbki monochloropochodnej była równa 0,314 g, a w wyniku opisanych przemian otrzymano 0,574 g stałego chlorku srebra. Wykonaj obliczenia i zaproponuj jeden wzór półstrukturalny (grupowy) chloropochodnej tego węglowodoru.
Zadanie 150. (NR17)
Gdy do zakwaszonego roztworu fenolu zawierającego nadmiar jonów bromkowych wprowadzi się bromian(V) potasu w nadmiarze w stosunku do fenolu, to wytworzony brom (w ilości równoważnej do bromianu(V) potasu) reaguje z fenolem zgodnie z równaniem (etap II)
:
Następnie do powstałej mieszaniny dodaje się jodek potasu. Brom, który nie został zużyty w reakcji bromowania, powoduje wydzielenie równoważnej ilości jodu (etap III):
Podczas kolejnego etapu (etapu IV) jod miareczkuje się wodnym roztworem tiosiarczanu sodu (Na2S2O3), co można zilustrować równaniem:
Oblicz stężenie molowe fenolu w próbce ścieków o objętości 100,0 cm3, jeżeli wiadomo, że w etapie I oznaczania zawartości fenolu powstało 0,256 grama bromu oraz że podczas etapu IV oznaczania tego związku na zmiareczkowanie jodu zużyto 14,00 cm3 roztworu tiosiarczanu sodu o stężeniu 0,100 mol · dm–3.
Zadanie 151. (NR18)
Gal występuje w przyrodzie w postaci mieszaniny dwóch izotopów. Na 3 atomy pierwszego izotopu galu o masie atomowej 68,926 u przypadają 2 atomy drugiego izotopu galu o masie atomowej mx. Średnia masa atomowa galu jest równa 69,723 u.
Na podstawie powyższych danych oblicz masę atomową mx drugiego izotopu galu. Wynik końcowy podaj z dokładnością do trzeciego miejsca po przecinku.
Na podstawie powyższych danych oblicz bezwzględną masę (wyrażoną w gramach) jednego atomu tego izotopu galu, który ma mniejszą masę atomową.
Zadanie 152. (NR18)
Oblicz wyrażoną w procentach masowych zawartość tlenu, wchodzącego w skład CO2 i CO, w pozostającej w równowadze mieszaninie tych związków z węglem w temperaturze 873 K i pod ciśnieniem 1013 hPa. Możesz przyjąć, że sumaryczna liczba moli gazowego substratu i gazowego produktu reakcji jest równa 1. W opisanych warunkach 1 mol gazu zajmuje objętość 71,6 dm3.
Zadanie 153. (NR18)
Rozpuszczono 0,600 g NaHSO4 w wodzie i otrzymano 100 cm3 roztworu o temperaturze T. W tym roztworze reakcji z wodą uległo znacznie więcej niż 5% jonów wodorosiarczanowych(VI). Oblicz pH tego roztworu. Wynik końcowy podaj z dokładnością do trzeciego miejsca po przecinku.
Zadanie 154. (NR18)
Dwa gazy A i B zmieszane w stosunku molowym A B n n: 1:4 = zajmują w warunkach normalnych objętość 1 dm3 . Tę mieszaninę umieszczono w reaktorze o stałej pojemności 1 dm3 i w temperaturze T zainicjowano reakcję. W tej temperaturze ustalił się stan równowagi opisany równaniem:
A (g) + 2B(g) ⇄ 2C(g) ΔH < 0
W stanie równowagi stężenie substancji C było równe 0,004 mol · dm–3.
Oblicz stężeniową stałą równowagi (Kc) opisanej reakcji w temperaturze T.
Zadanie 155. (NR18)
W temperaturze 20 °C rozpuszczalność uwodnionego wodorosiarczanu(VI) sodu o wzorze NaHSO4 · H2O jest równa 67 gramów w 100 gramach wody.
Na podstawie: T. Mizerski, Tablice chemiczne, Warszawa 2004.
Oblicz, jaki procent masy roztworu nasyconego o temperaturze 20 °C stanowi masa soli bezwodnej NaHSO4.
Zadanie 156. (NR18)
Do całkowitego spalenia 2,80 dm3 (odmierzonych w warunkach normalnych) mieszaniny zawierającej 60% objętościowych pewnego gazowego alkanu i 40% objętościowych metanu potrzeba 13,16 dm3 tlenu w przeliczeniu na warunki normalne. Reakcje całkowitego spalania metanu oraz dowolnego alkanu przebiegają zgodnie z równaniami:
Wykonaj niezbędne obliczenia i podaj wzór sumaryczny alkanu stanowiącego 60% objętości opisanej mieszaniny.